流式细胞术检测循环血骨髓瘤细胞的研究进展①
王显凤 陈文明
(首都医科大学附属朝阳医院血液科,北京100020)
多发性骨髓瘤(Multiple myeloma,MM)是恶性浆细胞在骨髓内恶性增殖和广泛浸润的一种血液系统肿瘤,具有高度异质性,目前尚不能治愈。MM诊断及残留病灶监测现阶段主要依赖骨髓(Bone marrow,BM)穿刺样本进行分析,但骨髓穿刺有创伤,骨髓稀释或骨髓瘤病灶分布不均可导致不同穿刺部位的结果相差较大。
有研究表明MM循环骨髓瘤细胞(Circulating myeloma cells,CMCs)具有独特的免疫表型、细胞遗传学及功能[1-3]。它的优点在于分布均匀,获取简单且创伤小。而流式细胞术具有可分析数量大、敏感性高、多参数分析、客观、准确、快速的优点,伴随着二代流式(Next generation flow,NGF)的出现,敏感性高达10-6,能进一步提高CMCs的检出率[4]。因此利用多参数流式细胞术(Multiparameter flow cytometry,MFC)检测CMCs有利于监测MM疾病的进展、治疗疗效和判断预后,使其在临床及科研中具有广阔的应用前景,现有医疗机构对检测CMCs的免疫表型所采取的检测方案并未统一,对检测CMCs应用前景等存在争议,对CMCs的生物学特征、病理生理机制仍不清楚。本文就CMCs的免疫表型、预后意义及临床应用的研究进展进行综述。
1 循环骨髓瘤细胞的免疫表型特征
浆细胞(Plasma cells,PCs)为外周淋巴器官中成熟B淋巴细胞在抗原刺激下分化增殖释放到外周血(Peripheral blood,PB),再返回BM中分化成一种不再具有分化增殖能力的终末细胞。BM中正常浆细胞(Normal plasma cells,NPCs)主要表达CD19+CD27++CD81+CD200+/dimCD45++CD38+++CD138+,胞浆轻链呈非限制性表达,小部分NPCs表达CD45-CD56+CD81-,约1/3 NPCs表达CD19-CD56-CD117-,通常不表达B细胞相关抗原,如CD20、CD22和膜免疫球蛋白(smIg)[5-8]。
1962年Ginsberg等[9]证实MM患者PB中能检测到PCs,大量研究报道CMCs的免疫表型,主要表达CD38、CD138,67%表达CD56、96%不表达CD19,CD45一般呈阴性表达,胞浆免疫球蛋白轻链呈限制性表达[1,10,11],有学者用CD38、CD56、CD19、CD45、CD138、CD37等抗体对MM患者BPPCs与BMPCs的免疫表型进行了比较,发现除CD56、CD138在外周血中的表达水平较骨髓低外,两者具有相同的复合免疫表型,同时证实CMCs CD19、CD38、CD45表达水平较NPCs低[10],2016年Muz等[12]研究证实CD138在CMCs中呈弱阳或阴性表达。2013年Paiva等[1]对CMCs免疫表型做进一步研究,发现CMCs低表达整合蛋白、黏附分子、活化分子,比如CD11a、CD11c、CD29、CD49d、CD49e、CD33、CD56、CD117、CD28、CD81等。可见NPCs、骨髓中骨髓瘤细胞(Myeloma cell,MCs)、CMCs抗原表达不尽相同(见表1),可依据不同抗原表达情况区分良恶性浆细胞。有研究报道CD56、CD117表达与骨髓外浸润及预后较差有关,CD200阴性表达与MM患者无事件生存期有关[13-15]。Paiva等[1]还证实CMCs与BM基质细胞共培养时,CMCs大部分处于静止状态,这一特性可能与其高度克隆潜能有关,可能代表一种独立的骨髓亚克隆浆细胞。
综上,CD38、CD138、CD19、CD56、CD45、胞浆免疫球蛋白轻链是区分良恶性浆细胞的重要免疫标记,已逐步被人们接受,逐渐应用于临床。其他表面分子如CD1la、CD28、CD33、CD117、CD200等也同样受到了一些学者的关注,相关免疫标记在CMCs上的应用前景还需深入探索。
表1比较正常浆细胞、骨髓瘤细胞、循环骨髓瘤细胞的免疫表型
Tab.1AcomparisonofphenotypesofNPCs,MCsandCMCs
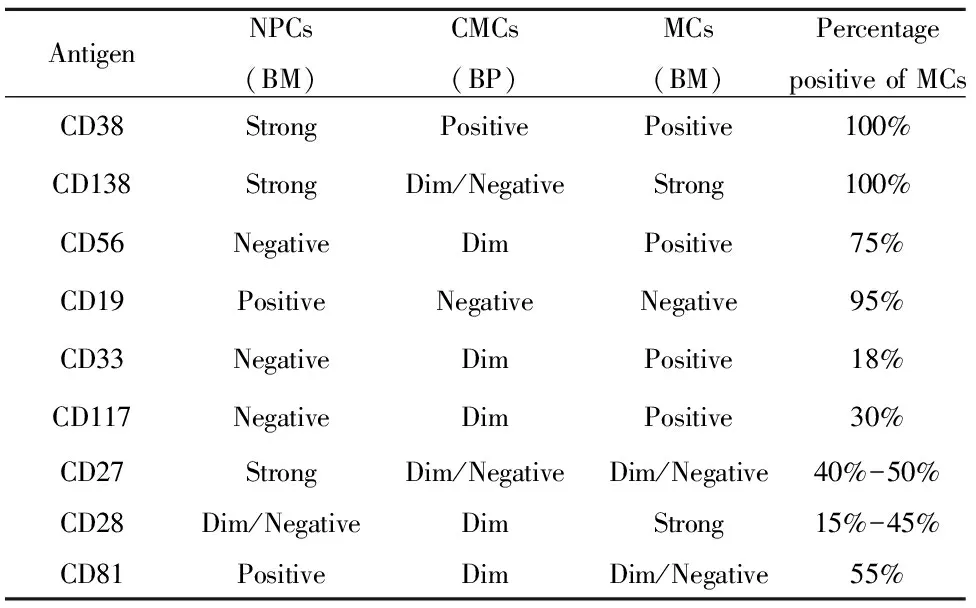
AntigenNPCs(BM)CMCs(BP)MCs(BM)Percentagepositive of MCsCD38StrongPositivePositive100%CD138StrongDim/NegativeStrong100%CD56NegativeDimPositive75%CD19PositiveNegativeNegative95%CD33NegativeDimPositive18%CD117NegativeDimPositive30%CD27StrongDim/NegativeDim/Negative40%-50%CD28Dim/NegativeDimStrong15%-45%CD81PositiveDimDim/Negative55%
2 浆细胞设门及抗体选择
抗体的选择对于确定浆细胞的免疫表型、检测的可重复性及敏感性都非常关键,尤其是对于含量较低的CMCs,然而设置统一的设门策略也非常必要。由于部分异常浆细胞CD38表达较弱[1,5,10],如果仅用CD38和SSC设门,易出现假阴性结果;用CD38和CD138设门,可以提高浆细胞的检出率,但易混有前体B细胞,影响浆细胞异常免疫表型的分析;用CD38和CD45可以减少其他细胞成分,但CD45阳性的恶性浆细胞也容易被遗漏;在此基础上欧洲骨髓瘤组(European Muhiple Myeloma Network,EMMN)于2008年在MM免疫分型的设门策略达成一致,中国免疫学会血液免疫分会临床流式细胞术学组于2017年在浆细胞肿瘤残留检测的设门策略上达成一致,两者一致认为分析时联合使用CD38、CD138、CD45和SSC共同设门,可达到最佳检出率,同时建议CD38、CD138、CD45应至少在一管中同时检测,如果使用双变量分析,第一个门应该用CD38和CD138设门,确保不遗漏CD45阴性的浆细胞组分,其他管最好也选用CD38和CD138[5,16]。
同时国内外专家共识认为在定义异常浆细胞免疫表型时,不能依赖于单个或少量标记来确定,无论是MM诊断还是MM-MRD监测[5,16]。EMMN认为应用CD38、CD138、CD19、CD56可以区分至少90%的浆细胞,联合CD27、CD28、CD117、CD20可以增加至95%,再联合胞浆Kappa与Lambda,检出率可达100%[3,12]。目前关于是否需要检测胞浆Kappa与Lambda,国内外仍存在争议,因为检测胞浆免疫球蛋白轻链需要洗涤、透膜,步骤较多,易造成细胞的丢失,因此国外的有些学者认为在膜抗体检测数量足够多的情况下可以不用检测胞浆抗体,但国内学者认为,胞浆免疫球蛋白轻链的限制性表达对于确定克隆性浆细胞是最直接的证据,在使用抗体相对较少时,建议进行检测[16]。综上对于CMCs检测,如何选择最佳抗体及分析方法还需深入研究。
3 循环骨髓瘤细胞的检测方法
根据多发性骨髓瘤细胞的形态学特点及遗传免疫学特点,用于检测浆细胞的手段有光学显微镜、电子显微镜观察外周血涂片中的浆细胞,免疫荧光显微技术、PCR技术和流式细胞术等方法检测特异性标记物。
由于外周血浆细胞数量较少,单纯采用形态学检测阳性率极低,目前已很少使用。1996年Joshua等[17]采用溴脱氧尿苷荧光免疫标记技术和流式细胞仪分析CD38强阳细胞,并对这两种方法检测的65例样本浆细胞标记指数(Plasma cell labeling index,PCLI)进行了比较,结果前者PCLI平均值较后者PCLI平均值低,研究结果说明后者敏感性明显高于前者。Rawstron等[10]分别采用CD38单抗通过流式细胞仪检测外周血浆细胞和IgH-PCR免疫荧光技术检测瘤细胞的方法,并对两者结果进行比较,结果提示两者有很好的一致性,IgH-PCR检测结果为阳性的流式细胞术结果均为阳性,IgH-PCR检测结果阴性的流式细胞术检测结果均为阴性,结果显示流式细胞仪免疫标记能作为检测浆细胞的定量手段。2015年Sanoja-Flores等[4]用NGF检测21例MM、5例SMM、37例MGUS、8例孤立性浆细胞瘤患者的循环浆细胞,在SMM、MM、60%MGUS患者的BP中均能检测到CMCs,三者的CMCs百分比中位值依次为0.002 6%、0.003 3%、0.000 2%,证实NGF检测敏感性可达10-6。2016年Muz等[12]研究发现检测CMCs时联合CD38、CD3、CD14、CD16、CD19、CD123抗体可以提高CD138弱阳性或阴性CMCs的检出率。2018 Kamande等[18]应用流式细胞分选仪检测9例MGUS、11例SMM、19例有症状MM及9例治疗后MM患者的CMCs,除1例MGUS未检测到CMCs外,其余CMCs均阳性,各组均值分别为62.4个/ml、68.8个/ml、818.4个/ml、169.3个/ml,有症状MM的CMCs均值明显高于其他3组,研究显示通过细胞分选法能提高CMCs的检出率。不同的检测方案、不同疾病状态对CMCs的检出率存在影响,NGF、流式分选对MM中CMCs的检出率可达100%,同时应用流式分选可提高MGUS中CMCs的检出率(见表2)。
综上可见流式细胞术具有高灵敏性、准确性以及快速、简便的特点,并且与免疫荧光显微技术、PCR技术等检测手段有很好的一致性[4,10,17,18],其敏感性高于细胞形态学、免疫荧光技术。因此目前采用流式细胞仪检测CMCs在临床及科研领域已逐步得到应用。
4 循环骨髓瘤细胞的预后价值
CMCs不仅能反映肿瘤负荷、疾病活动状态,还能预测初治、复发、缓解状态或移植后患者的总体生存期(Overall survival,OS)、无进展生存期(Progression free survival,PFS),同时CMCs是促进冒烟型多发性骨髓瘤(Smoky multiple myeloma,SMM)进展成MM的危险因素,也是患者危险分层的重要依据[11,19-26],因此检测CMCs对MM患者有非常重要的意义。
1993年Witzig等[20]用免疫荧光显微技术检测了84例患者的CMCs(35例初治MM、26例复发MM、10例MGUS、13例SMM),将MGUS与SMM归为疾病无活动性状态,初治MM及复发MM归为活动性状态,结果显示后者CMCs高于前者,处于疾病活动状态的61例患者,复发MM CMCs中位值高于初治MM CMCs中位值,显示CMCs与疾病的活动性密切相关;取3×106L-1作为临界值进一步分析,CMCs>3×106L-1时占疾病处于活动性状态的67%(41/61),CMCs<3×106L-1时占疾病无活动性状态的96%(22/23),再次证明CMCs能预测疾病的活动状态。研究表明,CMCs是预测MM患者OS的重要预后因素。2014年Gonsalves等[25]使用MFC分析了157例初治MM患者的PBPCs,发现CMCs阴性组OS比CMCs阳性组明显延长(P=0.019),CMCs阴性组患者2年、3年OS分别为91%、87%,CMCs阳性组患者2年、3年OS分别为76%、67%。同年Gonsalves等[19]用同样的方法分析了145例复发患者CMCs,得到了相似的结论。2018年Foulk等[2]研究缓解期MM患者,证实低CMCs组的总体生存期比高CMCs组更受益,进一步证实CMCs与生存期呈负相关,CMCs高预示生存期短。多篇文献报道CMCs影响移植后患者生存期[27,28],2016年Chakraborty等[27]用流式细胞术分析了840例接受ASCT的MM患者CMCs,结果显示CMCs阴性组的移植后严格完全缓解率、PFS、OS的中位值比CMCs阳性组高。2018 年Cowan等[28]做了类似研究,发现CMCs影响移植后MM患者的生存期,结果显示CMCs阴性组PFS较CMCs阳性组延长(P=0.031),证实了Chakraborty的结论,但发现OS无差异,接受ASCT后达完全缓解组中CMCs阴性组PFS较CMCs阳性组延长,在VGPR或疗效更好的MM患者中,CMCs阴性组PFS较CMCs阳性组延长(P=0.04),证实CMCs是高风险MM群体的独特因素。多篇文献报道CMCs是导致SMM进展为MM的重要因素,2013年Bianchi等[22]利用免疫荧光法研究了171例SMM患者,结果显示高CMCs是SMM进展为MM的危险因素。2016年Gonsalves等[26]用MFC分析100例SMM患者的CMCs,结果显示CMCs阴性SMM组的最短疾病进展中位值比CMCs阳性组的明显延长,58%CMCs阳性的SMM在24月内进展为MM,仅有9%CMCs阴性的SMM进展为MM;取150个CMCs作为临界值进一步分析,结果显示低CMCs组的最短疾病进展中位值比高CMCs组的明显延长,研究结果进一步证实Bianchi的观点,2018年Foulk等[2]的研究结果同样证实这一观点。因此检测SMM中CMCs有利于医生及早采取有针对性的治疗。
表2比较流式细胞仪检测MM、SMM、MGUS中CMCs的阳性率
Tab.2AcomparisonofpercentagepositiveofCMCsinMM,SMMandMGUSbyflowcytometry
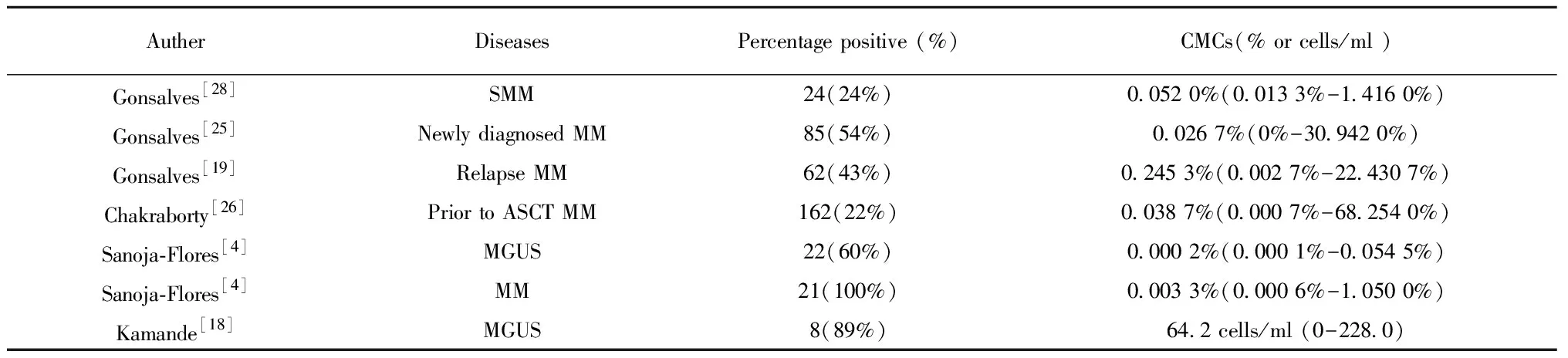
AutherDiseasesPercentage positive (%)CMCs(% or cells/ml )Gonsalves[28]SMM24(24%)0.052 0%(0.013 3%-1.416 0%)Gonsalves[25]Newly diagnosed MM85(54%)0.026 7%(0%-30.942 0%)Gonsalves[19]Relapse MM62(43%)0.245 3%(0.002 7%-22.430 7%)Chakraborty[26]Prior to ASCT MM162(22%)0.038 7%(0.000 7%-68.254 0%)Sanoja-Flores[4]MGUS22(60%)0.000 2%(0.000 1%-0.054 5%)Sanoja-Flores[4]MM21(100%)0.003 3%(0.000 6%-1.050 0%)Kamande[18]MGUS8(89%)64.2 cells/ml (0-228.0)
5 存在的问题及展望
综上研究证实CMCs在判断疾病活动程度、疾病疗效及进展、生存期方面有着不可忽视的作用,应用流式细胞术检测CMCs在未来具有良好的临床应用前景,但目前对于CMCs研究仍存在问题,尚需深入探索。首先CMCs检测目前国内外尚未建立统一方案,因此未来研究应进一步规范统一检测方案,使不同研究机构的结果更具有说服力和参考性;其次NGF检测值≥10-6时,检测值是否具有特异性,仍然需要临床验证;最后CMCs的生物学特征、病理生理机制仍不清楚,未来仍需致力于CMCs的基础研究。未来能否将CMCs纳入预后分层体系,CMCs能否替代骨髓的检测尚需大量的临床研究证实。