miR-140-5p调控类风湿关节炎滑膜成纤维细胞增殖和侵袭机制的研究
程 龙 徐五琴 张 鹏 黄建军 李小宁
(皖南医学院弋矶山医院检验科,芜湖241001)
类风湿关节炎(Rheumatoid arthritis,RA)是一种以炎性滑膜炎为主的慢性自身免疫性疾病,具有较高的致残率,严重影响患者生活质量[1-3]。RA的发生与多种细胞内因子及蛋白的表达水平异常有关[4-7]。SFs的主要功能是为关节腔及周围软骨提供营养及润滑。研究发现,RA患者关节内SFs会出现代谢异常活跃现象,可过量分泌IL-1等炎症因子,诱发RA组织破坏[8]。microRNAs(miRNAs)是一种类似于siRNA的小分子RNA,只在特定的组织和发育阶段表达,具有调节细胞生长及发育过程的作用[9]。miRNA的表达对RA的发生及发展有重要影响[10]。miR-140-5p是miRNAs中的一种,类风湿关节炎模型大鼠破骨样细胞分化后期存在miR-140-5p表达失调现象,提示其在机体内表达水平与RA形成有关[11]。研究发现,miR140-5p可通过调节TLR4的表达抑制RASFs的增殖及其炎症因子的分泌[12]。因此,本研究分析了miR-140-5p对RASFs增殖、侵袭的影响及相关机制,以期为RA的治疗提供临床依据。
1 资料与方法
1.1资料 我院骨科行关节置换术的RA患者,入选患者临床诊断均符合美国风湿病学会2010版《类风湿关节炎新的分类标准及其方法学》中关于RA的诊断标准并签署知情同意书。抗β-肌动蛋白抗体(上海安研商贸有限公司);总RNA提取试剂盒(北京百泰克生物技术有限公司);QuantStudio Dx实时定量PCR仪(中山大学达安基因股份有限公司);激光共聚焦显微镜(北京普瑞赛司仪器有限公司);miR-140-5p mimic(北京英格恩生物科技有限公司);BeyoECL Star 特超敏ECL化学发光试剂盒、MTT细胞增殖检测试剂盒(碧云天生物技术有限公司);培养基(上海哈灵生物科技有限公司);胰蛋白酶、羊抗兔二抗(赛默飞世尔科技有限公司);PBS缓冲溶液(北京索莱宝科技有限公司);CO2细胞培养箱(上海茸研仪器有限公司);transwell小室(北京萌壮科技有限公司);蛋白提取试剂盒(江苏凯基生物技术股份有限公司);兔抗TLR4(艾美捷科技有限公司)。
1.2方法
1.2.1RASFs体外培养 术中取出入选患者关节滑膜组织,2 h内于无菌条件下剪碎,37℃条件下使用3.0 g/L胰蛋白酶消化2 h,1 000 r/min离心10 min,收集细胞,置于培养基中形成细胞悬浮液,将悬浮液置于37℃的5%CO2培养箱中培养。当培养皿中细胞覆盖率达到80%~90%时即可传代,选取第3~5代细胞用于实验。
1.2.2细胞分组与处理 本次实验共分3组:空白对照组、脂质体对照组及miR-140-5p mimic组。脂质体对照组使用脂质体2000为载体转染入滑膜细胞;miR-140-5p mimic组使用脂质体2000为载体将 miR-140-5p转染入滑膜细胞,混匀后于37℃的5%CO2培养箱中孵育。
1.2.3qPCR检测 按照总RNA提取试剂盒说明书操作提取细胞总RNA。经过反转录合成第1链cDNA,PCR扩增,PCR检测。设定PCR程序:94℃预变性5 min,94℃循环1 min,60℃1 min,72℃ 3 min,扩增32个循环,72℃ 5 min。依据2-ΔΔCt法计算各样本mRNA的相对表达量。利用 Primer5.0软件设计引物。引物由上海剑钝生物科技有限公司合成。引物序列见表1。
1.2.4MTT法检测增殖情况 按照四甲基偶氮唑蓝(MTT)试剂盒说明书操作,测定细胞增殖率。吸取300 μl处于对数期生长的RASFs浓度为3×104个/ml的细胞悬液,接种于96孔板,每孔约9×103个细胞,加入miR-140-5p mimic混匀后,置入饱和湿度、37℃、5%CO2培养箱中培养36 h,每孔加入10 μl 5 mg/L的MTT溶液,继续培养4 h;弃去上清液,加入100 μl二甲基亚砜,置于摇床低速振荡10 min,待反应结晶物充分溶解后,于酶标仪上测定波长570 nm处各孔A值。
1.2.5Transwell法检测侵袭能力 取处于对数生长期的各组细胞,用无血清DMEM重悬,并调整细胞浓度至1×108个/L。以孔径为8 μm的聚碳酸酯微膜孔分隔上下室,上室滤膜上层铺盖Matrigel。吸取500 μl含10%血清的DMEM加入下室,加300 μl细胞悬液于内室,37℃、5%CO2培养箱中培养24 h,取出聚碳酸酯微膜,PBS洗涤2次。固定后利用结晶紫染色20 min,显微镜观察计数,取平均值。
1.2.6Western blot检测TLR4 PBS洗涤3次后采用细胞裂解法提取各组细胞总蛋白。采用邻苯三酚红钼法检测总蛋白。行SDS-PAGE 蛋白电泳;结束后转印至硝酸纤维素膜上,5%脱脂奶粉封闭3 h,加兔抗TLR4(1∶500),4℃条件下孵育过夜,次日洗膜后加通用二抗(1∶1 000),室温条件下孵育2 h。洗膜后酶显法显色,凝胶呈现系统扫描成像。以β-actin作为内参照,分析所得条带灰度值。
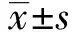
表1PCR引物序列
Tab.1PCRprimer
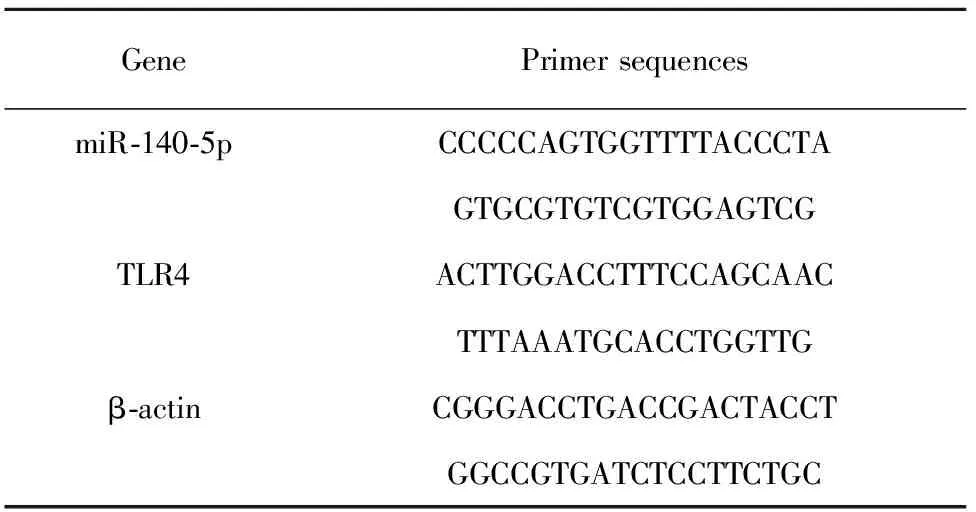
GenePrimer sequencesmiR-140-5pCCCCCAGTGGTTTTACCCTAGTGCGTGTCGTGGAGTCGTLR4ACTTGGACCTTTCCAGCAACTTTAAATGCACCTGGTTGβ-actinCGGGACCTGACCGACTACCTGGCCGTGATCTCCTTCTGC
2 结果
2.1转染情况比较 与空白对照组比较,脂质体对照组RASFs中miR-140-5p表达水平无明显变化(P>0.05)。miR-140-5p mimic组RASFs中miR-140-5p的表达水平为2.49±0.19 ,明显高于空白对照组,差异有统计学意义(P<0.05),见表2。
2.2miR-140-5p对RASFs增殖和侵袭的影响 增殖检测结果显示:与空白对照组比较,脂质体对照组中RASFs增殖情况无明显变化,P>0.05。miR-140-5p mimic组中RASFs增殖受到明显抑制,A值为0.42±0.03,明显低于空白对照组和脂质体对照组,差异有统计学意义(P<0.05)。侵袭检测结果显示:与空白对照组比较,脂质体对照组中RASFs侵袭能力无明显变化,P>0.05。miR-140-5p mimic组中RASFs侵袭能力受到明显抑制。穿膜细胞数为 49.27±6.18,明显低于空白对照组,差异有统计学意义(P<0.05),见表3、4和图1。
表2各组RASFs中miR-140-5p表达水平
Tab.2ExpressionofmiR-140-5pinRASFsofeachgroup

GroupsTLR4Blank control group1.02±0.11Liposome control group1.04±0.10miR-140-5p mimic group2.49±0.191)
Note:Compared with blank control group,1)P<0.05.
表3miR-140-5p对RASFs增殖的影响
Tab.3EffectofmiR-140-5ponproliferationofRASFs
Note:Compared with blank control group,1)P<0.05.
表4miR-140-5p对RASFs侵袭的影响
Tab.4EffectofmiR-140-5poninvasionofRASFs
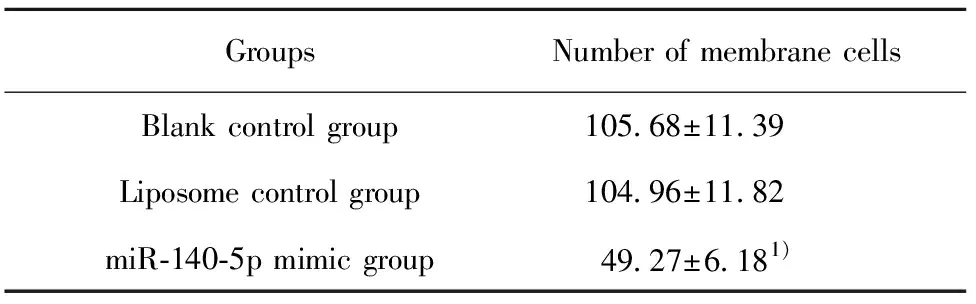
GroupsNumber of membrane cellsBlank control group 105.68±11.39Liposome control group 104.96±11.82miR-140-5p mimic group 49.27±6.181)
Note:Compared with blank control group,1)P<0.05.
2.3miR-140-5p对TLR4表达水平的影响 将miR-140-5p转染RASFs后,与空白对照组比较,脂质体对照组RASFs中TLR4 mRNA和蛋白表达水平无明显变化(P>0.05)。miR-140-5p mimic组RASFs中TLR4 mRNA和蛋白表达水平明显低于空白对照组,差异有统计学意义(P<0.05)。见表5、6、图2。

图1 miR-140-5p对RASFs侵袭的影响
表5miR-140-5p对各组RASFs中TLR4mRNA表达水平的影响
Tab.5EffectofmiR-140-5ponexpressionofTLR4mRNAinRASFsofeachgroup

GroupsTLR4 mRNABlank control group3.56±0.41Liposome control group3.61±0.45miR-140-5p mimic group1.82±0.291)
Note:Compared with blank control group,1)P<0.05.
表6miR-140-5p对各组RASFs中TLR4蛋白表达水平的影响
Tab.6EffectofmiR-140-5ponexpressionofTLR4proteininRASFsofeach

GroupsTLR4 proteinBlank control group1.02±0.10Liposome control group 1.03±0.11miR-140-5p mimic group0.43±0.051)
Note:Compared with blank control group,1)P<0.05.
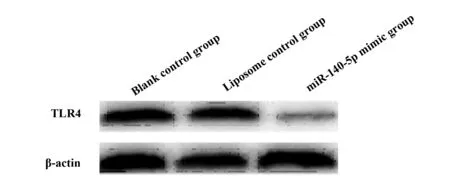
图2 miR-140-5p对各组RASFs中TLR4蛋白表达水平的影响
3 讨论
类风湿关节炎为临床常见慢性疾病,其特征是手、足小关节的多关节、对称性、侵袭性关节炎症,可伴有关节外器官受累及免疫功能指标表达异常,导致关节畸形及功能丧失[13,14]。
类风湿关节炎为免疫性疾病,Toll样受体为免疫跨膜信号转导受体,可激发启动机体免疫反应。Toll样受体存在于RA滑膜组织及外周血单核细胞中,其中TLR4与RA发病关系密切,TLR4可与内源性损伤因子细胞膜结合,促进炎症因子的释放[15]。滑膜直接附着于关节软骨边缘,可分泌滑液,在关节活动中起重要作用,而RA患者滑膜细胞的信号传导存在异常。SFs具明显的蛋白质合成和分泌活动,对不同程度的细胞变性、坏死和组织缺损以及骨创伤的修复有着十分重要的作用。microRNA调节着人类约三分之一的基因,可通过参与细胞增殖、细胞凋亡、细胞分化等,调控多种恶性肿瘤细胞的增殖[16-18]。
研究表明,miR-140-5p的表达与大鼠膝关节软骨组织再生及预防膝关节骨性关节炎有密切的关系[19]。SFs中microRNA 140-3p和microRNA 140-5p失调可导致骨关节炎严重程度的加深[20]。因此推断microRNA 140-3p和microRNA 140-5p的表达可在RA进程中起到一定的保护作用。本研究选取microRNA 140-5p为研究对象,观察了其对RASFs增殖及侵袭能力的影响。
转染实验结果显示:miR-140-5p mimic组RASFs中miR-140-5p的表达水平明显高于空白对照组(P<0.05),提示本次转染成功增殖及侵袭实验结果显示,miR-140-5p mimic组中RASFs增殖及侵袭能力明显低于空白对照组(P<0.05)。提示miR-140-5p过表达,可明显抑制RASFs的增殖及侵袭能力。
为了进一步研究miR-140-5p对RASFs生理功能影响的作用机制,本实验对各组TLR4蛋白及其mRNA的表达进行了检测。TLR4是脂多糖的受体,可通过选择性识别病原体,激活天然免疫,引起局部炎症,在RA患者外周血单核细胞中呈现高表达[21]。将miR-140-5p转染RASFs后,qPCR及Western blot分析结果显示,与空白对照组比较,脂质体对照组RASFs中TRL4 mRNA、TLR4蛋白表达水平无明显变化,P>0.05。miR-140-5p mimic组RASFs中TLR4 mRNA、TLR4蛋白表达水平明显低于空白对照组,差异有统计学意义,P<0.05。表明miR-140-5p过表达可下调TLR4蛋白的表达水平。研究表明,复方芪芎颗粒可通过下调TLR4蛋白的表达,起到抑制佐剂型关节炎大鼠的关节炎症表现[22]。推测可能是由于miR-140-5p的过表达,导致TLR4蛋白表达降低,对滑膜细胞的增殖起到有效的抑制。
综上所述,miR-140-5p可有效抑制RASFs增殖及侵袭能力,在RA的发生中起着重要作用,其机制可能与下调TLR4的表达有关。