磷酸化扁藻胞外多糖的修饰及其抗肿瘤活性研究
易志恒,翁正芬,温俊昊,刘梓茂,罗 辉,2,3,吴斌华,2,3*
(1.广东医科大学海洋医药研究院、广东省天然药物研究与开发重点实验室和第一临床医学院;2.南方海洋科学与工程广东省实验室;3.广东湛江海洋医药研究院,广东湛江 524023)
多糖的生物活性与其分子结构有关,对多糖分子结构进行修饰,可以提高多糖的活性[1]。分子修饰方法有多种,其中主要是化学修饰。化学修饰的常见方法包括硫酸化修饰、烷基化修饰、羧甲基化修饰、磷酸化修饰等[2]。本文通过参考多糖磷酸化修饰的相关文献[2-6],选取影响扁藻多糖磷酸(PEPs)根含量和多糖产量的4 个因素进行研究,通过正交设计初步确定了扁藻多糖磷酸化的最佳工艺条件,并初步探讨磷酸化扁藻胞外多糖(pPEPs)的抗肿瘤活性,旨在为磷酸化扁藻胞外多糖的研究和开发提供理论依据和实验基础。
1 材料和方法
1.1 仪器与试剂
RE-5210A 旋转蒸发仪(上海荣生生化仪器厂)、JXN-300 冷冻离心机(美国Beckman 公司)、FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司)、IRTracer-100 傅立叶红外吸收光度计(日本岛津公司)、Epoch 酶标仪(BioTek Instrument)等。PEPs(由本实验室提取获得),三偏磷酸钠(分析纯,上海麦克林生化科技有限公司),三聚磷酸钠(分析纯,天津市大茂化学试剂厂),三羟甲基氨基甲烷、氯化镁、盐酸、维生素C、硫酸、钼酸铵、磷酸二氢钾、过氧化氢等试剂均为市售分析纯。
1.2 方法
1.2.1 pPEPs 的制备 参考郑常领等[3]的方法,略作修改。按比例称取磷酸化试剂(6 g 三聚磷酸钠+1 g 三偏磷酸钠)共7 g,溶解在超纯水中,定容至100 mL,得到总质量浓度为70 g/L 的磷酸化试剂。定容后加入精制的PEPs 1 g,硫酸钠5 g,调节pH 值和温度至设定值后进行磷酸化反应。反应结束后,用3 倍体积的95%乙醇溶液静置沉淀24 h,5 000 r/min 离心10 min 收集沉淀,置于45 ℃的环境下2 h,以去除残留的乙醇,再于50 ℃水浴中复溶,后装入截留分子量为1 000 透析袋,透析2 d。得到的溶液预冻后置于冷冻干燥机中冷冻干燥,得到pPEPs。
1.2.2 磷酸根含量的测定(1)磷酸根标准曲线测定:根据钼蓝比色法[4]绘制磷酸根含量标准曲线,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。(2)pPEPs中的磷酸根测定:取0.10 g 样品于烧杯中,加入1 mL浓硫酸和1 mL 浓硝酸,加热至冒烟,冷却后加入1 mL体积分数为30%的 H2O2溶液,再缓慢加热,重复以上步骤直至烧杯内不再冒烟,溶液呈无色透明或淡黄色,冷却后加入1 mL 浓度为6 mol/L 盐酸,加热使酸彻底分解,转移至50 mL 容量瓶中定容。取适量上述溶液,按照标准曲线操作方法测定吸光度,根据标准曲线回归方程计算磷酸根含量。
1.2.3 PEPs 磷酸化反应正交实验 参考相关文献[2-7],采用正交试验设计方法,选取磷酸化实验中磷酸化试剂比例(A)、温度(B)、时间(C)和pH(D)为考察因素,每个因素选取3 个水平(见表1),选用L9(34)正交表进行正交实验。
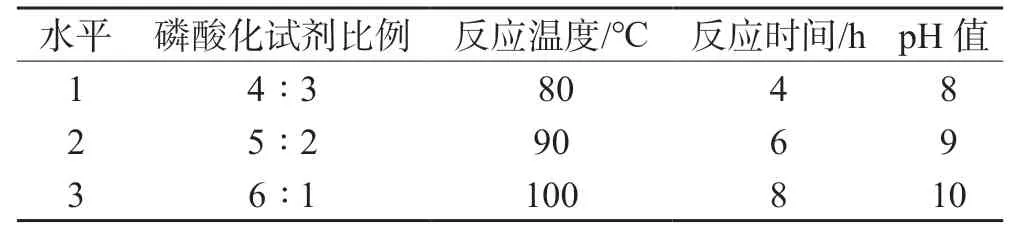
表1 正交实验因素与水平
1.2.4 红外光谱分析 使用傅立叶变换红外光谱仪测定多糖的红外光谱。PEPs 及其磷酸化产物分别与干燥的溴化钾研磨均匀后压片,在4 000~500/cm 的波长范围内进行测量。
1.2.5 MTT 实验 采用MTT 法进行检测pPEPs 对肿瘤细胞的活性,检测方法参考相关文献[8-10]。用胰酶消化处于对数生长期、状态良好的小鼠Raw264.7 巨噬细胞,然后重悬。接种于96 孔培养板内,使每孔细胞密度为1×104个,置于5% CO2、37 °C 培养箱中培养16 h使其贴壁,正常细胞对照组加等量细胞和培养液正常培养,空白对照组加等量培养基而不加细胞,给药组给予PEPs 和pPEPs,质量浓度分别为50、100、150、200、250 mg/L,每个质量浓度设置5 个复孔,药物与细胞作用24 h,每孔加入20 μL 的MTT 溶液(5 g/L),并继续放到培养箱中培养4 h;培养结束后弃去上清,每个复孔加入150 μL 的DMSO 溶液,用锡纸包裹避光,于摇床上震荡10 min 使结晶彻底溶解。采用酶标仪检测570 nm 处各孔吸光度值(OD)。细胞存活率=(OD样品-OD空白)/(OD对照-OD空白)×100%。
1.3 统计学处理
采用SPSS23.0 软件分析,极差分析寻找各水平因素对多糖产率及多糖磷酸根含量的影响,极差较大的因素为对该因变量影响较大的因素。采用Graphpad Prism 8.0 软件分析MTT 实验结果,组间比较采用t检验、单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 标准曲线
根据钼蓝比色法绘制的磷酸根含量标准曲线,结果如图1 所示。标准曲线方程为y=19.265x+0.0214,相关系数0.9876,显示相关性良好。
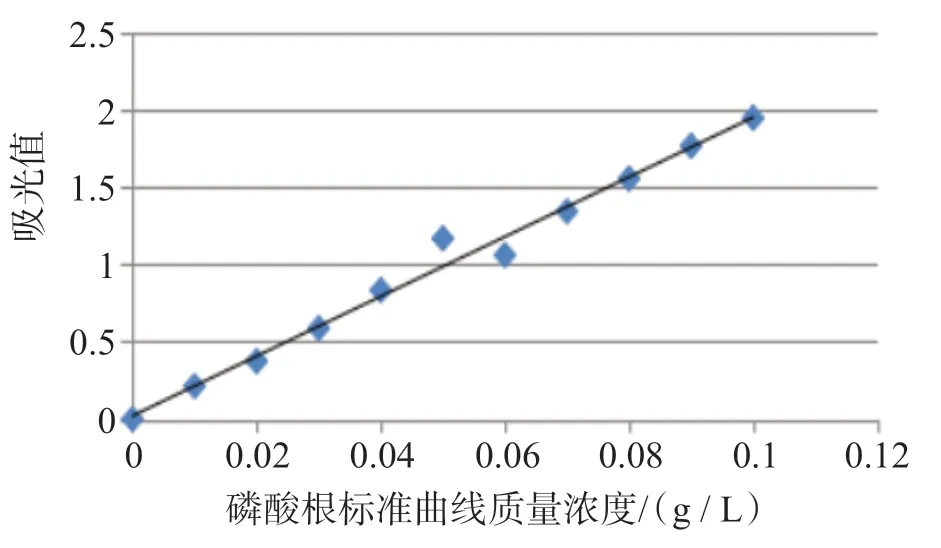
图1 磷酸根标准曲线
2.2 扁藻胞外多糖磷酸化反应正交实验
以产率为指标的结果显示:影响因素B>A>D>C;以磷酸根含量为指标的结果显示:影响因素B>D>A>C。综合两个指标的影响,确定当磷酸化试剂比例为6∶1,反应温度为100 ℃、反应时间为6 h、反应pH=8 时为最佳的反应条件,见表2。
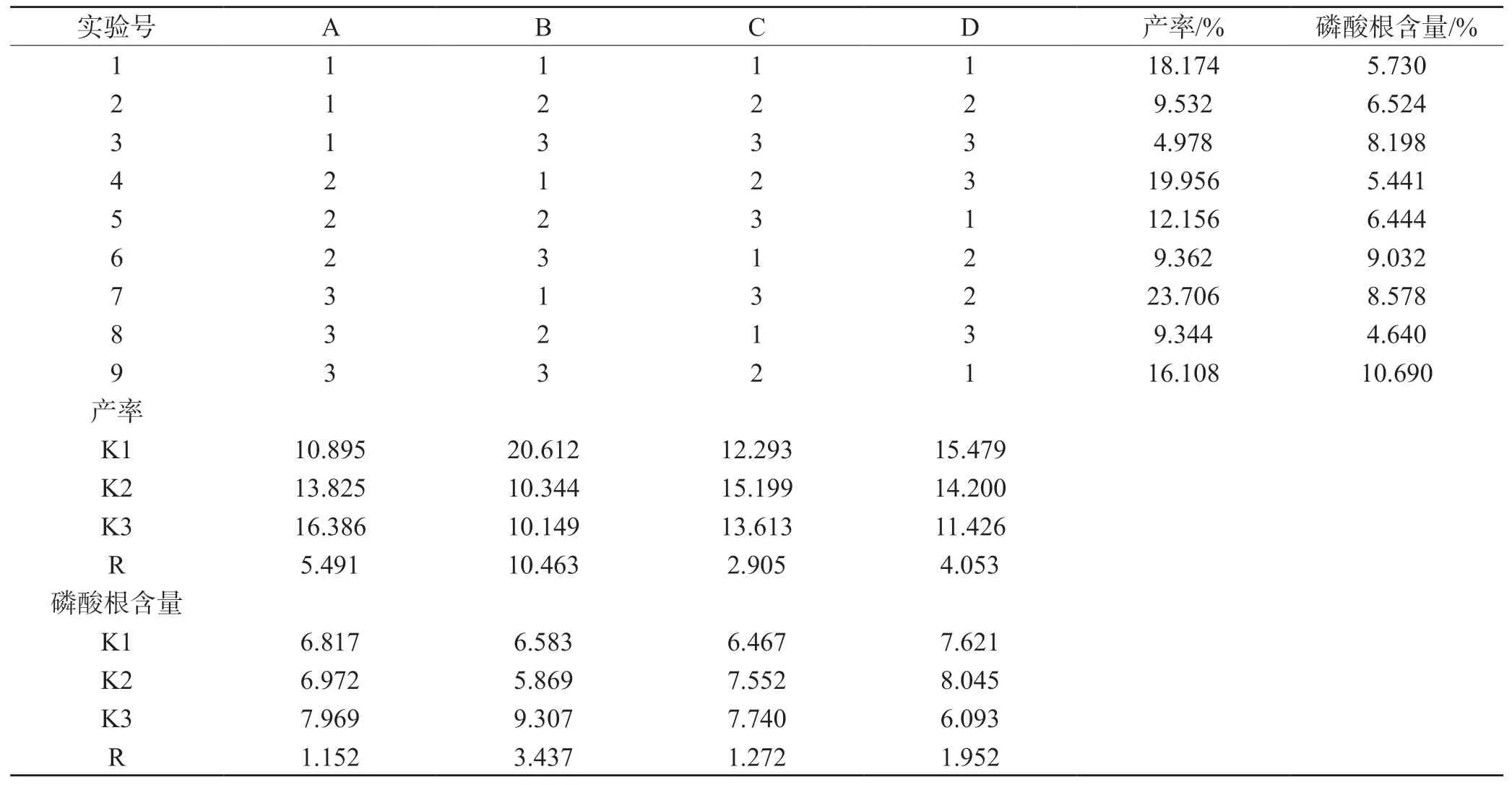
表2 正交实验及结果
2.3 红外光谱
采用傅立叶变换红外光谱仪进行红外吸光度检测,在3 414.0/cm 处存在吸收峰,为-OH 特征吸收峰,较未磷酸化多糖吸收峰强度弱;1 620.21/cm 处出现C=O 特征吸收峰,并且存在氢键,较未磷酸化多糖吸收峰强度弱;在999.13/cm 处的相关吸收峰为吡喃环上C-O-C 的特征吸收峰,此外,pPEPs 在1 265.30/cm处出现特征性的P=O 伸缩振动吸收峰,而891.11/cm处出现P-O-C 键的吸收峰。见图2、3。
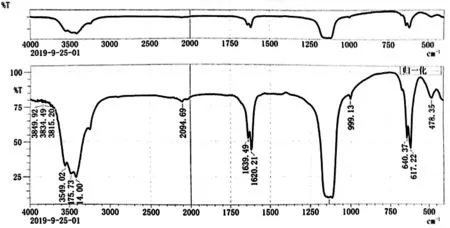
图2 扁藻胞外多糖红外吸收光谱
2.4 对Raw264.7 的生长抑制作用
在100~250 mg/L 的质量浓度时,PEPs 组和pPEPs组的细胞存活率均低于对照组(P<0.05 或0.01),以pPEPs 组更为显著(P<0.05 或0.01)。在150~250 mg/L的质量浓度时,pPEPs 组的细胞存活率明显低于PEPs组(P<0.05 或0.01),见图4。
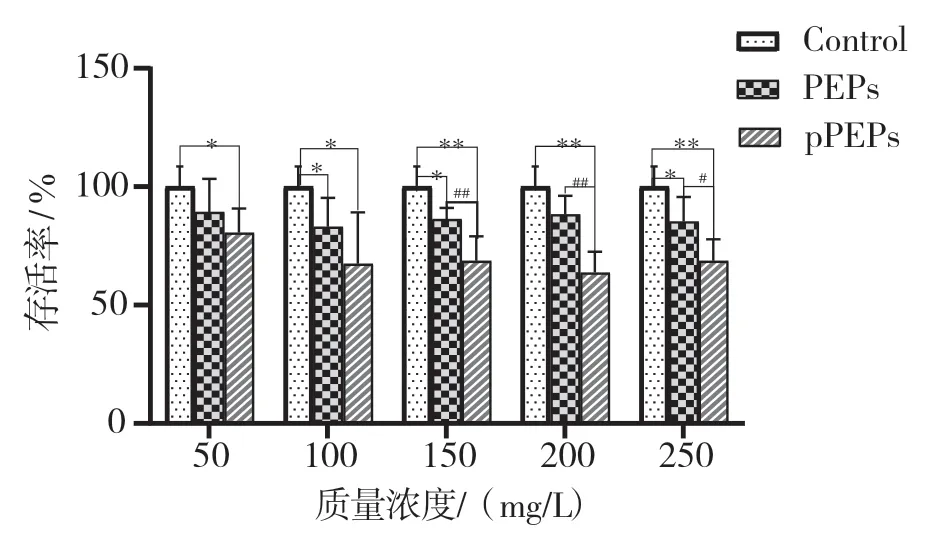
图4 PEPs 和pPEPs 对Raw264.7 细胞的影响
3 讨论
湛江毗邻南海,属于热带北缘季风气候,海洋资源丰富,扁藻是其丰富的海产之一,容易获得,生存力强,易于培养,且营养丰富,具有很高的研究价值。该文通过参考刘梓茂等[11]的方法培养扁藻并提取其胞外多糖进行研究。
多糖自身的结构可以影响多糖的生物活性,其中多糖糖苷键的类型、主链的构型、支链的性质是影响多糖活性的主要因素,改变其化学结构可增强其活性以及靶向性[12]。已知多糖常用的化学修饰方法有硫酸化、羧甲基化、乙酰化、硒化、磺酰化、磷酸化、双基团衍生化等。各种修饰方法各有优点,硫酸化修饰多糖的方法种类较多,硫酸化多糖的突出特点为具有抗病毒(抗HIV 病毒、流感病毒、巨噬细胞病毒)活性。羧甲基化修饰具有试剂易得、成本较低、制备过程简单及反应所生成的物质低毒或无毒等优点。甲基化多糖的突出特点为能有效提高多糖的水溶性。乙酰化修饰具有反应速度快、反应温和、产物转换率高等优点,乙酰化多糖增大了多糖的溶解度,其具有抗肿瘤、抗氧化、抗凝血及疫调节等活性。硒是人体生命活动的必需元素,因此硒化多糖兼有硒的强抗氧化性和多糖的抗肿瘤、抗病毒及抗辐射等生物活性。磷酸化多糖具有很强的抗肿瘤、抗病毒及免疫调节等生物活性,且磷酸化修饰的原料三偏磷酸钠及三聚磷酸钠等磷酸盐廉价易得且不易引起多糖的降解[13],所以该文选择了磷酸化来修饰多糖。
采用傅立叶变换红外光谱仪进行红外吸光度检测,可推断该多糖为吡喃型多糖[12]。与PEPs 相比,pPEPs 仍含有PEPs 的特征性吸收峰,说明多糖的主体结构未发生明显变化,仍是吡喃型多糖。此外,pPEPs在1 265.30/cm 处出现特征性的P=O 伸缩振动吸收峰,而891.11/cm 处出现P-O-C 键的吸收峰,因此可推断该扁藻胞外多糖成功磷酸化修饰[3,11]。三聚磷酸钠和三偏磷酸钠在480~550/cm 范围内有其特征性吸收峰[PO34-][13],由图1 和图2 的对比,磷酸化后的扁藻胞外多糖红外光谱中,在505/cm 有明显的吸收峰,而在未磷酸化的多糖红外光谱中未出现过,说明经磷酸化后,多糖分子结合上了磷酸基团。
影响多糖磷酸化结果的因素有反应时间、反应温度、磷酸化试剂比例和pH 值,参考相关文献的单因素实验[3,5,14],多糖磷酸化的最适反应条件区间分别为:反应时间4~8 h,反应温度80~100 ℃,磷酸化试剂比例4∶3~6∶1,pH 值8~10。该文选取这些区间为反应条件经行正交实验,得出扁藻胞外多糖pPEPs 的磷酸根含量的主次因素为反应温度>pH 值>磷酸化试剂比例>反应时间。影响pPEPs 产率的主次因素为反应温度>磷酸化试剂比例>pH 值>反应时间。综合考虑反应条件对磷酸根含量和产率的影响,确定制备pPEPs 的最佳工艺条件为m(三聚磷酸钠)∶m(三偏磷酸钠)=6∶1、反应温度为100 ℃、反应时间为6 h、pH 值=8,磷酸化扁藻胞外多糖中磷酸根质量分数平均为10.69%。通过参考文献[2,4,15]进行比较,得出本实验中的磷酸根质量分数处于较高的水平。猜测可能与实验中三偏磷酸钠占比较高,使得多糖分子能结合较多的磷酸基团有关,并且本实验中透析时间较长,能更好的滤过磷酸化试剂和未磷酸化的多糖,从而提高了产率。
细胞的死亡具有多种不同的发生机制,包括凋亡、坏死性凋亡、焦亡、铁死亡、自噬等[16]。近期研究表明多糖类成分抗肿瘤作用是通过抑制肿瘤细胞生长、免疫调节及细胞凋亡等途径实现[17-18]。Lyuksutova等[19]对(1-3)-β-D-葡聚糖进行磷酸化修饰,研究发现其免疫生物活性机制为磷酸化β-D-葡聚糖通过与膜受体细胞的相互作用而结合免疫细胞,激发机体多种自然免疫反应。Huang 等[20]对(1-3)-α-D-葡聚糖进行磷酸化修饰,研究发现磷酸化多糖的增强抗肿瘤活性的机制为激活机体的免疫应答,促进免疫细胞的增殖与分化。其体外抗S-180 肿瘤细胞IC50 可达0.01 g/L。张忠等[21]采用单磷酸盐法对灵芝β-葡聚糖进行磷酸化修饰,发现所制得的磷酸化衍生物对肿瘤细胞K562 和L1210 增殖在一定程度上有抑制作用,且抑制作用与其磷酸根取代度有关,取代度越大,抑制作用越强。本研究采用体外MTT 法考察了PEPs 和pPEPs 对raw 264.7 细胞增殖的抑制作用。实验发现,在100~250 mg/L 的质量浓度时,PEPs 组和pPEPs 组的细胞存活率均低于对照组(P<0.05 或0.01),以pPEPs组更为显著(P<0.05 或0.01)。在150~250 mg/L 的质量浓度时,pPEPs 组的细胞存活率明显低于PEPs 组(P<0.05 或0.01),说明PEPs 与pPEPs 对Raw 264.7 细胞的增殖均具有一定的抑制作用,且pPEPs 组的细胞抑制率高于PEPs 组。表明磷酸化修饰的方法能提高扁藻胞外多糖的抗肿瘤活性,磷酸化扁藻胞外多糖具有一定的抗肿瘤应用前景,本研究可为扁藻胞外多糖相关功能食品、医药产品和化学工业品的开发提供理论参考。
正交法制备磷酸化扁藻胞外多糖的工艺简单,原料容易获得,在今后开发中有一定的优势,这为其在工业中的应用提供一定的基础。实验显示,扁藻胞外多糖经磷酸化修饰后能增强其抑制肿瘤细胞增殖的作用,这可能是由于多糖经过磷酸化修饰后其分子结构发生了衍生,增加了药物的活性,增强了抗肿瘤细胞增殖的作用。而且磷酸化可以提高药物的溶解稳定性,减少药物的应用浓度和剂量,但磷酸化扁藻胞外多糖具体的抗肿瘤机理目前尚不明确,仍需进行进一步探讨研究。

