基于网络药理学探讨淫羊藿苷治疗动脉粥样硬化的机制
郭英杰,许锦荣*,林俊颜,刘左玲,左 玲
(1.广东医科大学附属第二医院心内科,广东湛江 524000;2.广州医科大学第一临床医学院,广东广州 510120;3.广东医科大学附属第二医院中医科,广东湛江 524000)
动脉粥样硬化是指动脉内膜层的斑块增厚形成,也可累及中膜层的平滑肌,从而引起狭窄,削弱血流,是一种复杂的全身性、慢性炎症性、进行性和年龄相关的动脉内膜疾病,是诱发心血管疾病的影响因素之一。2015 年,超过1 700 万人死于心血管疾病,占全球死亡总数的31%[1]。脂肪化合物积聚在斑块的核心,被纤维帽覆盖。成纤维细胞穿透结缔组织和钙沉积到斑块导致动脉硬化,最终动脉粗糙的内表面可能会导致血栓形成或栓塞[2-3]。大量研究表明,动脉粥样硬化会影响人类和动物模型中非中风患者的大脑认知功能。心血管疾病的数量与老年男女认知障碍之间存在直接关系[4]。在小鼠模型中,主动脉粥样硬化会引起脑β-淀粉样变性,从而导致学习缺陷[5]。动脉粥样硬化的等级与记忆的加速衰减有关[6]。虽然现有治疗可适度改善患者的临床症状,并在一定程度上提高生存率,但仍无法根治性治疗。淫羊藿是小檗科淫羊藿属植物,主要成分是生物碱、木脂素、多糖及黄酮4 大类,常用于治疗高血压、冠心病、骨质疏松、更年期综合征、阳痿、半身不遂、四肢麻木等。黄酮类淫羊藿苷(Icaritin,C33H40O15)是淫羊藿中的重要成分之一,对心血管疾病的治疗具有一定的作用[7-8]。本研究以网络药理学及分子对接手段为基础,分析了Icaritin 治疗动脉粥样硬化的作用,在基于计算机软件构建网络后,确定了该药用植物的作用机制,以期为新药的开发应用提供参考。
1 资料和方法
1.1 有效活性成分的靶点预测
以Icaritin 为关键词,通过PubChem 进行检索,确定Icaritin 结构信息,然后在Swiss Target Prediction 平台中检索有关结构信息,确定研究所需的靶点信息。
1.2 糖尿病心肌病相关靶点预测
选择GeneCards、OMIM、PharmGkb、DisGeNET、Drugbank 和TTD 数据库以“atherosclerosis”为检索词查找动脉粥样硬化相关靶点信息。将Icaritin 和动脉粥样硬化的有关靶点信息进行对比分析,确定两者的交集,也就是在Icaritin 治疗动脉粥样硬化方面的作用靶点。
1.3 蛋白质-蛋白质相互作用(PPI)网络构建
在String 平台中导入上一步骤获得的靶点信息,使用Multiple Proteins,将Organism 设置成Homo Sapiens,接着向Cytoscape version 3.8.2 工具中导入获得的信息,构建网络并进行分析,最后获得研究所需的PPI 关系图,再通过其插件CytoHubba 计算获得Maximal Clique Centrality(MCC)得分前10 的核心靶点。
1.4 靶点Gene oncology(GO)富集及 Kyoto Encyclopedia of Genes and Genomes(KEGG)通路注释分析
用R 语言软件对Icaritin 与动脉粥样硬化的共同作用靶点进行分析,获得GO 和KEGG 富集分析所需的气泡图及条形图,最后通过转换获得相应的原始基因靶点。
1.5 分子对接
在UniProt 数据库中搜索所选基因编码的受体蛋白,并将该蛋白的3D 结构下载到RCSBPDB 数据库,从PubChem 数据库下载的Icaritin 2D 结构使用ChemBio3D 软件最小化能量计算并输出3D 结构;受体蛋白使用PyMOL 进行脱水;利用AutoDock 软件对蛋白质进行氢化和电荷计算,采用AutoDockVina 进行对接,寻找最佳构象。
2 结果
2.1 Icaritin-动脉粥样硬化相关靶点的筛选
Icaritin 的2D 和3D 化学结构分别见图1、2。将Icaritin 的化学结构导入SwissTargetPrediction 数据库预测并构建靶点集,得到Icaritin 的潜在活性成分靶点102 个。基于6 个数据库检索去除重复靶点后,共获得动脉粥样硬化相关靶点5 300 个(4 793 个来自GeneCards、3 个来自OMIM、26 个PharmGkb、2 044个来自DisGeNET、39 个来自Drugbank、31 个来自TTD,其中共有1 636 个重复靶点),见图3。将上述Icaritin 靶点信息与动脉粥样硬化靶点信息进行比对并取交集,获得两者的共同靶点79 个,见图4。
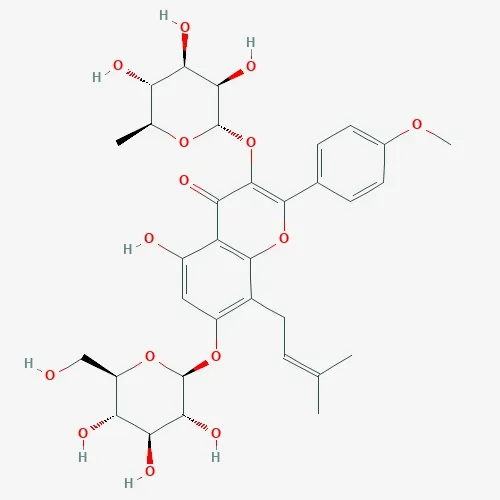
图1 Icaritin 2D 化学结构
图2 Icaritin 3D 化学结构
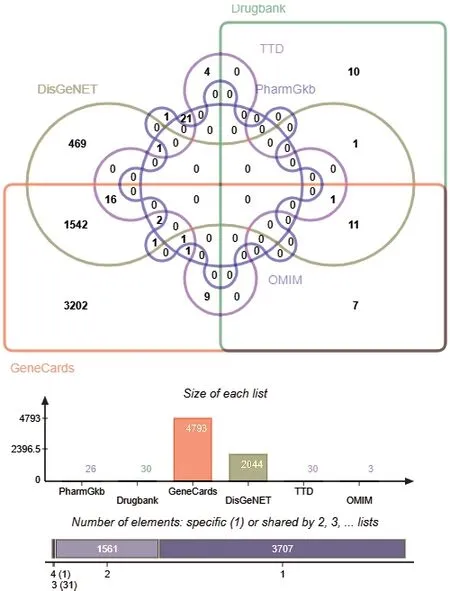
图3 基于6 个数据库获得动脉粥样硬化靶点
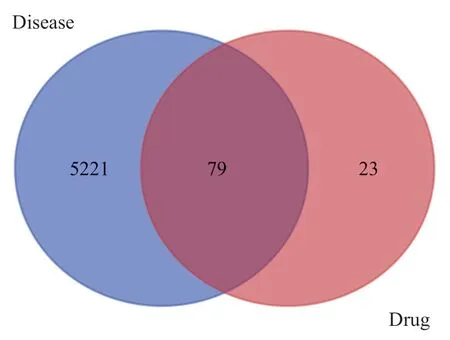
图4 淫羊藿与糖尿病心肌病共同靶点韦恩图
2.2 Icaritin-动脉粥样硬化相关靶点GO 富集分析
经R 语言运行后共得到72 个功能,以前20 作为分界,得到GO 富集条形图和气泡图。如富集较少,图形颜色趋近蓝色;如富集较显著,则图形颜色趋近红色,图像的横坐标代表的是富集数量。GO 功能富集后富集数目较多的有protein kinase C activity、protein serine/threonine kinase activity、protein phosphatase binding 和phosphatase binding 等,见图5、6。

图5 GO 富集条形图
2.3 Icaritin-动脉粥样硬化相关靶点KEGG 富集分析
经R 语言运行后共得到138 个功能,以前20 作为分界,得到KEGG 富集条形图与气泡图。如富集较少,图形颜色趋近蓝色;如富集较显著,则图形颜色趋近红色,图像的横坐标代表的是富集数量。KEGG富集通路分析显示Icaritin 治疗动脉粥样硬化主要通路有Sphingolipid signaling pathway、AGE-RAGE signaling pathway in diabetic complications、Chemical carcinogenesis-receptor activation 和HIF-1 signaling pathway 等,见图7、8,其中鞘脂信号通路的详细通路见图9、10。

图6 GO 富集气泡图
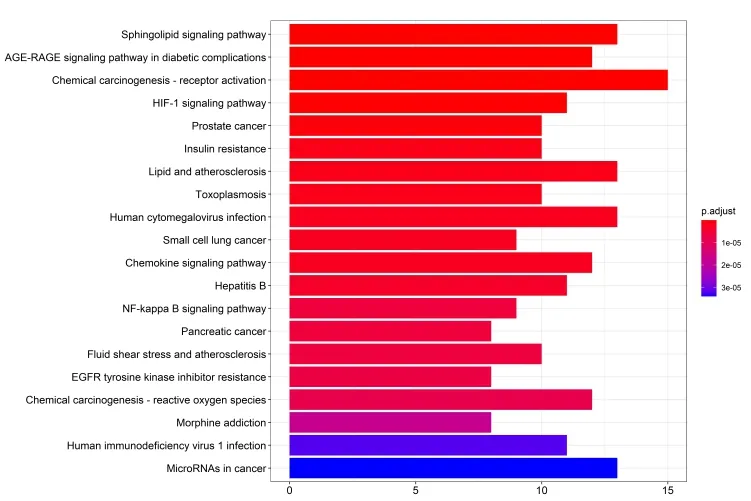
图7 KEGG 富集条形图
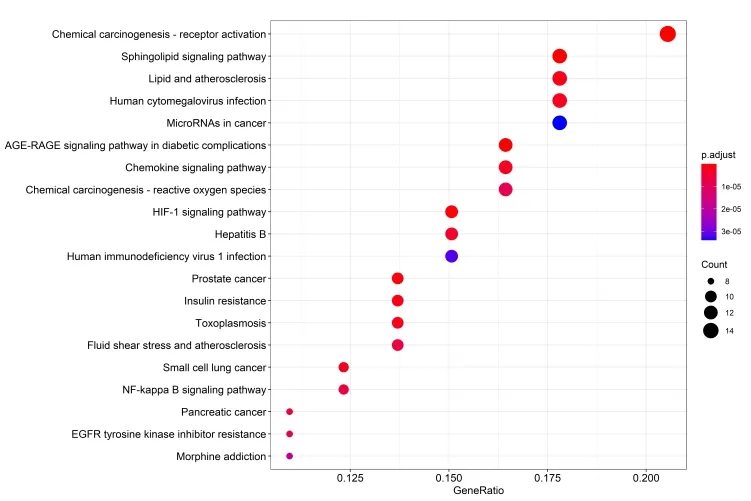
图8 KEGG 富集气泡图
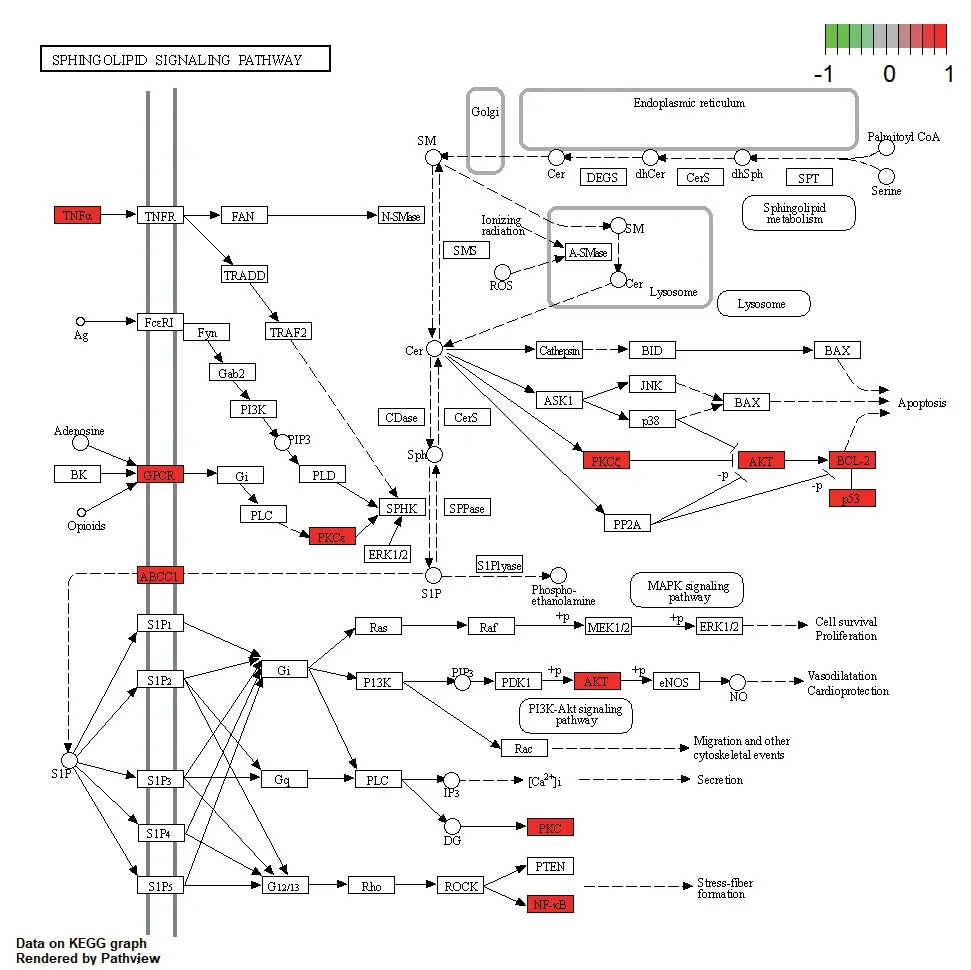
图9 鞘脂信号通路(1)
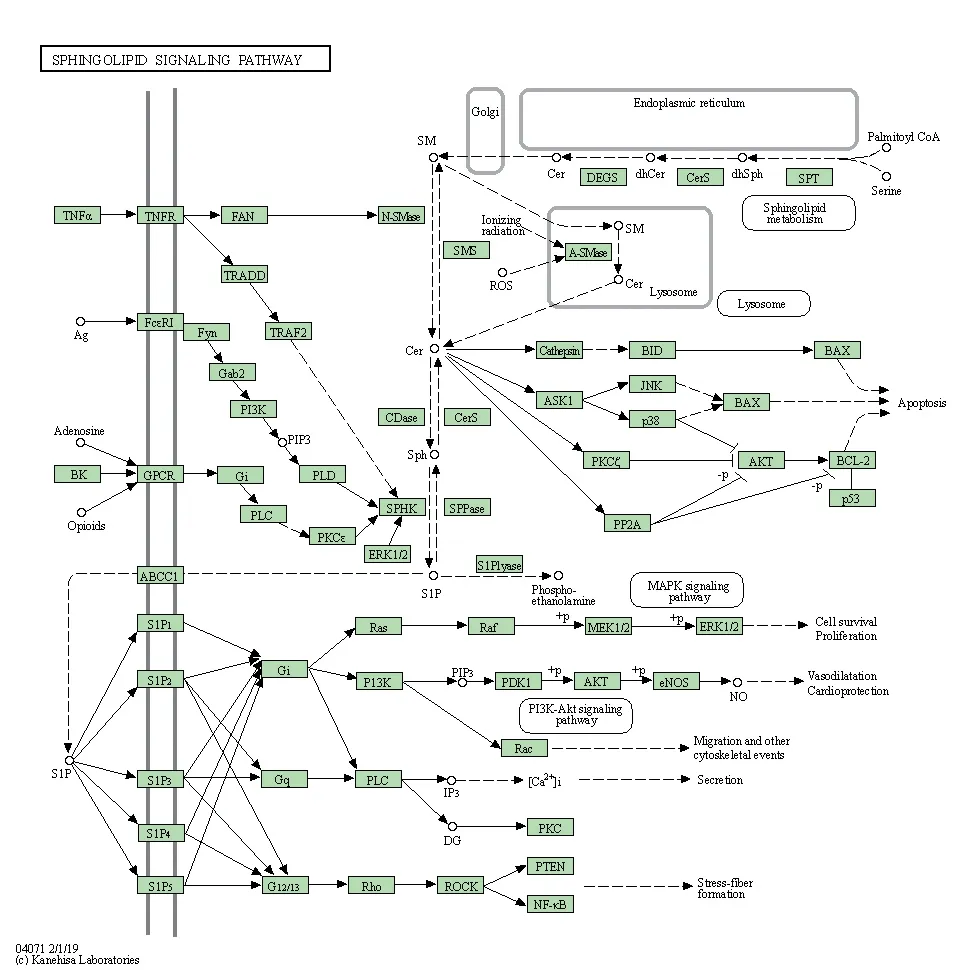
图10 鞘脂信号通路(2)
2.4 筛选核心靶点
为确定Icaritin 治疗动脉粥样硬化的潜在枢纽靶点及其之间的相互作用,将上述得到的79 个靶点信息输入到STRING 网络平台(https://string-db.org/)中,并选择人类作为物种,构建PPI 网络(见图11)。使用CytoHubba 插件通过MCC 方法进行排序输出前10的核心靶点,包括肿瘤蛋白P53(TP53)、肿瘤坏死因子(TNF)、丝氨酸/苏氨酸激酶Akt1(AKT1)、核因子Kappa-B P65(RELA)、表皮生长因子受体(EGFR)、B 细胞淋巴瘤-2 样蛋白1(BCL2L1)、雌激素受体1(ESR1)、热休克蛋白90αA1(HSP90αA1)、前列腺内过氧化物合酶2(PTGS2)和核因子Kappa-B1(NFKB1),见图12。
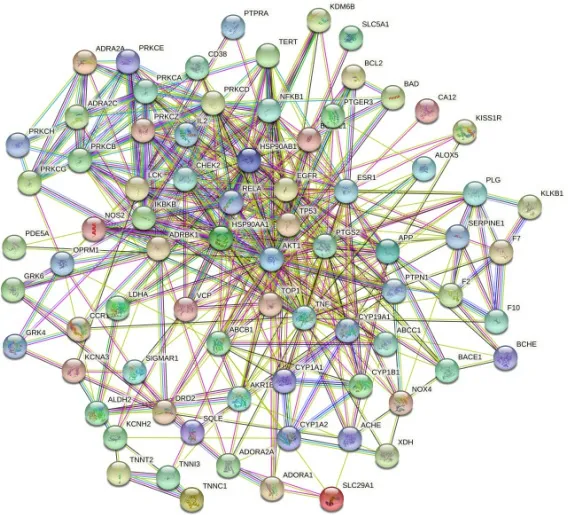
图11 PPI 网络
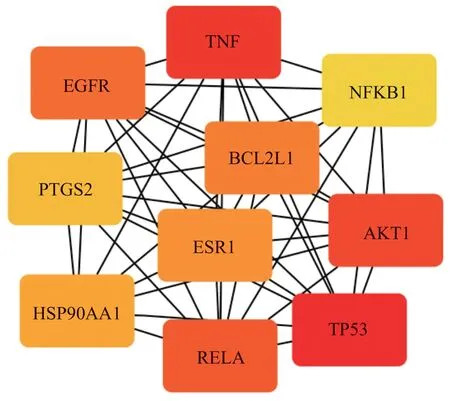
图12 核心靶点
2.5 分子对接
当药物分子配体与靶点结合形成构象稳定性时,能量越低,结构越稳定。结合上述筛选出的10 个核心靶点,计算出Icaritin 与核心靶点蛋白之间分子对接的结合自由能,见表1。Icaritin 与10 个核心靶点蛋白之间的结合自由能均<-5 kcal/mol,表明其结合稳定,所有活性化合物均可进入并结合目标蛋白的活性口袋,见图13。
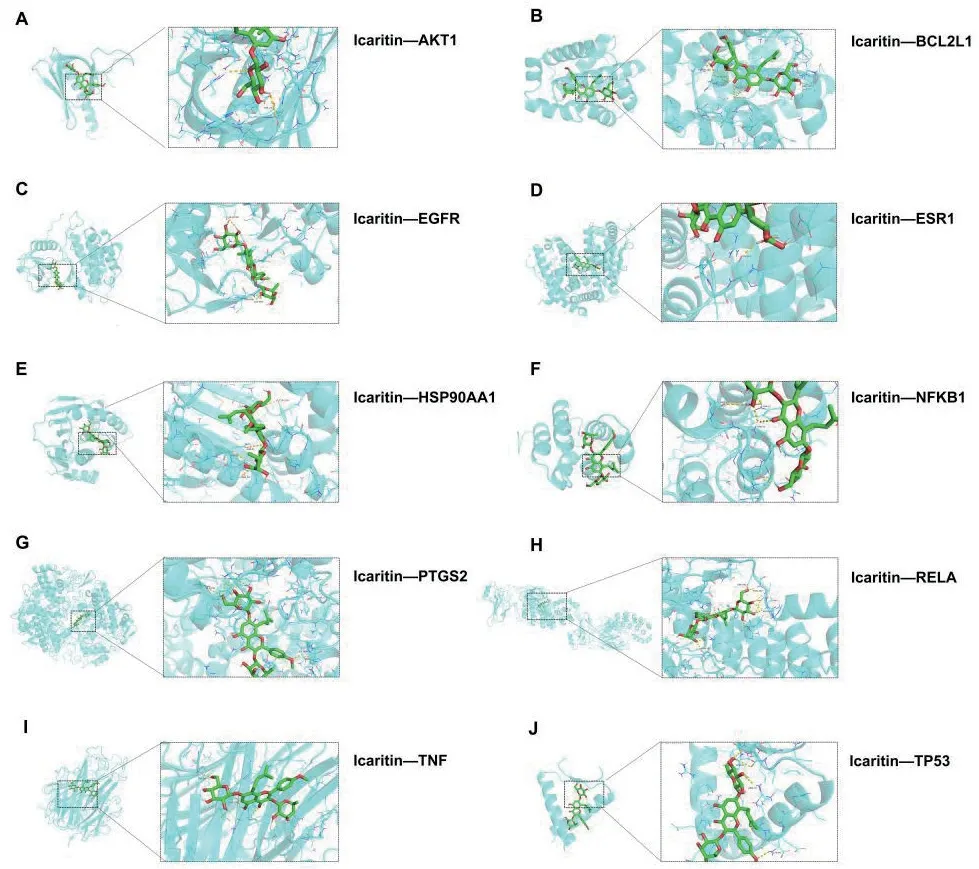
图13 分子对接可视化
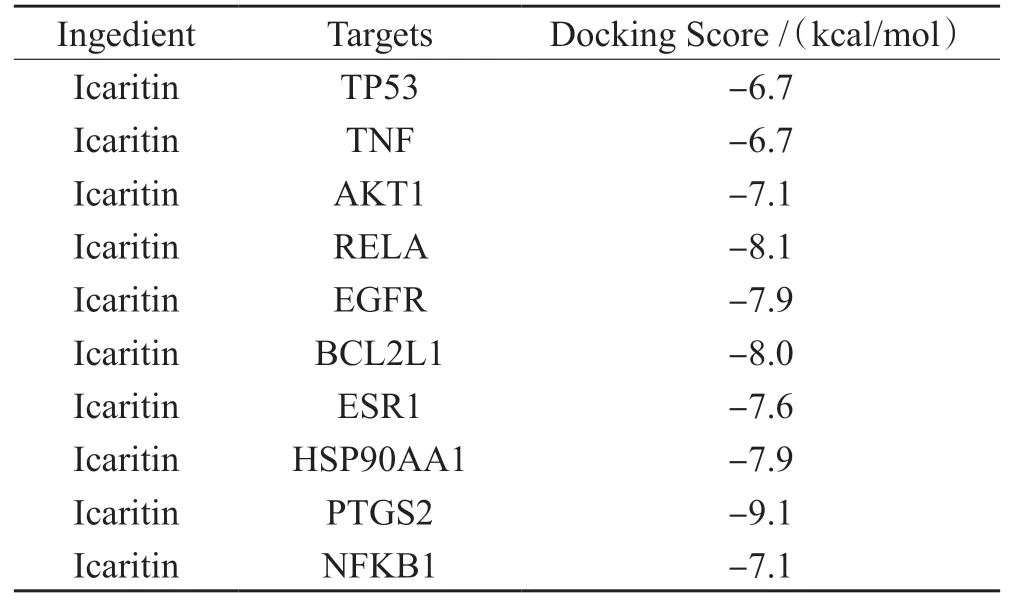
表1 分子对接的结合自由能
3 讨论
动脉粥样硬化是常见心血管疾病如冠心病和中风的主要原因,而冠心病和中风是造成全世界疾病死亡负担的主要原因之一[9]。血管平滑肌细胞的活力、迁移和积累是动脉粥样硬化进展过程中形成稳定斑块的重要因素,因此,动脉粥样硬化的早期诊断及其潜在的分子机制对于动脉粥样硬化的治疗策略至关重要[10]。Icaritin 是淫羊藿中的主要活性成分,具有广泛的药理活性[11],如神经保护[12]、心血管保护[13],临床上常用于治疗骨质疏松症、动脉粥样硬化等疾病[14-15]。研究表明,Icaritin 及其代谢物可通过改善炎症反应和氧化应激,调节细胞增殖和凋亡,抑制血管内皮细胞损伤和细胞衰老,对心血管疾病具有广泛的保护作用[13,16]。
我们通过靶点预测得到Icaritin 作用于动脉粥样硬化的靶点共79 个,经PPI 网络筛选后排在前5 的核心靶标主要有TP53、TNF、AKT1、RELA(p65)和EGFR,推测这5 个靶标是Icaritin 治疗动脉粥样硬化的关键靶点。蛋白激酶(AKT)是信号转导分子,可以调控细胞迁移、增殖及诱导分化等[17]。文献报道金雀异黄素可能通过影响磷酸肌醇-3-激酶(PI3K)/Akt-内皮型一氧化氮合成酶(eNOS)通路改善血管重塑[18];TNF 可调控白介素6(IL6)表达,加重血管内皮细胞的损害,影响细胞的增殖和凋亡,介导血管重塑的进程[19]。有研究显示TP53 在血管重塑的发展中起重要作用[20]。研究发现,过氧化物酶体增殖物激活受体γ(PPARγ)-p53 介导的血管再生程序能够逆转血管增殖[21]。RELA(p65)是NF-κB 家族的一个主要成员,有研究发现抑制NF-κB 等可以改善动脉粥样硬化[22]。国外研究提示,抑制EGFR 可减少T 细胞的激活而抑制增殖,是动脉粥样硬化潜在的治疗靶点[23]。EGFR 主要影响低氧诱导因子(HIF-1)信号通路从而改变动脉粥样硬化进展。Icaritin 治疗动脉粥样硬化主要通过多靶点、多通路发挥生物学作用,从而阻断动脉粥样硬化患者血管重塑的进程,改善血管功能。分子对接结果显示Icaritin 与10 个核心靶点蛋白之间的结合自由能均小于-5 kcal/mol,表明其结合形成的结果稳定。网络药理学与分子对接结合相互验证,Icaritin 具有较好的治疗动脉粥样硬化的作用。分子对接结果也进一步为Icaritin 治疗动脉粥样硬化提供了新的证据及思路。
GO 分析显示Icaritin 治疗动脉粥样硬化的预测靶点参与蛋白激酶C 活性、蛋白丝氨酸/苏氨酸激酶活性、蛋白磷酸酶结合和磷酸酶结合等;KEGG 富集分析描述了Icaritin 治疗动脉粥样硬化的预测靶点参与鞘脂信号通路、糖尿病并发症中的AGE-RAGE 信号通路、化学致癌作用-受体激活和HIF-1 信号通路等,这可能是Icaritin 治疗动脉粥样硬化的关键信号通路。KEGG 通路富集结果也与PPI 网络分析及GO富集分析结果相似,主要富集通路有鞘脂信号通路、AGE-RAGE 信号通路和HIF-1 信号通路。HIF-1 与血管功能密切相关,研究发现HIF-1 抑制剂能有效降低丙酮酸脱氢酶激酶同工酶1(PDK1)活性,从而抑制血管平滑肌增殖,改善血管重塑[24-25]。AGE 及其受体(RAGE)和可溶性RAGE(sRAGE)似与血管重塑的发病机制有关。AGE 与RAGE 相互作用后通过促进VSMC 增殖及ECM 积累,抑制细胞凋亡,诱导血管肥大。AGE 和RAGE 相互作用还可产生活性氧(ROS)以调节肺动脉平滑肌细胞增殖、凋亡,收缩肺动脉,从而诱导血管重塑,最终导致动脉僵硬。AGE 的消耗和形成的减少、RAGE 表达的抑制、AGE 与RAGE 配体结合的阻断、sRAGE 水平的升高等可能是预防和减缓血管重塑进展的新靶点[26-27]。故Icaritin-交集靶标-动脉粥样硬化中存在着极为复杂的关系,在对动脉粥样硬化进行治疗时,Icaritin 似可通过多种不同的途径和靶点发挥治疗作用。
综上,本研究以网络药理学为基础,发现Icaritin可能利用多靶点、多通路抑制氧化应激、细胞增殖以改善动脉血管重塑。现阶段Icaritin 治疗动脉粥样硬化机制的研究较为少见,虽然我们以数据库为基础推导得出结论,但依旧能够为相关科研工作提供参考。

