巨噬细胞靶向雷帕霉素和利福平自噬纳米笼的构建及其对胞内结核杆菌的杀伤效能
何晓枫,赵祖国,罗仁幸,彭婉晴,吴坤汝,韦燕兰,廖显平,程炜然,王万党,金 花
结核病由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染引起,已成为全世界发病率和致死率最高的传染性疾病。95% 结核病死亡者来自包括我国在内的一系列发展中国家[1]。目前临床仍使用一些经典的抗痨药物(如异烟肼、利福平Rif 等)对其进行治疗,但这些药物往往具有不良反应大、用药周期长、治疗方案复杂、极易引起耐药等问题[2-3]。因此,设计、开发高效精准的结核治疗药物和治疗方法对缩短结核化疗周期、减少毒副作用、提高结核患者的生活质量、防治结核病(特别是耐药结核病)具有至关重要的意义。宿主导向治疗(host-directed therapy,HDT)是一种新的、有效的结核病辅助治疗方法,主要通过调节宿主对结核分枝杆菌各种免疫通路达到最大限度杀死细菌和减少炎症所致组织损伤的目的,是遏制结核菌及耐药结核菌的有效途径。巨噬细胞(Mφ)是M.tb在体内主要的宿主细胞及免疫细胞,但是M.tb在与宿主长期相互作用过程中,逐渐形成多种逃避杀灭的有效策略,得以在宿主体内存活并增殖。其中,结核菌抑制Mφ 自噬,从而逃逸机体的免疫杀伤,是结核菌生存的主要方式。因此,促进Mφ 自噬可作为清除Mφ 内部的M.tb的有效措施[4-5]。而其他正常细胞也可以摄取一定量的自噬药物,从而引起广泛的机体毒性。本研究拟通过构建具有高Mφ 靶向性的自噬增强纳米药物,降低机体毒性,并通过提高药物的生物相容性,以期实现高效杀灭胞内M.tb的目的。
1 材料和方法
1.1 细胞系
THP-1 人单核细胞购自ATCC 公司(上海),用含有10%胎牛血清(FBS)和1%青/链霉素(P/S)的无血清细胞冻存基础培养基(RPMI 培养基)于37 ℃,5%CO2中常规培养。
1.2 主要材料和试剂
RPMI 培养基购自HyClone 公司;FBS 及P/S 购自Gibco 公司;聚乳酸-羟基乙酸共聚物(PLGA-PEG)和PMA(P1585)购自sigma 公司;二氯甲烷(CAS:75-09-2)购自大茂化学试剂厂;聚乙烯醇(CAS:9002-89-5)、Rif(CAS:13292-46-1)及D-甘露糖(CAS:3458-28-4)购自Macklin 公司;香豆素6(C6,CAS:38215-36-0)购自源叶生物;雷帕霉素(Rapa,CAS:NO.R8140)购自Solarbio 公司;HRP 标记的羊抗鼠IgG、羊抗兔IgG、LC3I、LC3II、P62 及GAPDH 抗体购自Beyotime 公司。
1.3 甘露糖修饰的雷帕霉素和利福平纳米笼(Man@Rapa/Rif-NCs)构建及其表征分析
聚乳酸-羟基乙酸共聚物(PLGA-PEG)与Rapa、Rif 共同溶解在二氯甲烷中作为油相,1% PVA 水溶液(w/v)作为水相,利用油包水的乳化作用原理在高强度机械力(100 W,3 min)作用下形成乳剂,超纯水洗涤,冷冻干燥得到纳米颗粒(Rapa/Rif-NCs)。将一定量的甘露糖(Man)溶解在醋酸钠溶液(0.1 mol/L,pH=4)中使其终浓度为8 μmol/L,再加入PLGA-PEG纳米颗粒水溶液(0.1 µmol/L),在室温下震荡8 h,浓缩获得Man@Rapa/Rif-NCs。所得到的产品利用原子力显微镜观察其形貌,并利用纳米激光粒度仪测量产品的粒径和表面zeta 电位。
1.4 Man@ Rapa/Rif-NCs 纳米笼生物安全性分析
取1 mL 小鼠全血,采用EDTA 抗凝,3 000 r/min离心10 min,取红细胞沉淀,用PBS 重悬后,加入纯水(阳性溶血组)、PBS(阴性对照组)、不同浓度的纳米载药体(Rapa/Rif、Rapa/Rif-NCs、Man@Rapa/Rif-NCs)。模拟体内环境,37 ℃水浴18 h 后观察其溶血情况,并检测OD540。
1.5 Man@ Rapa/Rif-NCs 对Mφ 靶向作用分析
将THP-1 细胞接种到六孔板中,培养至10 万细胞/孔,加入100 mmol/L PMA 刺激细胞[6],24 h 后,加入罗丹明(Rh)标记的自噬纳米笼Man@Rh-nanocage(Man@Rh-NCs)孵育一定时间,用PBS 洗涤细胞3 次,去除细胞表面的Man@Rh-NCs 后,换为磷酸缓冲溶液(PBS),用倒置荧光显微镜观察Man@Rh-NCs 被Mφ吸收的情况。
1.6 体内靶向活体成像
在纳米笼构建步骤中,以C6 代替Rapa 和Rif,得到含有荧光标记的纳米笼颗粒(C6-NCs)。取正常健康C57 小鼠,用磷酸缓冲液(Basal 组)、甘露糖修饰的纳米载体(Man@C6-NCs)滴鼻给药,采用IVIS 小动物活体成像仪分析不同修饰的纳米笼在小鼠各个组织器官中的分布。
1.7 构建的自噬纳米笼Rapa/Rif-NCs 对巨噬细胞自噬的诱导作用
将THP-1 细胞接种到六孔板中,加入100 mmol/L PMA 刺激细胞,24 h 后加入不同药物作用72 h 后用PBS 洗涤细胞3 次,采用吖啶橙追踪药物处理后细胞内酸性自噬泡(AVOs)的生成;提取细胞总蛋白,采用免疫印迹法检测自噬蛋白LC3II/I 及P62 表达水平的变化。
1.8 Man@ Rapa/Rif-NCs 对M.tb 杀伤效果检测
药物对胞外BCG 菌株的杀伤疗效检测:细菌经纯培养基(Medium 组)、Rapa/Rif、Rapa/Rif-NCs、Man@Rapa/Rif-NCs、Man@Rapa/Rif-NCs+3-MA 分别作用72 h 后,涂板,37 ℃孵育3~4 周后计菌落数。实验中原药或纳米笼中负载的Rif 质量浓度为10 µg/L,Rapa 质量浓度为10 mg/L。自噬抑制剂3-MA 质量浓度为10 mg/L。
药物对Mφ 内BCG 菌株的杀伤疗效检测:将THP-1细胞接种到共聚焦培养皿,培养至40 万细胞/孔,加入100 mmol/L PMA 刺激细胞,24 h 后用M.tb菌株BCG感染Mφ(感染复数MOI=1),4 h 后用PBS 洗涤细胞,去除细胞表面的细菌后分别加入纯培养基(Medium组)、Rapa/Rif、Rapa/Rif-NCs、Man@Rapa/Rif-NCs、Man@Rapa/Rif-NCs+3-MA 作用72 h,清洗细胞,用蒸馏水裂解细胞并涂板,37 ℃孵育3~4 周后计菌落数。
2 结果
2.1 Man@ Rapa/Rif-NCs 纳米笼的表征特点
实验结果显示(图1A),所制备的具有Mφ 靶向功能的无修饰、无载药的纳米笼Blank NCs 粒径为(70±18)nm,双载药纳米笼Rapa/Rif-NCs 粒径约为(132±29)nm,而甘露糖分子修饰的双载药纳米笼Man@Rapa/Rif-NCs 粒径为(222±41)nm。经甘露糖分子修饰的双载药纳米笼的表面zeta 电位为+77.4 mV(图1B),说明甘露糖分子成功融合在纳米笼的表面,且相对稳定,不容易发生聚集。未经修饰的双载药纳米笼的表面zeta 电位约为0 mV,呈规则球形(图1C)。
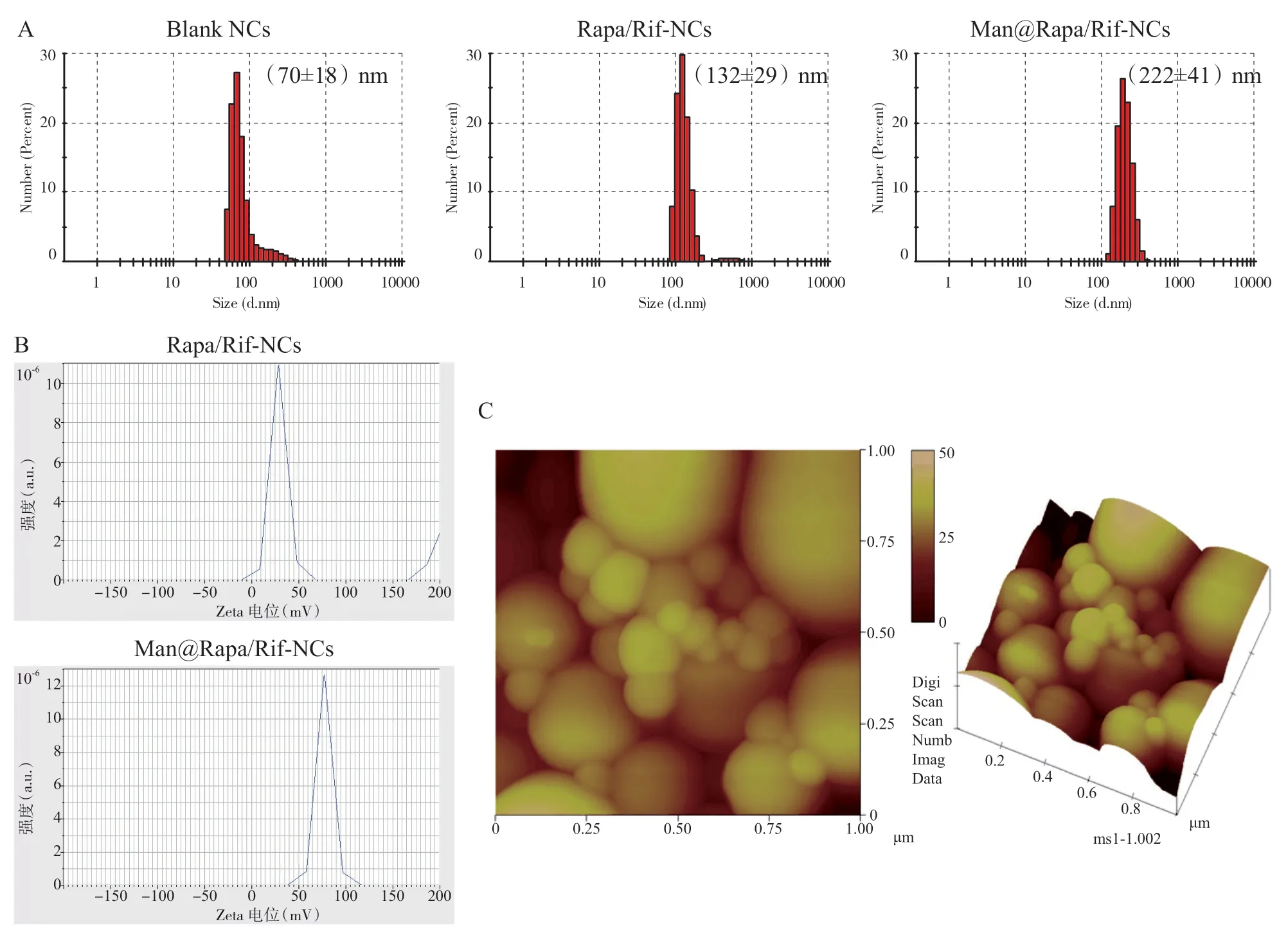
图1 构建的纳米笼的粒径、表面电位及形貌表征
2.2 Rapa/Rif@Man-NCs 纳米笼的生物安全性及Mφ靶向性分析
在药物质量浓度为10 µg/L 的条件下,所制备的药物肉眼所见无明显溶血现象(图2A)。以(实验组OD540 -阴性对照OD540)/阴性对照OD540 的值作为纵坐标绘制溶血程度直方图,以代表药物溶血性的定量表征,结果显示,所制备的Rapa/Rif-NCs 及Man@Rapa/Rif-NCs 纳米笼不会造成溶血(图2B),说明该纳米药物生物安全性良好。构建的抗结核化疗药物纳米笼可被Mφ 摄取(图2C、D)。进一步对其表面修饰甘露糖分子后,发现纳米载体被Mφ 的摄取量增加了3倍(图2E)。
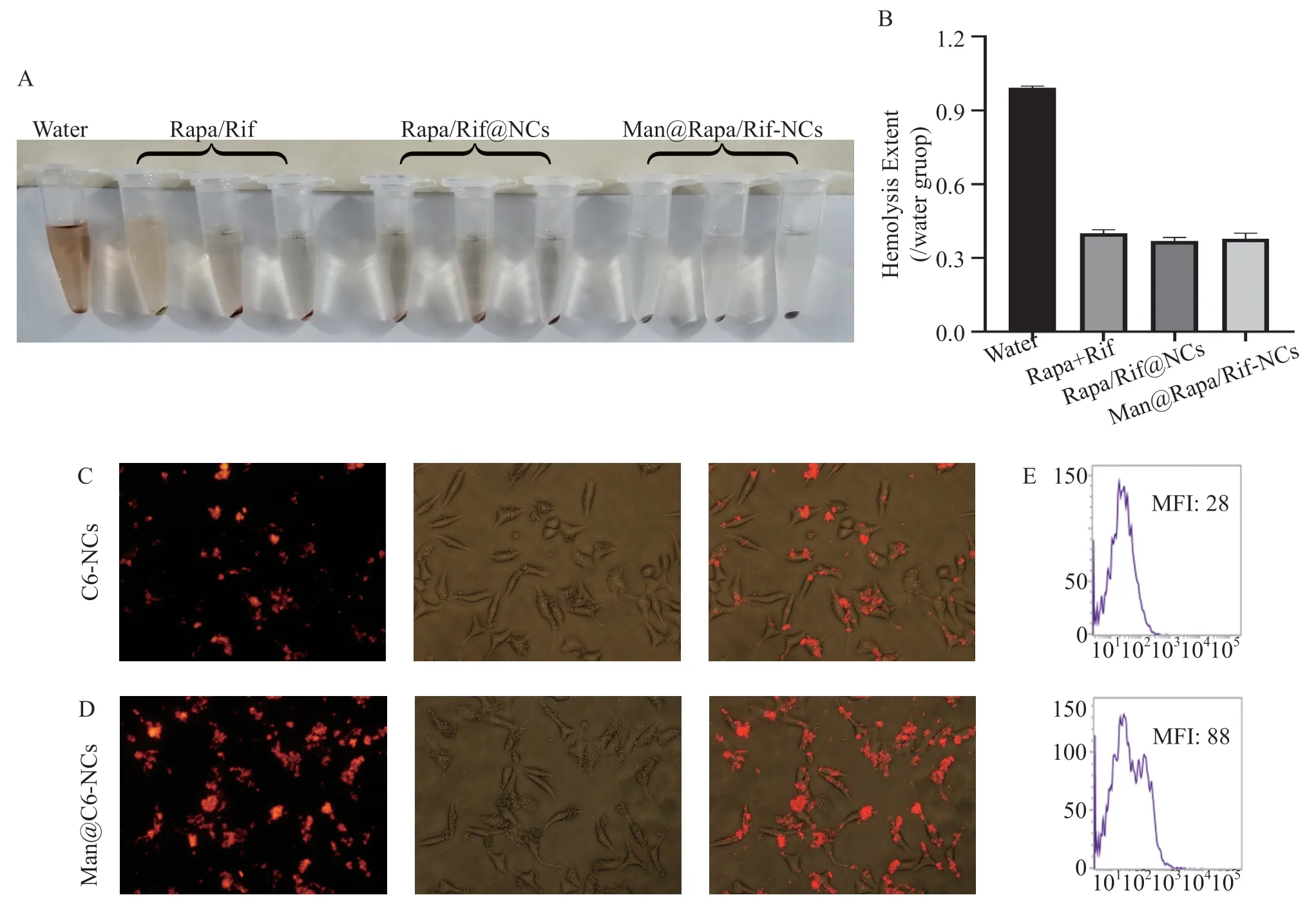
图2 Man@ Rapa/Rif-NCs 生物安全性、生物相容性及巨噬细胞靶向性
2.3 Man@ Rapa/Rif-NCs 纳米笼在体内靶向性分析
活体成像实验结果见图3,构建的纳米载体主要聚集在肝脏和肺脏。其中,未经C6-NCs 很快被机体清除,而经甘露糖修饰后可以在体内滞留时间大于24 h,同时纳米载体在肺脏的滞留量也大大增加。
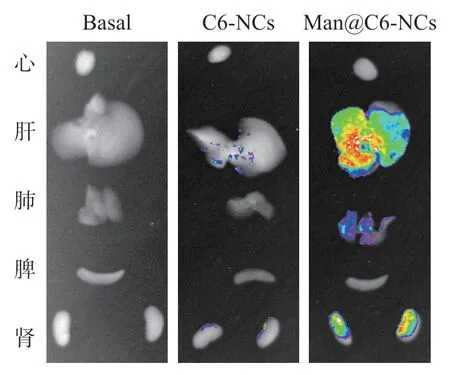
图3 构建的自噬纳米笼的体内器官靶向性的表征
2.4 Man@Rapa/Rif-NCs 纳米笼对Mφ 自噬诱导及胞内M.tb 抑制作用分析
自噬诱导剂Rapa 能明显诱导Mφ 自噬,而自噬抑制剂3-MA 明显抑制了Mφ 的自噬,“纳米笼”的负载能显著加强Rapa 的自噬效果,差异均有统计学意义(P<0.05)。见图4。
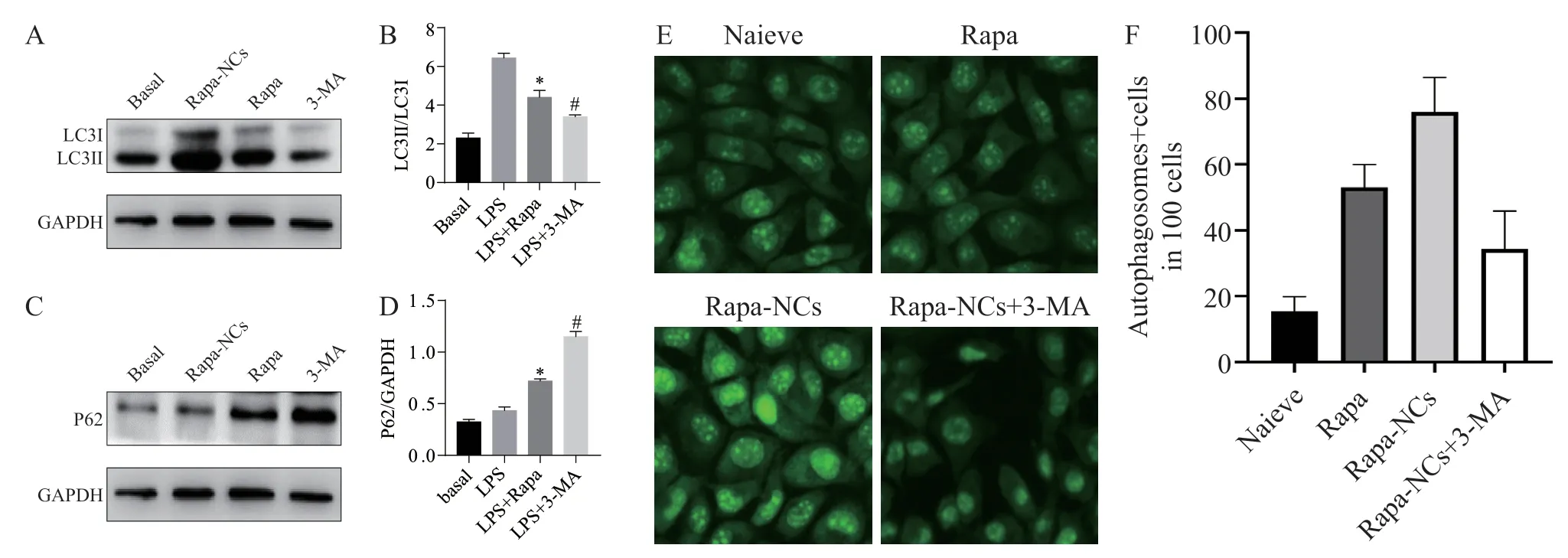
图4 构建的自噬纳米笼对巨噬细胞自噬的影响
2.5 Man@Rapa/Rif-NCs 对M.tb 杀伤效果检测结果
通过计算(菌落涂板计数结果/涂板所用液量)得到菌液中M.tb的含量(CFU/mL)并以此作为纵坐标绘制直方图(图5)。Rapa/Rif-NCs 组对胞外BCG 抑制率可达80%以上(P<0.01),见图5A。Man@Rapa/Rif-NCs 组在胞外及胞内杀伤均有较好的效果(P<0.01),且在胞内杀伤实验中,Man@Rapa/Rif-NCs 组未检出可疑菌落,说明自噬纳米药物对胞内结核菌的杀伤效果良好。而联合使用自噬抑制剂3-MA 与诱导自噬双载药物纳米笼Man@Rapa/Rif-NCs 对胞内菌的杀伤效率有所下降,见图5B。
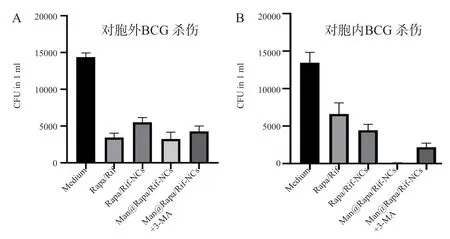
图5 构建的纳米笼对胞内和胞外结核杆菌抑制率的影响
3 讨论
甘露糖受体是先天免疫系统中重要的模式识别受体和内吞受体,主要表达于Mφ 表面,可高效靶向Mφ并被其摄取[7-8]。鉴于小分子化疗药物如利福平、雷帕霉素等,具有良好的生物活性,二者联用可以在临床抗结核治疗中具有很好的前景。但小分子药物本身又具有毒副作用大、脱靶性、生物相容性和利用度低等一系列问题,使其疗效和临床应用都受到很大限制。纳米载药系统可以通过功能化修饰实现靶向递送,将药物、基因或抗体等直接运送到疾病部位的组织或细胞,实现药物的靶向输送以及到达靶点后的定向释放[4]。
临床化疗药物利福平进入体内后,对Mφ 内M.tb的杀伤效果差,结核患者病情缓解较慢,需大剂量长期用药(6~12 个月以上)。而高剂量的药进入体内后,杀伤Mφ 内M.tb的同时,由于脱靶性,药物也会大量进入其他正常细胞,从而引起对机体的严重不良反应[9]。前期研究表明,细胞自噬是破坏胞内感染菌的重要方法[10]。近年来,研究发现M.tb已经进化出多种机制以干扰自噬介导的M.tb清除路径,从而使其逃避细胞的免疫攻击,使其在胞内存活和复制[11]。
本研究中,制备了负载抗结核药物和自噬诱导剂的纳米笼,并通过对其进行甘露糖的表面修饰,增加了其对巨噬细胞的靶向性,表明所制备的纳米笼具有很好的生物安全性,不会引起红细胞溶血;同时,“纳米笼”具有很好的生物相容性,能快速被Mφ 吞噬,从而将负载的药物成功输送到宿主细胞内;体内实验证明,小鼠滴鼻给药后,靶向纳米笼可以富集在肺部。
机体内Mφ 与结核菌的相互作用影响结核菌的发展和生存,增强Mφ 对胞内M.tb的杀灭能力,成为抑制结核病发展的重要策略。而通过诱导Mφ 自噬以及自噬溶酶体的成熟在杀灭M.tb中起着关键调节作用。图4 中,我们利用装载自噬诱导剂Rapa 的纳米笼及自噬抑制剂3-MA,对比了自噬对Mφ 内结核菌清除的影响,结果显示,自噬可以促进胞内M.tb的清除,而抑制自噬则有利于M.tb的生长。
综上所述,本研究中我们成功构建了具有高Mφ靶向性、高生物相容性及高安全性的自噬“纳米笼”,并基于该纳米载体构建了具有自噬增强作用的纳米载体系统,用于抗结核药物的装载和Mφ 靶向输送,通过结合增强Mφ 自噬引发的免疫反应和Mφ 内的抗结核药物对M.tb直接杀伤,可更高效地杀灭胞内M.tb。

