基于PI3K/AKT/mTOR信号通路的过表达miR-29b对宫颈癌模型大鼠的干预作用
刘雪飞 曹宏 杜捷( 白城医学高等专科学校临床医学院,吉林 白城 7000; 吉林大学中日联谊医院普外科; 白城中心医院普外科)
宫颈癌在女性癌症发病率中排名第4 位,且近年发病呈年轻化的趋势〔1〕。宫颈癌从前期病变发展到原位癌,最终演变成浸润癌,属于一个量变与质变的过程,更是造成患者死亡的主要死亡〔2〕。磷脂酰肌醇3 激酶/蛋白激酶B/哺乳动物类雷帕霉素靶蛋白(PI3K/AKT/mTOR)信号通路能够被外界多种细胞所激活,参与在肿瘤的发生发展中〔3〕。其中PI3K/AKT 通路在维持细胞恶性生物学特征中发挥重要作用,调控机体细胞增殖、凋亡中国具有重要作用〔4〕。AKT/mTOR 信号通路为肿瘤相关的重要信号通路,其活性出现增强,与较多的恶性肿瘤发生及发展具有密切联系,具有门控分子的别称〔5〕。miRNA 为一类经过基因转录后,在调控过程中发挥关键作用的小分子RNA,其异常的表达在肿瘤的发生发展中有着密切联系〔6〕。本文选择建立宫颈癌模型大鼠,在基于PI3K/AKT/mTOR 信号通路下,探究过表达miR-29b 干预作用。
1 资料与方法
1.1 一般资料 选取40 只SD 健康雌性大鼠,由上海斯莱克动物实验中心提供,鼠龄8~11月龄,平均(9.5±1.2)月龄,体重219~246 g,平均(231.5±11.07)g。在相对湿度30%~36%、温度(23.5±1.3)℃的环境下,进行喂养大鼠1 w,光照12 h/d。本文研究获医院伦理委员会批准。miR-29b 及PI3K、AKT、mTOR mRNA(Sigma 公司);人宫颈癌Hela 细胞及磷酸盐缓冲液(PBS,Invitrogen 公司);AKT mRNA 抗体(Abcam 公司);糖类抗原(CA)125抗体(Millipore 公司);枸橼酸缓冲液(Cell Signaling公司)。血管内皮生长因子(VEGF)及鳞状细胞癌抗原(SCC)抗体及苏木素-伊红(HE)染色试剂盒(碧云天公司);流式细胞仪(美国AI 公司)。
1.2 方法
1.2.1 建模及分组 随机选取10 只为正常组,不做任何处理。余下30 只建立宫颈癌大鼠模型。无菌环境下,在RPMI1640 培养基中放入人宫颈癌Hela 细胞,以37℃、5%CO2的培养箱中进行培育24 h。后在对数生长期添加0.25%胰酶进行消化,后放置小牛血清培养基中,在消化过程终止后,以4℃、1 500 r/min进行10 min 离心处理,并充分洗涤,将细胞浓度调整为1×107/ml,使用移液枪吹匀后,将人宫颈癌Hela 细胞悬浊液进行抽取,在需要造模大鼠腋窝下进行注射,每只规格为0.5 ml,后回笼饲养7 d,当出现肿瘤结节为造模成功。其中随机选取10 只大鼠为模型组,不做任何处理为模型组。余下20 只沉默miR-29b 组注射0.2 μl/g antago miR-29b,过表达miR-29b 组注射0.2 μl/g ago miR-29b。
1.2.2 HE 染色 对待测标本进行脱蜡、水化等处理之后,将其在0.01 mol/L、95℃的枸橼酸缓冲液中浸泡,同时进行热修复,以3% H2O2环境下培育10 min,滴入山羊血清,26℃环境中培养30 min,抽离封闭液、添加一抗,将其置于5℃的环境中过夜培养,第2日置入二抗,在37℃恒温箱中培养30 min,清洗后进行二氨基联苯胺(DAB)显色、封片。
1.2.3 miR-29b 及PI3K、AKT、mTOR mRNA 检测以RT-PCR 对miR-29b 及PI3K、AKT、mTOR mRNA 表达进行检测,首先提取细胞总RNA,检测其RNA 纯度、含量,逆转录处理后获得cDNA,设计引物序列,采用2-ΔΔCt方法计算细胞间黏附分子(ICAM)-1 表达,PCR 引物以Primer Premier 6.0 软件进行设计(Invitrogen 公司合成)。其中miR-29b上游引物5′-GCGCGCTAGCACCATTTG-3′、下游5′-CAGTGCAGGGTCCGAGGT-3′;PI3K mRNA 上游引物 5′-TTGCTATGGCATCTTATTCGTAACGCA-3′、下游5′-GACTGCTTTGGAGCTGTTCTACTACTA-3′、AKT上游引物 5′-AGTCGTAACTCGTTAGGATGAGCTGTC-3′、下游5′-TCCTGAGTACTCTCGAGT-3′;mTOR mRNA 上游引物5′-CATCGTGCTGTTGG-GTGA-3′、下游5′-GTCCATCTTCTTGTCGAGGC-3′。
1.2.4 肿瘤体积、重量检测 分别对造模成功的大鼠肿瘤体积、重量进行检测,在采血后,对经过麻醉处死后宫颈癌大鼠的肿瘤进行完整剥离,以游标卡尺对肿瘤的长径a 与短径b 进行测量,根据V=axb2/2 对肿瘤体积计算,使用称重器测量肿瘤重量,均由同一人员操作进行。
1.2.5 CD3+、CD4+、CD8+检测 在禁食12 h 后,将大鼠静脉血3 ml 置入流式管内,将50 μl 乙二胺四乙酸(EDTA)抗凝血及10 μl CD3+、CD4+、CD8+单抗加入其中,在避光孵育20 min 后,将2 ml 溶血素置入,继续避光孵育20 min,以2 000 r/min、半径为8 cm,进行离心处理10 min,去除上清,添加2 ml PBS 进行混匀,后离心处理去除上清,在加入2 ml PBS 重悬混匀后,使用流式细胞仪对外周血T 淋巴细胞亚群CD3+、CD4+及CD8+水平检测。
1.2.6 CA125、VEGF 及SCC 水平检测 免疫组化法检测CA125、VEGF 及SCC 水平,以PBS 作为阴性对照,以CK19>10 μg/L 为阳性判断标准,当细胞膜或细胞质呈棕黄色或棕褐色为CK19 染色阳性信号。将组织蜡块进行石蜡切块,将厚度切为4 μm,以常规脱蜡、脱水,进行抗原修复,除去离子水孵化,并滴加ICAM-1 为一抗,在4℃置放12 h,进行2 次PBS 清洗,同时滴加聚合梅辅助剂,在37℃下水浴,进行持续孵化,时间为20 min;2 次PBS 清洗,并进行滴加IgG 多聚体。在37℃下水浴,进行持续孵化,时间为30 min。
1.3 统计学处理 采用SPSS21.0 软件进行F检验、t检验。
2 结 果
2.1 HE 染色 如图1 所示,HE 染色后,正常组细胞密度较高,且坏死较少,模型组细胞坏死多,细胞排列紊乱,沉默miR-29b 组坏死较多,细胞排列显著紊乱,过表达miR-29b 组坏死细胞得到降低,细胞排列较为紧密。
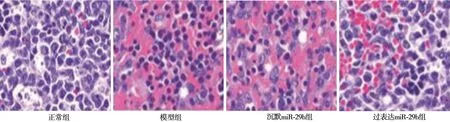
图1 各组宫颈癌组织HE 染色(×400)
2.2 肿瘤体积、瘤重及miR-29b 表达比较 与正常组相比,模型组、沉默miR-29b 组及过表达miR-29b组miR-29b 表达均明显较低,与模型组相比,沉默miR-29b 组miR-29b 表达明显较低,过表达miR-29b组明显较高(均P<0.05);与模型组相比,沉默miR-29b 组肿瘤体积与瘤重均明显较高,过表达miR-29b组肿瘤体积与瘤重均明显较低(P<0.05)。见表1。
2.3 PI3K、AKT、mTOR mRNA 表达比较 与正常组相比,模型组、沉默miR-29b 组及过表达miR-29b组PI3K、AKT、mTOR mRNA 表达均明显较高,与模型组相比,沉默miR-29b 组PI3K、AKT、mTOR mRNA 表达均明显较高,过表达miR-29b 组PI3K、AKT、mTOR mRNA 表达均明显较低(P<0.05)。见表1。
表1 各组肿瘤体积、瘤重、PI3K mRNA、AKT mRNA、mTOR mRNA 表达比较(±s,n=10)

表1 各组肿瘤体积、瘤重、PI3K mRNA、AKT mRNA、mTOR mRNA 表达比较(±s,n=10)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与沉默miR-29b 组比较:3)P<0.05;下表同
组别肿瘤体积(mm3)瘤重(g)miR-29b 表达PI3K mRNAAKT mRNAmTOR mRNA正常组1.05±0.180.11±0.010.07±0.010.05±0.01模型组141.52±15.260.34±0.040.42±0.071)0.52±0.051)0.42±0.041)0.39±0.041)沉默miR-29b 组149.46±16.532)0.41±0.052)0.26±0.051)2)0.64±0.071)2)0.59±0.071)2)0.57±0.071)2)过表达miR-29b 组70.53±9.572)3)0.25±0.032)3)0.94±0.121)2)3) 0.32±0.041)2)3) 0.28±0.031)2)3) 0.26±0.021)2)3)--
2.4 CD3+、CD4+及CD8+指标水平比较 与正常组相比,模型组、沉默miR-29b 组及过表达miR-29b 组CD3+、CD4+指标水平均明显较低、CD8+指标水平明显较高(均P<0.05);与模型组相比,沉默miR-29b组CD3+、CD4+指标水平均明显较低、CD8+指标水平明显较高,过表达miR-29b 组CD3+、CD4+指标水平均明显较高、CD8+指标水平明显较低(均P<0.05)。见表2。
2.5 CA125、VEGF 及SCC 水平比较 与正常组相比,模型组、沉默miR-29b 组及过表达miR-29b 组CA125、VEGF 及SCC 水平均明显较高(均P<0.05);与模型组相比,沉默miR-29b 组CA125、VEGF 及SCC 水平均明显较高,过表达miR-29b 组CA125、VEGF 及SCC 水平均明显较低(P<0.05)。见表2。
表2 各组CD3+、CD4+及CD8+、CA125、VEGF 及SCC 指标水平比较(±s,n=10)

表2 各组CD3+、CD4+及CD8+、CA125、VEGF 及SCC 指标水平比较(±s,n=10)
组别CD3+(%)CD4+(%)CD8+(%)CA125(pg/ml)VEGF(ng/L)SCC(pg/ml)39.42±5.7234.36±4.58模型组25.84±4.261)21.35±3.451)43.57±4.391)74.51±3.261)105.28±10.391) 209.31±23.431)沉默miR-29b 组22.41±3.411)2)18.57±2.461)2)46.89±4.871)2)86.35±9.171)2) 129.33±13.571)2) 235.28±26.451)2)过表达miR-29b 组53.86±6.241)2)3) 51.23±5.711)2)3) 28.73±3.291)2)3) 42.46±5.281)2)3) 63.48±7.151)2)3) 96.73±14.781)2)3)正常组75.29±8.2368.47±7.8920.25±3.438.42±1.35
3 讨 论
宫颈癌为高度恶性肿瘤之一,具有较高的死亡率〔7,8〕。关于宫颈癌的治疗,通过进行手术、放化疗等临床治疗手段,均能够取得较好的效果,但长期的治疗效果仍不能达到理想〔9〕。近年来,关于宫颈癌治疗的研究主要集中在基因的靶向治疗,尤其是microRNA。相关研究显示,microRNA 的异常表达,在肿瘤的发生发展中具有重要联系〔10〕。其中miR-29 作为一类抑癌基因,在恶性肿瘤中为低表达。miR-29b 作为具有代表性一种,能够对癌细胞的生长与转移发挥负性调控作用〔11〕。
miR-29b 出现于哺乳动物的细胞代谢蛋白质结构降解氨基酸分解过程中。其作为一种抑癌因子,能够促进肿瘤细胞的凋亡、肿瘤基因DNA 甲基化的抑制,减少肿瘤增殖与增加化疗敏感性,进而抑制肿瘤进展。相关研究显示,在肿瘤细胞的调控分化、凋亡以及转录中,均有miR-29b 参与其中〔12〕。通过对肿瘤细胞杀伤,降低肿瘤体积及重量,从而改善机体免疫功能,提升患者生存率。肿瘤体积是病理学有效评价化学与生物治疗肿瘤效应的指标〔13〕。本文研究结果说明过表达miR-29b 对宫颈癌大鼠进行干预,能够促进肿瘤细胞的凋亡。
PI3K 为细胞内磷脂酰肌醇激酶,其能够对细胞的休眠、增殖、癌变及凋亡进行调控〔14〕。AKT 属于PI3K 下游基因,能够因PI3K 正反馈进行调控。PI3K/AKT/mTOR 信号通路能够被外界的多种细胞所激活,进而使得下游蛋白AKT 得到激活〔15〕。AKT 能促进肿瘤细胞的增殖抗凋亡及化疗耐受的作用,现已被定义成癌基因〔16〕。mTOR 为AKT 下游底物的底物之一,氨基酸系列高度保守,当通过磷酸化的mTOR 将增强肿瘤细胞的生长及分化相关蛋白的表达,进而促进肿瘤的发生〔17〕。同时活化的mTOR 能够抑制肿瘤细胞的自噬。本研究结果说明过表达miR-29b 对宫颈癌大鼠进行干预,能够减少肿瘤增殖。
在宫颈癌小鼠中,出现局部的免疫失衡是导致出现癌症的主要原因。相关研究显示,在宫颈癌发生发展中,免疫系统出现紊乱在其中有着明显参与〔18〕。因此,关于宫颈癌的治疗,改善其免疫系统是关键。在免疫功能中,T 细胞是细胞免疫的重要效应细胞〔19〕。当T 细胞亚群出现免疫失衡,往往意味着肿瘤标志物水平得到显著升高。本研究结果说明过表达miR-29b 对宫颈癌大鼠进行干预,能够提升宫颈癌大鼠免疫功能。
SCC 是诊断宫颈癌的可靠标志物之一,在鳞状上皮细胞的癌细胞中分泌。当发生宫颈癌时,其水平会明显升高〔20〕。CA125 属于较为典型的一种高分子糖白,在体腔上皮组织细胞中较多分布,能够显著表达肿瘤性疾病,其强度远高于非肿瘤疾病。相关研究显示,在血清中CA125 能够有效评价妇科肿瘤情况及术后复发情况〔21〕。肿瘤新生血管的生成是肿瘤生长的基础,在肿瘤血管的形成中VEGF 发挥重要作用,其水平的升高能够显著提升恶性肿瘤的体积增加〔22〕。本研究结果说明过表达miR-29b对宫颈癌大鼠进行干预,能够减少肿瘤新生血管的生成,抑制宫颈癌病情的发展。
综上,在PI3K/AKT/mTOR 信号通路下的宫颈癌大鼠,进行过表达miR-29b 干预,能够显著改善宫颈癌免疫功能,促进肿瘤细胞的凋亡,减少肿瘤增殖及肿瘤新生血管的生成,使宫颈癌病情得到控制。

