CT计算脑池血容量对老年动脉瘤性蛛网膜下腔出血患者预后的预测价值
张庭庭 孟思 吉思璇( 三亚市中医院影像科,海南 三亚 57000; 三亚中心医院(海南省第三人民医院)放射科; 三亚市中医院放射科)
蛛网膜下腔出血(SAH)占脑卒中的3.2%,是严重的出血性脑卒中,近半数SAH 患者在30 d 内死亡,2/3 的幸存者残留不同程度的后遗症〔1,2〕,其中动脉瘤破裂引起的动脉瘤性蛛网膜下腔出血(aSAH)占所有SAH 的85%左右〔3〕。对SAH 患者进行危险分层且识别预后不佳因素有助于对患者进行针对性处理,提高诊疗水平并改善患者预后,尽管目前已提出了多种基于CT 的分级系统,但尚未达成共识,还有待进一步深入分析CT 图像以获得更有预后指示效能的影像学标志〔4〕。研究报道CT 计算脑池血容量与SAH 后迟发性脑缺血的发生有关〔5〕,但关于脑池血容量与SAH 患者远期预后关联的研究仍十分有限,本研究旨在探讨脑池血容量对aSAH 患者预后的预测价值。
1 资料与方法
1.1 一般资料 连续纳入2017年2月至2020年2月三亚市中医院老年aSAH 患者85 例,随访时间9.5~41.8 个月,中位随访时间21.4 个月。收集患者临床资料,包括年龄、性别、吸烟史、糖尿病史、高血压史、动脉瘤部位、直径、Hunt-Hess 分级、Fisher分级、并发症、发病至治疗时间及治疗方法。
1.2 纳入与排除标准 纳入标准:①初次急诊发病,伴头痛、恶心、呕吐、昏迷症状;②经头颅CT 检查发现SAH,CT 血管造影(CTA)及数字剪影血管造影(DSA)检查确诊aSAH;③发病8 h 内入院;④年龄≥60 岁。排除标准:①合并严重心、肺、肝、肾等脏器功能不全;②合并颅内感染、颅内肿瘤、缺血性脑卒中;③合并急慢性感染;④3 d 内死亡或家属放弃治疗;⑤脑血管畸形、血管炎或创伤所致的SAH。本研究经医院伦理委员会批准。
1.3 CT 计算脑血池血容量 采用西门子64 排螺旋CT 从颅顶至第一颈椎下缘扫描,管电压为100~120 kV,通过自动曝光控制系统调节管电流,参考200 mA,准直64 mm×0.6 mm,螺距1.2,层厚0.75 mm,间隔0.5 mm,矩阵512×512,旋转时间0.33 s,扫描时间3~5 s。50 ml 碘海醇(GE Healthcare,Omnipaque 350)经Medred 双筒高压注射器及19 号密闭式静脉置留针静脉滴注用于增强成像,注射速率为3~5 ml/s,50 ml 盐水,速率与造影剂一致。使用发病后入院首次CT 扫描图像用于分析,如果在24 h 内发生再出血,则使用再出血后的CT扫描图片。脑池血容量具体计算方法为,首先确定包含血肿的CT 切面,分别计算各切面上血肿面积(S),则相邻切面间血容量为20×(S1+S2)/2,依次计算所有相邻切面间血容量再将其相加得到总脑池血容量。由两位有经验的影像科医师对图像进行独立分析,脑池血容量取两者均值〔6〕。
1.4 随访 通过1 次/月门诊复诊和1 次/w 电话联系对患者进行随访,随访截至2020年11月30日,采用格拉斯哥预后评分(GOS)对患者预后进行评估:临床症状消失,恢复良好计5 分;中度功能障碍,但可独立生活和工作计4 分;严重功能障碍影响日常生活和工作计3 分;持续性植物状态计2 分;死亡计1 分,其中GOS 4~5 分为预后良好,1~3 分为预后不良〔7〕。至随访截止日期共失访6 例(7.1%),男24 例,女55 例;平均年龄(65.8 ±7.4)岁;动脉瘤直径(6.4±3.4)mm;发病至治疗时间(6.2±1.7)h;脑出血容量54.0(14.2,66.7)ml。
1.5 统计学分析 采用SPSS19.0 软件进行t检验、χ2检验、Fisher 精确性检验、Kaplan-Meier 检验、对数秩分析,生存率用寿命表法计算;采用Cox 比例风险回归模型分析各危险因素对患者预后的预测价值并依据COX 回归模型,将回归系数扩大10 倍,并将其整数化作为对应因素分值,建立预后预测评分表,根据预测概率计算公式P=e^(β0+score/10)/〔(1+e^(β0+score/10)〕计算预测概率〔8〕。其中β0为模型中的常数,score 为评分模型总得分;使用受试者工作特征(ROC)曲线评估模型预测效能。
2 结 果
2.1 不同脑池血容量患者生存分析 根据脑池血容量将患者分为低脑池血容量组(≤54 ml)与高脑池血容量组(>54 ml)。全队列总生存率为77.2%,生存时间为(35.1±1.3)d(95%CI:32.6~37.7 d),其中低血容量组为90.0%,高血容量组生存率为64.1%;低血容量组生存时间为(38.6±1.2)d(95%CI:36.1~41.0 d),高于血容量组的(32.1±2.0)d(95%CI:28.2~36.0 d),差异有统计学意义(P=0.02)。见图1。
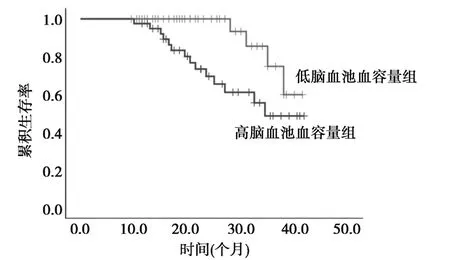
图1 不同脑池血容量患者生存曲线
2.2 预后单因素分析 截至随访日期共18 例(22.8%)预后不良。单因素分析结果显示,预后不良患者年龄、动脉瘤直径、Hunt-Hess 分级、Fisher 分级、脑池血容量、再出血及发病至治疗时间与预后良好患者差异有统计学意义(P<0.05)。见表1。

表1 预后因素单因素分析〔n(%),n=79〕
2.3 相关因素对患者预后COX 比例风险回归分析对患者年龄、动脉瘤直径、Hunt-Hess 分级、Fisher分级、脑池血容量、再出血及发病至治疗时间进行共线性诊断,排除共线性后各变量赋值情况为年龄(X1):1=>66 岁,0=≤66 岁;动脉瘤直径(X2):1=>6.4 mm,0=≤6.4 mm;Hunt-Hess 分级(X3):1=Ⅲ、Ⅳ级,0=Ⅰ、Ⅱ级;Fisher 分级(X4):1=Ⅲ、Ⅳ级,0=Ⅰ、Ⅱ级;脑池血容量(X5):1=>54 ml,0=≤54 ml;再出血(X6):1=>是,0=≤否;发病至治疗时间(X7):1=>6.2 h,0=≤6.2 h;预后(Y):1=预后不良,0 = 预后良好。COX 分析显示动脉瘤>6.4 mm、Hunt-Hess 分级Ⅲ、Ⅳ级、脑池血容量>54 ml、再出血及发病至治疗时间>6.2 h 是影响患者预后的独立危险因素(HR>1,P<0.05,P<0.001),将回归系数扩大10 倍,并将其整数化作为对应因素分值,据此动脉瘤直径>6.4 mm 赋值6 分、Hunt-Hess 分级Ⅲ、Ⅳ级赋值3 分、脑池血容量>54 ml赋值4 分、再出血赋值8 分,发病至治疗时间>6.2 h 赋值6 分,预后风险预测评分表总分27 分,分数越高患者预后越差。见表2。
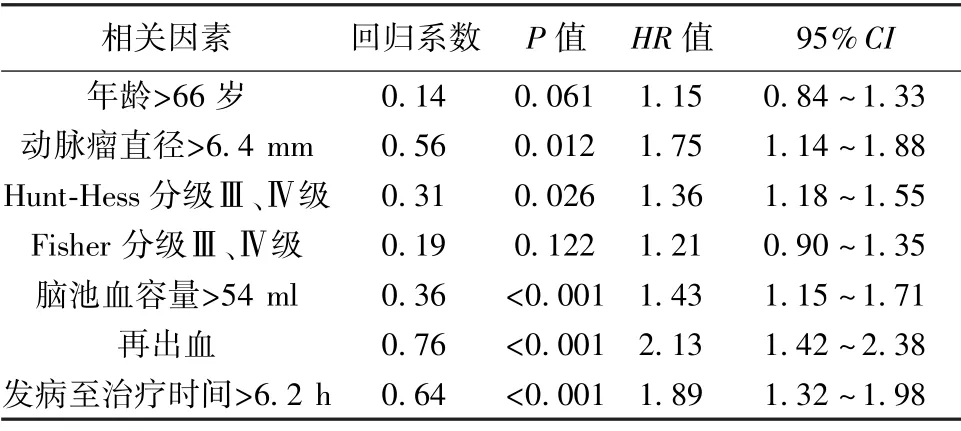
表2 影响预后的因素的COX 比例风险回归分析
2.4 预后风险评分模型及其预测效能 ROC 分析显示回归模型区分预后不良患者的曲线下面积(AUC) 为0.911 (95%CI: 0.834~0.987,P<0.001),最佳截断值为18 分。根据COX 回归模型最佳截断值将其分为评分≥18 分的高危组(28 例)及<18 分的低危组(51 例),根据预测风险概率计算公式计算患者的预后不良发生率,低危组预后不良4 例, 高危组14 例, β0 为17.7, 实际发生率(22.8%)与预测发生率(25.3%),差异无统计学意义(P=0.710)。
3 讨 论
CT 作为疑似aSAH 患者的重要筛查手段,其多种征象均被报道与aSAH 患者的预后相关,如白质通透性,脑萎缩程度及静脉延迟等〔9〕,CT 中显示的脑池血容量可直接来源于破裂的动脉瘤,也可通过蛛网膜下腔经Luschka 小孔分配至脑池,无论何种途径均可引发脑血管痉挛、微血栓形成或皮质扩散性缺血〔10〕,本研究以CT 计算得到的脑池血容量为标志物对患者进行危险分层,结果发现队列患者脑池血容量均值为54 ml,与之前的报道相近〔10〕,而高脑池血容量患者预后明显差于低脑池血容量患者,提升脑血池血容量可作为指示患者预后的潜在影像学指标。
本研究发现动脉瘤直径、Hunt-Hess 分级、脑池血容量、再出血及发病至治疗时间是影响患者预后的独立危险因素,其中入院后再出血是患者预后不良的强预测因素,其相对危险度达到2 以上,此类患者可能存在多种遗传或解剖结构上的异常,因此动脉瘤极不稳定且治疗效果欠佳〔11〕。按照Yasargil 分类法可将颅内动脉瘤分为微小型(<2 mm)、小型(2~5 mm)、中型(6~14 mm)、大型(15~25 mm)和巨型(>25 mm)5 型,aSAH 的动脉瘤多属于中小型,随后Koopman 等〔12〕研究指出动脉瘤的大小与患者再出血风险相关,较大的动脉瘤其内血流动力学倾向不稳定,其瘤壁所受张力不均以致更易破裂。Hunt-Hess 分级是基于神经系统症状及体征的分级系统,可在一定程度上指示患者病情严重程度,但其评分项目实施过程繁琐〔13〕,从结果看其预后预测效能一般。既往对aSAH 手术时机的研究指出尽早进行手术治疗对改善患者预后至关重要,而对于开颅或介入手术的优劣仍存在争议〔14〕,本研究同样强调了治疗开始时间对患者预后的重要性。既往文献报道女性及吸烟史是aSAH 患者预后的预测因子〔15,16〕,而本研究未发现这种显著性,这可能与人种间差异及研究对象选择偏移有关。
本文使用上述5 个危险因素构建了预后风险评分模型,该模型区分预后不良患者的AUC 达到0.9以上,根据预测风险概率计算公式所得的预测不良事件发生率与实际发生率之间未见统计学差异,进一步验证了该模型对患者预后的预测价值。
本研究主要不足之处在于受中心规模所限,纳入样本量不足,后续研究将进一步扩充研究对象作为验证集验证研究结论,此外,目前已有多种影像学及血清学指标用于预测患者预后,后续研究有必要联合此类指标以更精准判断患者预后〔17〕,最后,由于目前不同中心对SAH 的治疗水平差异明显,后续研究需纳入多中心病例进行亚组分析。

