ET-1作为癌前病变分子标志物的价值及应用
孟韬 张大伟 ( 吉林省人民医院结直肠肛门外科,吉林 长春 3000; 长春市人民医院普通外科)
直肠癌系源于上皮的肿瘤,其中腺癌占95%,也是最常见的消化道肿瘤,在大城市发病率明显上升。经深入研究,约70%是由腺瘤性息肉演变而来。随分子生物学技术的发展,癌变过程中的基因改变逐渐被认识,已知直肠癌的发生、发展是一个多步骤、多阶段、多基因参与的细胞遗传性疾病;因此寻找一种特异的分子标志物对直肠癌的早期诊断十分重要。随分子生物学检测技术的提高,对直肠癌生物学特性的不断深入,内皮素(ET)及其拮抗剂成为近年来研究的热点。ET 在诸多恶性肿瘤中呈现出不同的表达状态,并参与肿瘤的进展、转移、血管重构等〔1〕,其中以ET-1 的表达最为突出〔2〕,多项研究〔3~5〕先后报道了ET-1 在乳腺癌组织及血液中呈高表达状态,可作为肿瘤标志物检测,然而在直肠癌中表达情况国内报道甚少。本研究拟分析ET-1 作为癌前病会分子标志物的价值及应用。
1 材料与方法
1.1 标本收集与分组 前瞻性收集吉林省人民医院肛肠外科直肠癌患者60 例(直肠癌组);其中女23 例,男37 例;年龄58~88 岁,中位年龄73 岁;直肠癌病理类型:腺癌30 例、黏液腺癌15 例、腺鳞癌10 例、其他特殊型癌5 例。取癌旁正常良性组织标本30 例为良性组,癌前病变组织标本30 例(腺瘤)为癌前病变组。入选前均经肠镜检查,明确病理学诊断。另选健康志愿者血清标本20 例为血清对照。入组标准:①术前均行肠镜检查并取病理活检,明确病理诊断为直肠癌、良性腺瘤;②未接受过放、化疗、靶向等抗肿瘤药物治疗;③预期生存期≥3 个月;④辅助检查评估心、肝、肾等主要脏器功能基本正常。排除标准:①接受过放化疗治疗、靶向治疗;②合并骨转移、严重骨质疏松;③存在严重或不能控制的全身性疾病者;④无法控制的活动性感染、各类传染病者。所有患者自愿入组,符合医学伦理标准。将3 组病理组织适量分别放入30%甲醛浸液中保存待测。
1.2 直肠癌组织ET-1 检测 采用免疫组化法(IHC)测定,标本用ABC 法标记:①制作石蜡切片;②脱蜡;③去除内源酶3%H2O215 min;④蒸馏水与0.01 mol/L 磷酸盐缓冲液(PBS,pH 7.4) 浸洗;⑤一抗:兔抗大鼠ET-1 抗血清(上海德波生物技术有限公司)1 ∶400,4℃过夜孵育;⑥PBS 浸洗;⑦二抗:生物素化羊抗兔抗血清1 ∶500,37℃30 min;⑧PBS浸洗;⑨三抗:ABC 复合物,1 ∶100,37℃40 min;○10二氨基联苯胺(DAB)显色,5 min。每例切片选5 个高倍视野(×400),随即选测80~100 个ET-1 细胞吸光度值,计算平均吸光度值,以平均值(A)表示细胞中的ET-1 的含量。
1.3 血清ET-1 检测 清晨空腹采集右肘部静脉血3~5 ml,手术患者术前1~3 d 采集。采集完成后注入含10%乙二胺四乙酸二钠和抑肽酶的试管中混匀(上海艾研生物、货号367863、6 ml),4℃下,3 000 r/min离心15~20 min。分离出血清用0.1%TFA 6 ml 酸化,3 000 r/min离心20 min 后取其上清液,放置于-80℃冰箱保存待测。术后7~10 d 再次采集血液标本,制作及保存方法同上。
1.4 结果判定 IHC:应用德国CMIAS-008 型真彩色医学图像分析仪,IHC 标记显示:ET-1 阳性细胞其胞质表现为棕黄色或黄色细颗粒状,若阳性细胞在标记的细胞总数中超过60%者,标记为阳性病例。PCR:试剂盒为进口Austria 生产,仪器:γ 计数仪为美国bookman。主要技术参数:ET-1 测定范围20~4 680 pg/ml,灵敏度10 pg/ml,回收率平均95%~100%,批内变异系数(CV)<5%,批间CV<10%,正常参考值38.78~71.50 pg/ml。
1.5 统计学方法 采用SPSS17.0 软件进行t检验、单因素方差分析。
2 结 果
2.1 IHC 测定3 组ET-1 吸光度值比较 直肠癌组平均吸光度值(0.233±0.071)>癌前病变组(0.107±0.060)>良性组(0.029±0.072),差异有统计学意义(P<0.05)。
2.2 术前、术后3 组血清ET-1 水平比较 术前直肠癌组血清ET-1 表达水平〔(77.87±7.98)pg/ml〕明显高于癌前病变组〔(51.21±8.43)pg/ml〕和良性组〔(42.28±8.34)pg/ml;P<0.01〕,术后〔(72.25±8.56)pg/ml〕较术前明显降低(P<0.01),但仍显著高于良性组和癌前病变组(P<0.01)。
2.3 直肠癌组织与临床病理分级、淋巴结、TNM 分期的关系 直肠癌组血清ET-1 与组织ET-1 表达结果吻合,组织学分级越差表达越高、伴淋巴结转移阳性者表达越高、TNM 分期越高表达越高(均P<0.05)。见表1。
表1 组织ET-1、血清ET-1 与直肠癌临床特征关系(±s)
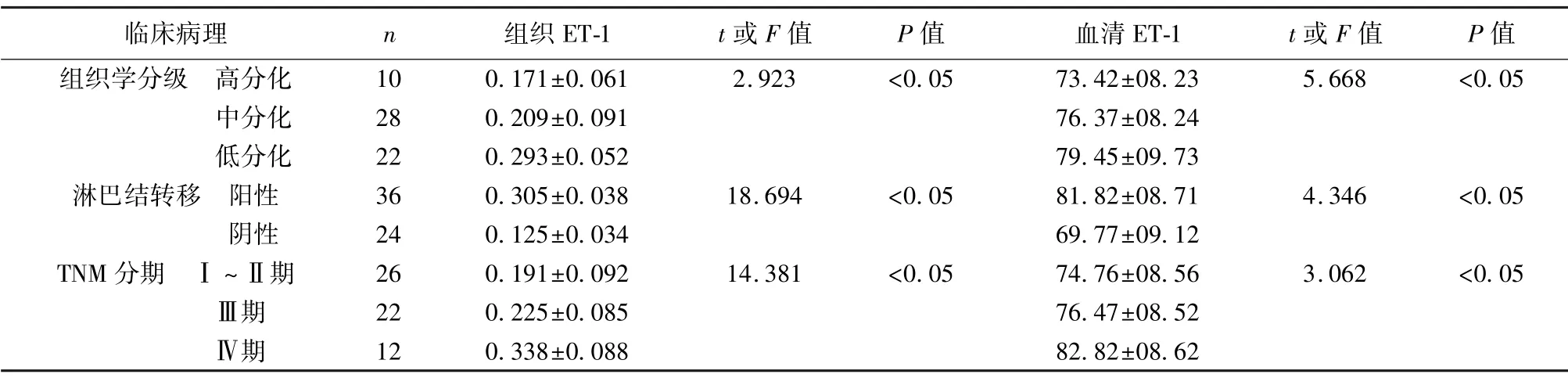
表1 组织ET-1、血清ET-1 与直肠癌临床特征关系(±s)
临床病理n组织ET-1t 或F 值P 值血清ET-1t 或F 值P值组织学分级 高分化100.171±0.0612.923<0.0573.42±08.235.668<0.05中分化280.209±0.09176.37±08.24低分化220.293±0.05279.45±09.73淋巴结转移 阳性360.305±0.03818.694<0.0581.82±08.714.346<0.05阴性240.125±0.03469.77±09.12 TNM 分期 Ⅰ~Ⅱ期260.191±0.09214.381<0.0574.76±08.563.062<0.05Ⅲ期220.225±0.08576.47±08.52Ⅳ期120.338±0.08882.82±08.62
3 讨 论
ET 是1988年由Yanagisawa 等〔6〕首次从培养的猪主动脉内皮细胞上清液中分离并纯化出来,由21种氨基酸残基组成的一种血管活性多肽,具有多种生物学作用〔7〕,如收缩血管、导致疼痛、促进肿瘤浸润与转移。在正常人血液中ET 主要由血管内皮细胞产生,起到一种神经调节因子或局部激素样作用,ET-1 有两个同分异构体〔8〕:ET-1、ET-2。其中ET-1起决定性生理作用〔2〕,肿瘤细胞表达趋化因子受体CCR7 可被ET-1 与受体ETA 结合作用及同HIF-let协调共同促进,其表达的趋化因子受体可以通过其趋化性诱导入侵和转移及肌动蛋白聚合和伪足的形成,如通过淋巴转移,显示肿瘤的器官特异性转移〔9,10〕。近年来研究表明ET-1 大量存在于恶性肿瘤细胞内,与肿瘤生长、浸润关系密切〔11〕。而国内对ET-1 在直肠癌组织内报道甚少。
本研究结果说明直肠癌组织细胞内大量存在ET-1,多项研究提出在乳腺癌患者组织及血清中含有大量ET〔3~5〕,并可作为乳腺肿瘤标志物检测,与胃癌组织内表达相同。本文结果还说明,ET-1 在直肠癌患者肿瘤组织中及血液中大量存在,癌前病变内也广泛存在,因此联合ET-1 检测对直肠癌的筛查及协助直肠癌诊断同样具有一定参考价值,并可以单独作为直肠癌肿瘤的分子标志物,其血清学检测方法快捷、便利、且无创。
本研究结果表明,直肠癌恶性程度越高,ET-1表达水平及平均吸光度值越高,其中在低分化直肠癌中ET-1 表达最高,如合并淋巴结转移者表达会更加明显,分期越高表达越高。这可能因为恶性程度高的直肠癌细胞,其增殖、浸润能力较强,所以其在肿瘤增殖及浸润中扮演重要角色,与相关研究内容一致〔12,13〕。这对判断直肠癌患者临床分期、恶性程度和预后有重要意义。另外本文进一步说明ET-1表达情况和直肠癌转移具有相互一致性,并可以作为判断预后的一项因素。故临床应用中可以通过检测ET-1 初步评价患者病理、临床分期,甚至可以判断远期预后。本研究还存在不足之处:(1)目前标本收集数量有限,需要大量数据支持;(2)病理类型较多未进行细化;(3)癌前病变标本单一,本研究只有腺瘤,需要更多癌前病变标本加以支持;(4)血清ET-1 对判断远期预后还需要进一步随访。目前还有学者研究ET 能促使癌细胞血管、淋巴管生成〔14,15〕,虽然ET 在不同组织的具体作用还存在一定争议,但ET-1 在上述肿瘤中表达明显,因此利用ET 受体拮抗剂行分子靶向治疗将成为治疗胃癌的新希望,有待于更多临床数据证实。

