原位杂交技术检测组织切片中MicroRNA的应用进展
丁成龙 刘滢 刘爽(佳木斯大学 附属第一医院病理科,黑龙江 佳木斯 5400; 临床医学院; 基础医学院)
微小核糖核酸(microRNA) 又称miRNA 或miR,是目前研究最为深入的一类非编码RNA。至今人类已发现超过2 000 种与疾病相关的miRNA。即使miRNA 的检测方法众多,但有部分学者认为,想要真正证明miRNA 的作用和位置,原位杂交(ISH)技术必不可少。因此,本文从探针、标记物、检测系统等方面总结ISH 技术的当前进展,分析探讨其优势和局限性,为临床病理检测提供新路径。
1 ISH 概述
ISH 是指通过已知特定的标记探针与组织样本中待检测的分子特异性结合的分子检测技术,广泛用于分子和细胞病理学研究领域。ISH 起源于20世纪70年代,最初是由美国耶鲁大学的Gall 等〔1〕使用核糖体基因探针确定其定位于卵母细胞的核仁中。同年,Buongiorno-Nardelli 等〔2〕在中国仓鼠组织切片中使用3H 标记的rRNA 探针,首次成功使用ISH。由于同位素标记探针使用范围局限,传统生物标记法和核酸探针不断改良,ISH 检测范围也从提供基因和染色体的相对位置关系逐渐扩展到原位检测RNA 和miRNA。MiRNA 是一类长约22 个核苷酸的非编码小RNA 分子。它们通常在介导转录后发生基因沉默。因其不作为蛋白质合成的直接模板不能进行免疫组化检查。其中能对单个细胞水平和定位了解的唯一方式就是ISH。2006年,Nelson等〔3〕首次使用ISH 检测miRNA。近年来随着ISH在miRNA 研究的重要性不断提高,其检测方法也不断细化。从材料上看,已经报道的miRNA ISH 实验方案中包括应用石蜡组织切片、低温冷冻组织切片和细胞等。由于石蜡包埋组织块便于长期保存,有利于回顾性研究,因此石蜡组织切片在miRNA ISH技术中应用最为广泛。
2 ISH 技术优势
2.1 定位效应 由于miRNA 分子量小、长度短且表达水平低、易降解,因此主要采用聚合酶链反应(PCR)、微阵列杂交、基因克隆和ISH 等方法检测miRNA 的表达情况。由于前几种方法虽然能定量显示miRNA 的表达,但都无法检测miRNA 在组织或细胞中的定位情况。而ISH 的优势在于其能监测miRNA 在细胞和亚细胞的分布和组织学定位,并确定其空间表达谱。一般来说,miRNA 定位于细胞核、细胞质或是细胞外基质十分重要。Eckstein等〔4〕使用免疫荧光双重染色对前列腺癌细胞中的miRNA 进行定位。研究表明,miR-375 主要定位于肿瘤细胞尤其是腔腺细胞的核仁中。而在模式4 组(GP4)和淋巴结转移标本中,miR-145 在间质细胞中仅在细胞核中表达,而在肿瘤细胞中不表达。
此外,在小鼠脑组织中miRNA 的表达部位也各有特点。其中,miR-9 主要位于梨状皮质、海马CA和DG 区,而miR-100 主要在DG 的亚颗粒区,在海马CA1 和基底外侧杏仁核中强烈表达。除了正常组织功能定位,肿瘤组织及癌旁组织中miRNA 的表达及定位的差异尤为重要〔5〕。通过ISH 对比同一区域非小细胞肺癌组织和正常肺组织的miRNA-148a 的表达水平,发现在癌组织中miRNA-148a 弱染色,而邻近正常肺组织中呈现强染色,表明miRNA-148a 在肺癌组织中被下调〔6〕。
2.2 半定量分析 除了进行组织定位,ISH 还可以联合其他生物学方法进行定量分析。在黑色素瘤细胞中,miR-21 和miR-125b 存在异常表达。数字图像分析定量的ISH 进一步显示miR-21ISH 在黑色素瘤中表达增加,而miR-125b 的定量显示在痣和黑色素瘤中表达一致〔7〕。Nizyaeva 等〔8〕通过石蜡切片和地高辛(DIG)ISH 检测先兆子痫和晚期子痫前期孕妇胎盘绒毛中miRNA-146a 和miRNA-155 的表达。与足月妊娠相比,先兆子痫晚期孕妇绒毛细胞中miRNA-155 和miRNA-146a 的表达均减少〔8〕。另外,Wang 等〔9〕通过ISH 发现,在正常的胃黏膜上皮细胞和胃癌细胞中均有miR-214 的表达,且胃癌组织中的表达程度明显降低。
3 在miRNA 检测中ISH 方法进展
经典的ISH 过程是依赖于核酸探针与固定细胞或组织中特异性序列互补,并通过显色、荧光或电子显微镜等方法可视化杂交探针来进行检测。在miRNA 检测中,影响ISH 技术效果的关键变量主要包括使用探针的类型、标记物和检测系统。其中,多数新型ISH 技术可通过调整方法变量达到期望要求,以下将分别追踪这3 个方面的进展阐述ISH 的发展过程。
3.1 探针发展 探针设计是ISH 实验中关键步骤之一,常见的探针包括寡核苷酸探针、cDNA 探针和cRNA 探针〔10〕。通常用于甲醛溶液固定或石蜡切片的探针最佳大小为20~500 个碱基对。miRNA 检测中常见的ISH 探针,见表1。但在miRNA 原位杂交实验中,由于miRNA 尺寸较短,传统的DNA 或RNA 探针与靶序列结合的亲和力较低。因此,许多学者通过修饰探针组件提高探针与靶标的亲和力和特异性用于改进ISH 在miRNA 中的应用。目前miRNA ISH 探针分为2 类:线性探针或“扩增”探针。
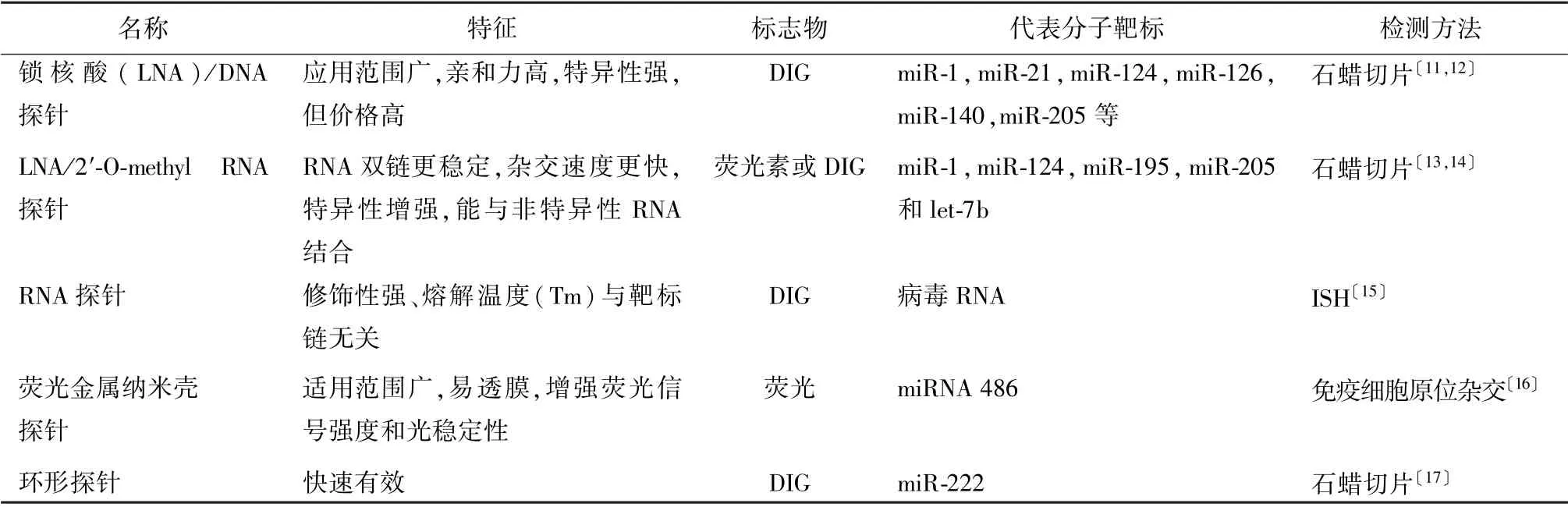
表1 常见的ISH 探针
3.1.1 线性探针 LNA 是最广泛用于miRNA ISH探针之一,也被视为是miRNA 特异性诊断的金标准。其结构主要是通过2′-O、4′-C 构成亚甲基桥,将核酸锁在C3′内构象中。与传统寡核苷酸探针相比,使用具有LNA 合成的探针能适应更高的杂交温度,且稳定所得的双链体达到更高的特异性。Chu等〔18〕使用双地高辛标记的LNA 探针检测结果显示44%原发甲状腺癌患者miR-21 呈现出强表达。虽然其优势明显,但其价格昂贵也相对限制其使用范围。因此,在LNA 探针基础上进行修饰是目前较为主流的探针选择。早期发现在LNA 探针3、6、15、20 位的碱基处添加2′-氟修饰的RNA 残基(2′-F RNA) 后miR-146b 和miR-375 稳定性增强〔19〕。2019年,Azevedo 等〔20〕发现2′-O-Me 修饰的探针能克服荧光原位杂交分析(DNA-FISH)低细胞通透性、低亲和力和低核酸敏感性等缺点。可见LNA 和2′-O-Me 结合探针比其他探针具有更高的设计灵活性。2020年Minogue 等〔21〕提出可利用核糖使LNA探针在2′-O 与4′-C 之间形成桥连结构,修饰的探针有利于增加反应的特异性并允许较低的信噪比。而基于此的ISH 技术能使miRNA 如miR-35-3p 在雌雄同体的性腺中以单细胞分辨率重复显示〔21〕。
3.1.2 “扩增”探针 为增加低频度miRNA 分子信号强度,与序列扩增技术结合的探针开始应用于ISH 中。“扩增”探针相比于线性探针,其不仅可以成功检测miRNA,而且还可以进一步检测序列。比如环形探针一般是通过DNA 连接酶使线性DNA 探针退到两端特定序列后进行环化。形成的圆环结构能通过滚轮效应进一步放大信号甚至延长序列。起初,Ge 等〔22〕通过在体外将探针与DNA 链接酶结合,然后形成环状结构最后与靶序列杂交,检测人肝癌SMMC-7721 细胞和正常肝脏LO2 细胞中miR-222 表达水平。此外,还有一种滚环扩增法使用的探针,利用这种探针进行的ISH 过程能在生理温度下高特异性鉴定miRNA,并在3 小时内于单个细胞中原位观察标记的miRNA〔23〕。
3.2 标志物发展 在大多数miRNA 原位杂交实验中,寡核苷酸探针首选的标志物是DIG。DIG 是从洋地黄类植物(毛地黄和毛花毛地黄)中提取的类固醇物质,在敏感性和质量控制上明显优于其他的生物标志物。2018年,Memi 等〔24〕通过使用DIG 标的LNA 探针在小鼠心脏组织切片中检测到miRNA-182 的表达,进一步免疫染色显示,心肌肌钙蛋白(cTn)T 能和miRNA-182 共同定位在心肌细胞。也有报道称,miR-138 可作为功能性肿瘤抑制因子,其与口腔鳞状细胞转移程度呈负相关。可通过DIG标记的miRNA 探针原位测量证实〔25〕。
除了DIG,新型的生物标志物也不断涌现,包括羧基荧光素(6-FAM),溴脱氧尿苷(BRDU)和生物素等。2016年,Zhmurov 等〔26〕通过6-FAM 标记定位了miR-126-3p 和miR-126-5p,证实它们与动脉斑块硬化内新生血管相关能促进疾病发展。最近,Kaur等〔27〕在视网膜细胞中利用BRDU 标记进行荧光共定位检测Shh 信号传导通路对视网膜再生的作用,结果发现Shh 信号通路受let-7 miRNA 的调节。BRDU 标记检测的miRNA 稳定性更强,效果更佳。在ISH 技术发展中,生物素也是近几年的研究热点。与DIG 不同,如果使用生物素作为半抗原标志物,则需要同时选择合适的生物素阻断剂来阻止生物素与内源生物素的结合,生物素易同内源生物素存在潜在的交叉反应〔28〕。
3.3 检测系统发展 在探索新型ISH 技术过程中,除了考虑传统的实验变量,更多的技术革新点主要集中在检测系统上。间接染色法是最初在ISH 检测中最常用的染色方法。但是由于miRNA 分子量小,表达量有限,早期染色方法明显观察不清miRNA 的表达,因此逐渐研发出基于放大信号的检测系统构成二代ISH 检测方法。LAB/LSAB 是利用高亲和力的抗生素-生物素/链霉素标价法构成的敏感性ICH检测方法,Diamandis 等〔29〕发现使用这种方法的亲和力是抗原-抗体相互作用的103~106 倍。同时,该种检测方法还能避免洗涤液、PH 变化对组织切片的影响,灵敏度更高。Shi 等〔30〕使用另外一种放大信号检测miRNA 的方法,名为抗生素蛋白-生物素复合法(ABC),但在实际应用中因为其敏感度比LSAB 法低5~10 倍,晶体尺寸过大限制其渗透到细胞中,使其应用受到局限。
相比上面的检测系统,酶标记的荧光信号放大法(ELF)在目前应用较为成熟。其主要通过磷酸酶进行发光底物裂解,沉淀出黄绿色荧光产物进行miRNA 分析。2016年,Lv 等〔31〕在食管癌患者标本中通过使用ELF 检测发现,同比癌旁组织,在哈萨克族和维吾尔族食管癌患者中miR-21 明显上调,miR-375 表达水平降低。随着纳米技术不断发展,近年来将纳米材料用于miRNA ISH 领域也成为一种新的检测miRNA 的手段,同时也是目前发展最快的领域之一。Ge 等〔22〕发现纳米壳层的使用能克服有机荧光团特有的困难,增加光稳定性和强度,同时使纳米壳层更好地穿透细胞膜,对miRNA 靶标具有高度特异性。
综上,miRNA ISH 已经广泛用于临床诊断。尽管ISH 是唯一能够定位miRNA 的方法,但其仍然具有局限性。一方面,ISH 的定量效应是不完全的,只能结合其他检测方法进行实际量化。同时,虽然能原位捕获miRNA 但仍然没有办法区分其功能状态。另一个不能忽视的方面是ISH 的单分子检测效率低,固定要求高。因此,如何克服ISH 技术在miRNA 检测上的局限性优化是目前需要解决的问题。

