阿格拉宾对小鼠肺缺血再灌注损伤的保护作用及机制
周 倩 胡晓晴 熊 娟 范国华
肺移植是治疗终末期呼吸系统疾病的的唯一手段[1]。肺缺血再灌注是指在供肺的冷缺血基础上,进一步恢复血流灌注导致的肺组织损伤加重的现象,其是导致肺移植功能障碍的主要原因。目前观点认为导致肺缺血再灌注损伤的主要机制主要包括氧化应激、无菌性炎症、肺组织细胞的调节性细胞死亡及自噬异常[2, 3]。在获取供肺和植入受者体内再灌注之间的这段时间内,肺暴露于缺血和严重缺氧的环境中,导致肺组织能量大量消耗,最终导致细胞死亡,同时释放大量损伤相关分子(damage-associated molecular patterns, DAMPs),诱发肺巨噬细胞炎症激活和焦亡[4];另一方面,研究表明自噬激活可通过改善血-气屏障来减轻肺缺血再灌注损伤[5]。因此,靶向抑制焦亡或激活自噬的化合物具有治疗肺缺血再灌注损伤的潜力。
阿格拉宾是一种从青蒿中分离出的无色结晶的双环化合物,具有多种药理活性,包括抗炎、抗氧化应激、抗凋亡及抗肿瘤等[6]。研究表明,阿格拉宾可通过抑制NLRP3炎症小体活化,激活自噬最终减少胰腺β细胞凋亡并预防2型糖尿病发生[7]。但阿格拉宾在肺缺血再灌注损伤中是否同样发挥保护作用目前尚未见报道。本研究通过建立左肺门夹闭构建了小鼠肺缺血再灌注损伤模型,同时观察并探讨了阿格拉宾预处理对小鼠肺损伤表型的影响及潜在机制。
材料与方法
1.实验小鼠:8~10周龄,体质量23.4~25.8g的雄性C57/B6小鼠购自湖北省预防科学院动物中心。实验小鼠饲养于武汉大学人民医院实验动物中心,温度22±1℃,湿度55%±5%。实验动物实验和管理批号:WDRM20180401。本研究中所有动物相关操作均获得武汉大学人民医院动物护理和使用委员会批准。根据随机数表法将实验小鼠分为4组,依次为对照组、阿格拉宾组、缺血再灌注组和治疗组,每组小鼠数量为10只。
2.实验试剂:阿格拉宾(纯度:99.17%,批号:HY-16059)购自MedChemExpress(中国)公司;一抗IL-1β(批号:ab254360)、MCP-1(批号:ab7202)、TNF-α(批号:ab215188)、NLRP3(批号:ab263899)、ASC(批号:ab283684)、Beclin1(批号:ab207612)、ATG7(批号:ab52472)、GAPDH(批号:ab8245)、羊抗兔IgG(批号:ab52947)购自英国Abcam公司。
3.肺缺血再灌注损伤模型的建立:参考既往文献报道的方式,缺血再灌注组小鼠术前12h禁食、禁水,戊巴比妥钠(2%)60mg/kg的剂量进行腹腔注射麻醉。麻醉诱导成功后,取仰卧位固定于保温平板,左侧胸部剃毛并消毒铺巾。使用特制静脉留置针进行气管插管,固定套管于小鼠上切牙。依次打开皮肤、筋膜及肌肉后,使用显微血管钳夹闭左肺门1h,随后松开显微血管钳再灌注2h。再灌注结束后使用眼科剪游离左肺门,获取肺组织标本。治疗组小鼠在肺门夹闭前1h给予阿格拉宾(5μg/kg)腹腔注射。
4.HE染色评估小鼠肺病理损伤:取小鼠左肺组织于多聚甲醛(4%)中固定1天,分别用自来水合蒸馏水冲洗,并使用梯度乙醇脱水,制成蜡块后切片。将得到的肺组织切片在温箱中烘烤1h后,使用梯度乙醇脱水、二甲苯脱蜡、苏木精-伊红染色后在光学显微镜下观察并拍照。同时对各组小鼠肺损伤情况进行评分,具体如下:0分:肺组织正常;1分:损伤<25%;2分:损伤为25%~50%(不含);3分:损伤为50%~75%;4分:损伤>75%。
5. Western blot法检测:每组随机选取5只小鼠的左肺下叶进行相关蛋白表达的检测。首先,使用超声裂解法提取小鼠肺组织中总蛋白,并通过BCA法对各样本蛋白进行定量。配制10% SDS-聚丙烯酰胺凝胶,取50μg蛋白样品上样电泳。电泳结束后,将还有凝胶中的总蛋白转至醋酸纤维素膜上,并使用脱脂奶粉(5%)进行封闭。封闭完成后,分别使用相应的一抗稀释液对目的条带进行孵育,4℃过夜。次日,使用等渗缓冲盐溶液TBST洗膜3次后,二抗室温孵育1h。ECL显色后,最后使用Image Lab对各泳道的灰度值进行半定量。

结 果
1.阿格拉宾对缺血再灌注小鼠肺病理损伤的影响: HE染色结果显示,肺缺血1h,再灌注2h小鼠肺组织出现了明显的病理损伤,表现为肺组织中大量炎性细胞浸润、肺水肿及肺泡腔中出现一定量的红细胞,同时小鼠肺损伤评分明显升高(P<0.05);阿拉格宾干预可明显减轻小鼠肺病理损伤,降低肺损伤评分(P<0.05),详见图1。
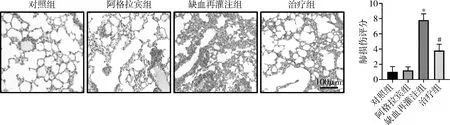
图1 各组小鼠肺组织HE染色结果(×200)及肺损伤评分
2.阿格拉宾对缺血再灌注小鼠肺炎性反应的影响: Western blot法检测结果表明,缺血再灌注可明显上调小鼠肺组织中IL-1β、MCP-1和TNF-α的蛋白表达水平(P<0.05);而单独给予阿拉格宾预处理对对照组小鼠肺组织中IL-1β、MCP-1和TNF-α的蛋白表达无明显影响(P>0.05);相反,阿拉格宾预处理可明显抑制缺血再灌注小鼠肺组织中IL-1β、MCP-1和TNF-α的蛋白表达(P<0.05),详见图2。

图2 各组小鼠肺组织中IL-1β, MCP-1和TNF-α的蛋白表达
3.阿格拉宾对缺血再灌注小鼠肺组织焦亡水平的影响: Western blot法检测结果表明,缺血再灌注可明显上调小鼠肺组织中NLRP3和ASC的蛋白表达水平(P<0.05);而单独给予阿拉格宾预处理对对照组小鼠肺组织中NLRP3和ASC的蛋白表达无明显影响(P>0.05);相反,阿拉格宾预处理可明显抑制缺血再灌注小鼠肺组织的焦亡水平(P<0.05),详见图3。

图3 各组小鼠肺组织中NLRP3和ASC的蛋白表达
4.阿格拉宾对缺血再灌注小鼠肺组织自噬水平的影响: Western blot法检测结果表明,缺血再灌注可明显抑制小鼠肺组织中自噬水平,表现为肺组织中Beclin1和ATG7的蛋白下调(P<0.05);而阿拉格宾预处理可明显上调缺血再灌注小鼠肺组织中Beclin1和ATG7的蛋白表达,上调自噬(P<0.05),详见图4。

图4 各组小鼠肺组织中Beclin1和ATG7的蛋白表达
讨 论
肺移植是目前治疗终末期呼吸系统疾病的最有效策略[1]。然而,长期以来供肺不足仍是一个阻碍肺移植发展的关键的问题。研究统计,约80%的供肺由于各种原因无法达到移植标准。而剩余的20%供肺尽管可以达到移植标准,但由于移植术后再灌注的“二次打击”,造成移植物失功,这也是肺移植患者围手术期死亡的主要原因之一[9~11]。为了降低肺移植后的移植物失功,越来越多的研究开始聚焦肺缺血再灌注损伤的发病机制并寻找具有肺保护作用的天然化合物。本项研究揭示小分子天然化合物阿格拉宾在肺缺血再灌注损伤中发挥重要的保护作用,具有明显的抑制焦亡和激活自噬的潜力。
天然免疫介导的无菌性炎症在器官缺血再灌注后的组织损伤中发挥重要作用,这种无菌性炎症的激活与模式识别受体密切相关[12]。肺泡巨噬细胞是在肺泡中主要驻留的免疫细胞,一旦它们表面的DAMPs被识别时,天然免疫和肺组织无菌性炎症将会被激活[13]。在肺缺血再灌注早期,常驻的肺泡巨噬细胞可控制炎症。然而,当宿主反应不能恢复稳态时,炎性反应会不受控制地扩展并发展为急性肺损伤和(或)急性呼吸窘迫综合征[14]。焦亡是一种重要的调节性细胞死亡方式,是指伴随炎性因子大量释放所诱发的细胞炎性死亡。NLRP3炎性小体的活化是导致细胞焦亡的重要机制之一。而NLRP3炎性小体活化的前体是NLRP3、ASC和Pro-caspase1的正确装配。一旦NLRP3炎性小体组装成功并被激活,细胞可迅速产生大量炎性介质并发生炎症性死亡[15~17]。因此,抑制NLRP3炎性小体的形成或激活是减轻肺损伤的重要策略。本研究发现阿格拉宾预处理可显著抑制缺血再灌注小鼠肺组织中NLRP3和ASC的蛋白表达水平,表明阿格拉宾具有抗焦亡的潜力。
自噬作为一种细胞质质量控制的代谢性过程,具有重要的细胞保护和抗炎作用。在天然免疫、无菌性感染和有菌性感染相关的炎症中,自噬可清除破坏细胞的无菌刺激物、入侵的病原体及受损或衰老的细胞器[18, 19]。既往研究表明,在肺缺血再灌注损伤中,肺组织自噬水平被明显抑制,使用自噬激动剂或外源性药物上调自噬可明显减轻肺病理损伤并改善肺功能[5]。在本研究中,阿格拉宾预处理可显著上调缺血再灌注小鼠肺组织中Beclin1和ATG7的蛋白表达,发挥自噬激活作用。
阿格拉宾作为一种小分子天然化合物,可通过抑制NLRP3炎性小体发挥重要的抗炎活性[6]。此外,阿格拉宾还抑制IFN-γ、IL-2、IL-1β、IL-18和TNF-α的合成,这些与COVID-19的发病密切相关。毒理学研究显示阿格拉宾未表现出任何致畸性、胚胎毒性和诱变性。上述证据提示阿格拉宾具有一定的临床转化潜力。本研究数据显示,阿格拉宾预处理可明显改善肺缺血再灌注小鼠肺组织损伤,降低肺组织焦亡水平,同时激活自噬。但阿格拉宾调控焦亡和自噬的直接作用靶点还需开展进一步实验予以证实。

