慢性肾脏病患者血清NGAL、OPN及MMP9水平与左心室肥厚的关系
张 帅 谢 娟 张译元 郑东辉
慢性肾脏病(chronic kidney disease, CKD)患病率逐年增高,已成为全球关注的重要公共卫生问题之一。截至2017年,全球CKD患者数量达到6.975亿,其中约1/3患者生活在中国(1.323亿)和印度(1.151亿)。而心血管疾病(cardiovascular disease,CVD)是CKD患者最常见的并发症及最主要的死因,2017年全球约140万患者死于因肾功能受损所致的心血管疾病,严重影响着CKD患者的预后[1,2]。心血管疾病最突出的特征是心脏结构及功能的异常,尤其是左心室肥厚(left ventricular hypertrophy,LVH)。左心室肥厚会导致CKD患者发生心肌缺血、心源性猝死、心律失常、心力衰竭等心血管事件的风险增加[3]。
基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)是一种广泛存在于心肌组织中的明胶酶,通过调节心肌细胞外基质(extracellular matrix,ECM)降解来影响心室重塑,从而参与LVH的形成[4]。研究发现,骨桥蛋白(osteopontin,OPN)和中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin, NGAL)通过延缓MMP9降解或促进其表达、促进心肌炎性反应及纤维化等机制参与心血管疾病如LVH发生的病理生理过程[5,6]。然而,目前尚不清楚血清OPN、NGAL及MMP9水平与CKD3~5期患者并发LVH的确切关系,因此,本研究旨在探讨血清OPN、NGAL及MMP9水平与CKD3~5期患者发生LVH的相关性,以期为CKD患者早期发现心脏损伤并干预提供理论依据。
资料与方法
1.一般资料:本研究选择2020年7月~2021年6月就诊于徐州医科大学附属淮安医院肾脏内科且明确诊断为CKD 3~5期的患者为实验组,均符合CKD诊断标准,均未行肾脏替代治疗或相关数据均在行肾脏替代治疗之前完成收集[7]。排除标准:①合并基础心脏疾病的患者:心功能Ⅲ~Ⅳ级,先天性心脏病,严重心力衰竭、急性心肌梗死、瓣膜性心脏病、风湿性心脏病、甲状腺功能亢进性心脏病、肺心病、心脏搭桥术后等患者,或者近期发生急性心血管事件的患者;②合并严重感染;③合并严重肝胆疾病、活动性或消耗性疾病(如恶性肿瘤、重症肺结核);④妊娠及哺乳期女性;⑤近半年内使用类固醇类激素、免疫抑制治疗、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂(ACEI/ARB)类药物者。共144例入组,男性88例,女性56例,患者年龄29~78岁,平均年龄为55.38±15.39岁。原发疾病:慢性肾小球肾炎72例,糖尿病肾病68例,狼疮性肾炎2例,慢性间质性肾炎2例。根据患者肾小球滤过率(estimate glomerular filtration rate,eGFR)水平将患者分为A组[eGFR为30~59ml/(min·1.73m2),60例]、B组[eGFR为15~29ml/(min·1.73m2),48例]、C组[eGFR小于15ml/(min·1.73m2),36例]。另纳入同期在笔者医院体检中心体检的30例健康体检者作为对照组,其中男性19例,女性11例,年龄35~63岁,平均年龄为48.35±10.59岁。本研究得到徐州医科大学附属淮安医院医学伦理学委员会批准(伦理审批号:HEYLL202086)。
2.方法:(1)临床资料收集:收集入组患者的临床资料,包括患者的年龄、性别、基础疾病、血压、体重指数(body mass index,BMI)、体表面积(body surface area,BSA)。(2)血清标志物水平的测定:血清为患者既往清晨空腹生化化验时-80℃留存的标本。采用酶联免疫吸附法检测血清OPN、NGAL、MMP9水平,试剂盒均购自泉州市睿信生物科技有限公司。(3)实验室指标:包括血红蛋白(hemoglobin,Hb)、肌酐(creatinine,Cr)、尿素氮(urea nitrogen,BUN)、钙(calcium,Ca)、磷(phosphorus,P)、C反应蛋白(C-reactive protein,CRP)。用简化肾脏病饮食改良研究(modification of diet in renal disease,MDRD)公式计算肾小球滤过率(glomerular filtration rate,GFR)。(4)心脏超声指标:由笔者医院专职超声科医生做单盲检测,测定患者左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、室间隔厚度(interventricular septum thickness,IVST)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)。参照文献[8]计算左心室质量(left ventricular mass,LVM)及左心室质量分数(left ventricular mass index,LVMI),LVH的诊断标准为男性LVMI≥115g/m2,女性LVMI≥95g/m2。其中LVM(g)=0.8×1.04×[(LVEDD+IVST+LVPWT)3-LVEDD3]+0.6;LVMI(g/m2)=LVM/BSA。

结 果
1.不同分期的CKD患者及对照组的基本临床资料比较:各组间年龄、性别、BMI比较,差异无统计学意义(P>0.05)。对照组、A组、B组及C组患者的磷、收缩压、肌酐、尿素氮、CRP、NGAL、OPN、MMP9水平均逐渐增高,钙、血红蛋白水平逐渐下降,且两两比较差异均有统计学意义(P<0.05)。在CKD患者中,LVMI随着CKD的进展逐渐增高,两两比较差异均有统计学意义(P<0.01)。C组患者合并LVH的比例高于A组,差异有统计学意义(P<0.01),详见表1。
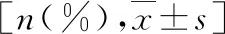
表1 入组患者的临床资料
2.LVH组和非LVH组相关资料水平比较:CKD3~5期患者中LVH组的年龄、性别、BMI、舒张压和CRP与非LVH组比较,差异无统计学意义(P>0.05)。LVH组的收缩压、肌酐、LVMI、NGAL、OPN及MMP9均高于非LVH组,血红蛋白、eGFR低于非LVH组,差异有统计学意义(P<0.05),详见表2。
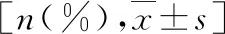
表2 LVH组和非LVH组标志物水平比较
3.各标志物水平的相关性分析:经Pearson相关分析显示,CKD3~5期患者血清NGAL、OPN及MMP9之间呈显著正相关(P<0.01),详见表3。

表3 各标志物水平的相关性分析(r)
4.标志物水平与超声心动图参数的相关性分析:二分类Logistic回归分析显示,年龄、收缩压、CRP、NGAL、OPN、MMP9是CKD3~5期患者发生LVH的独立危险因素(OR值分别为1.511、1.480、1.115、1.392、2.573、2.217;95% CI分别为1.027~2.124、1.101~1.939、1.025~1.414、1.140~1.675、1.796~2.701、1.646~2.967;P值分别为<0.001、0.044、0.027、<0.001、0.007、<0.001),详见表4。

表4 Logistic回归分析发生LVH的危险因素
5.血清OPN、NGAL及MMP9水平诊断左心室肥厚的敏感度和特异性分析:ROC曲线分析结果显示,3种标志物联合预测CKD3~5期患者发生LVH的AUC为0.890,敏感度、特异性分别为87.36%、79.91%,详见表5。

表5 血清OPN、NGAL及MMP9诊断LVH的敏感度和特异性分析
讨 论
NGAL最初从中性粒细胞颗粒中纯化得到,也称为脂质运载蛋白2(lipocalin-2),是脂质运载蛋白家族成员之一,作为急性肾损伤的早期标志物而受到广泛研究。NGAL其自身结构中β-桶状结构封闭末端的β4~β5环附近有游离的巯基,可以与配体结合形成二硫键,从而调节蛋白的活性和功能,也成为其与MMP9相结合并调节其代谢的结构基础[9]。
MMP9是一种明胶酶,隶属于基质金属蛋白酶(matrix metalloproteinases,MMPs) 家族,具有降解间质蛋白的作用,是降解心肌细胞外基质(extracellular matrix,ECM)的主要介质,广泛存在于心肌组织中[10]。ECM则对维持左心室形状、心肌细胞的排列和协调心肌收缩性起重要作用。ECM成分合成或降解代谢失衡是引起左心室扩大及心肌重构的主要因素之一。MMP9则通过影响ECM降解来影响心室重塑[10]。研究发现,NGAL与MMP9的结合并不影响后者的活性, 但起到稳定及延缓 MMP9分解的作用,故NGAL通过延缓MMP9的降解而起到促进心室重塑的作用[9]。
研究发现在大鼠平滑肌细胞(smooth muscle cess SMC)的培养基中发现其分泌的NGAL与MMP9以复合物的形式存在,并与MMP9共定位于小鼠的动脉粥样硬化(atherosclerosis AS)斑块中,都证实了在心肌等组织中MMP9与NGAL共表达[4]。OPN也称为骨涎蛋白、分泌性磷蛋白,是一种分泌型多功能糖基化磷蛋白,由314个氨基酸残基组成,可以通过包括磷酸化、糖基化、硫酸化、酶裂解等翻译后修饰发挥不同的功能[11]。经过酶裂解OPN可以形成几种基质金属蛋白酶(MMP2、MMP9等)裂解位点,正是凭借此过程OPN可通过提高细胞外基质中MMP9的表达,在心室重塑过程中起到与NGAL相同的作用[12]。本研究中受试者血清NGAL、OPN浓度与MMP9浓度呈显著正相关,也从侧面证实了三者在参与心室重塑过程中的相关性。
有研究将小鼠心肌细胞与重组NGAL一起孵育,发现随着NGAL浓度的增加,心肌细胞的体积也逐渐增大,且肥大的心肌细胞中NGAL及NGAL mRNA水平均明显增加[13]。由此推测NGAL参与心肌细胞肥大形成,但NGAL参与心肌肥大的具体病理生理机制仍未明确。此外,心肌肥大也是发生左心室肥厚及左心室舒张功能障碍的关键病理过程。还有文献报道急性心肌梗死(acute myocardial infarction,AMI)及慢性心力衰竭(heart failure,HF)患者的血清NGAL水平明显高于健康受试者[14,15]。前者的血清NGAL水平也高于稳定型心绞痛患者[14]。国内有研究显示,血清或尿NGAL水平和NT-proBNP一样均可作为诊断HF的标志物[16]。血清NGAL水平同样可以作为CKD患者心血管并发症的预测因子[17]。而关于OPN,Giachelli等[18]在动脉组织中发现它并指出其可能在动脉粥样硬化斑块形成的炎症过程中发挥重要作用。
既往研究发现,心力衰竭患者血浆OPN水平显著升高,并与严重程度相关[19]。对心力衰竭患者进行心肌活检,也发现OPN表达水平明显上调[20]。OPN目前已被确定为慢性心力衰竭和特发性肺动脉高压患者病死率的独立预测因子[19,21]。此外,在高血压人群中,受试的199例高血压患者中发现循环中高水平的OPN是发生心室肥厚和心室舒张功能障碍的独立危险因素[22]。在另外一项包含1092例高血压患者的大规模样本研究中也得出相似的结论[23]。本研究在CKD人群中检测两种标志物并评估其与LVH的相关性,结果显示CKD患者血清NGAL、OPN浓度明显高于对照组,并且随着CKD的进展,两种标志物的水平也逐渐升高,这与Kim等[3]研究结果类似。一方面,慢性肾脏病患者肾脏损伤可能会导致NGAL与OPN的排泄减少。另一方面考虑与CKD患者机体长期处于微炎性状态,IL-1β、IL-6与TGF-β等炎性细胞因子释放增加,刺激NGAL、OPN产生增加[24]。
研究结果还显示,CKD患者合并LVH的比例达41.67%,造成发生率升高的因素包括高龄、高血压等“传统因素”,以及CKD特异性的“非传统因素”(如贫血、微炎症状态、矿物质代谢紊乱等)。同时LVH组患者血清NGAL、OPN水平明显高于非LVH组,进一步表明两种标志物与CKD患者并发LVH存在密切关系,这与Yang等[22]、曾艳等[25]在高血压人群中的研究结果存在一定相似性,两项研究分别对OPN与NGAL水平与LVH的相关性进行了探讨,发现二者能早期评估高血压心脏损伤,是高血压患者发生LVH的独立危险因素。
回归分析显示年龄、收缩压及3种标志物水平是CKD3~5期患者发生LVH的独立危险因素,提示随着年龄的增长,因为肾血流下降与肾单位减少等因素导致三者的排泄减少,NGAL与OPN分别通过延缓MMP9降解或促进其表达使ECM降解增加,引起了心室重塑,从而导致发生LVH的风险增加。同时随着血压升高,血管外周阻力也不断升高,心脏后负荷增加,心脏射血功能减弱致心排出量下降,心室内压力升高,最终导致左心室肥厚。NGAL、OPN及MMP9预测CKD3~5期患者发生LVH的敏感度和特异性均低于联合检测,说明3种标志物的联合检测对CKD患者发生心脏损伤早期诊断与筛查发挥了较好的应用价值。
综上所述,血清NGAL、OPN及MMP9水平在CKD患者中明显升高,三者与CKD3~5期患者发生LVH密切相关。联合检测3种标志物可能对CKD患者早期发现心脏损伤、改善患者预后具有一定的临床意义。

