lncRNA RP11-1C8.5通过结合miR-181a-5p对糖尿病心肌细胞凋亡和增殖的影响
黄 锐 周 源 贺 清 白 杨 周礼平
糖尿病性心肌病是糖尿病患者的并发症之一,其特征包括心室扩张、心肌纤维化、心脏肥大等心肌结构改变[1]。糖尿病性心肌病的发生可能与心肌细胞的凋亡、炎症、代谢、氧化应激等相关,是导致糖尿病患者死亡的重要原因[2]。然而,糖尿病性心肌病的发病机制尚不清楚,确定糖尿病性心肌病的病理生理机制和潜在的治疗靶点是其防治研究的重要方向。心肌细胞凋亡和功能下降是糖尿病心肌病形成的重要机制,阻断心肌细胞凋亡并促进其活力对治疗糖尿病心肌病具有重要临床意义[3~5]。长链非编码RNA(long non-coding RNA,lncRNA)是一类RNA转录本,长度大于200个核苷酸[6]。虽然lncRNA没有蛋白质编码功能,但其能够通过多种作用机制调控特定基因的表达和定位,在细胞的生理和病理过程发挥显著的生物学功能[7~9]。lncRNA与糖尿病及其并发症的是糖尿病研究领域的热点[10]。RP11-1C8.5是一个尚未被报道研究的lncRNA,其基因含有一个外显子,转录产物长度为4597个核苷酸。本研究通过检测不同高糖浓度培养下的心肌HCM细胞中RP11-1C8.5的表达,旨在观察RP11-1C8.5与高糖浓度的相关性,通过感染RP11-1C8.5干扰腺病毒,探讨敲减RP11-1C8.5对心肌细胞凋亡和增殖的调控及可能的作用机制。
材料与方法
1.细胞系与主要试剂:人心肌细胞系HCM购自美国ATCC公司。胎牛血清和心肌细胞培养基购自美国Hyclone公司。RP11-1C8.5干扰腺病毒(干扰序列为ATGGCATTTACAGAATAACAAAT,结合位点为175~197)和对照重组腺病毒购自北京索莱宝科技有限公司。LipofectamineTM3000、CCK-8试剂盒购自美国Invitrogen公司。细胞凋亡试剂盒购自美国Thermo Fisher Scientific公司。miR-181a-5p mimic和NC mimic购自广州锐博生物科技有限公司。RP11-1C8.5野生型和突变型双荧光素酶报告基因pGL3质粒购自上海和元生物技术股份公司。一抗Bax、caspase3、Bcl-2、CED-9、GAPDH购自美国Millipore公司。
2.细胞培养和感染:在37℃、5%CO2的培养箱中,心肌细胞系HCM培养在含10%胎牛血清的心肌细胞培养基中,使用5.5、10.0、13.9、22.2、33.3mmol/L葡萄糖孵育处理24h,qPCR检测RP11-1C8.5的表达水平。在33.3mmol/L葡萄糖培养的HCM细胞融合度为80%时,将RP11-1C8.5干扰腺病毒和对照重组腺病毒感染心肌细胞,培养箱继续培养32h,进行后续实验。
3.qPCR检测:采用TRIzol法从人心肌HCM细胞中提取总RNA,加入反转录试剂进行反转录,合成后的cDNA进行qPCR反应。qPCR反应体系为0.5μg总RNA、1μl上游引物、1μl下游引物、5μl 5×SYBR Green。采用2-ΔΔCt方法计算RP11-1C8.5、miR-181a-5p相对表达水平。以GAPDH为内参检测RP11-1C8.5的表达;以U6为内参检测miR-181a-5p的表达。引物序列如下,miR-181a-5p正向引物:CGGCAACATTCAACGCTGT,反向引物:GTCCAGGCTCCGAGGTATTC;GAPDH正向引物:ACATCGCTGAGACACCATG,反向引物:TGTAGTTGAGGTCAATGAAGGG;RP11-1C8.5正向引物:GCCCAGAGTGTCCATTCACT,反向引物:CATCTCCTTCTGGGACTCCA。U6正向引物:CACGCTTGGGC-AGCACATATACT,反向引物:ACGCATCACGAATCTGCGTGTC。
4.流式细胞术检测:胰酶消化收集对照组和实验组HCM细胞,用预冷的1×PBS溶液洗4次,用配好的binding buffer结合缓冲液重悬HCM细胞,每100μl细胞悬液中加入Annexin V-FITC试剂5μl,避光染色3h。每100μl细胞悬液中加入PI试剂5μl,避光染色30min,通过流式细胞仪检测两组HCM细胞的凋亡率。
5. CCK-8法检测:将对照组和实验组HCM细胞制备成均匀的细胞悬液,将每组单细胞悬液以6×103个/孔接种于96孔板,培养箱中常规培养。在细胞接种后第1~5天分别终止培养,加入30 微升/孔CCK-8试剂,摇床混匀,在培养箱中孵育3.5h。采用全自动酶标仪测定每孔在450nm波长处的吸光度(A)值,即HCM细胞相对活力。
6.生物信息学方法预测和双荧光素酶报告基因实验:根据生物信息学软件starBase v2.0预测的RP11-1C8.5与miR-181a-5p的结合序列,将此野生型序列及突变型序列插入pGL3质粒构建双荧光素酶报告基因质粒。将复苏的HCM细胞铺至24孔板,分别共转染200ng RP11-1C8.5-wt、200ng RP11-1C8.5-mut或200ng NC mimic、200ng miR-181a-5p mimic。24h后收集细胞,分别检测萤火虫萤光素酶和海肾萤光素酶发光强度,两者比值即可反映RP11-1C8.5与miR-181a-5p相互结合的能力。
7. Western blot法检测:向对照组和实验组HCM细胞中加入细胞裂解液,低温裂解30min,离心提取蛋白上清液。通过聚丙烯酰胺凝胶电泳和硝酸纤维素膜转膜,采用4%脱脂牛奶进行封闭。加入所需监测蛋白的抗体,稀释比例如下,一抗Bax(1∶5000)、caspase3(1∶3000)、Bcl-2(1∶3000)、CED-9(1∶3000)、GAPDH(1∶5000),4℃过夜孵育。加入相应二抗(1∶9000),室温孵育3h,通过ECL发光试剂盒进行显影。

结 果
1.RP11-1C8.5在高糖培养心肌细胞中的表达:qPCR结果显示,与正常葡萄糖浓度(5.5mmol/L)比较,10.0、13.9、22.2和33.3mmol/L葡萄糖浓度培养基培养的心肌HCM细胞中RP11-1C8.5表达显著上调(P<0.01),RP11-1C8.5表达与葡萄糖浓度梯度呈正相关(r=0.98,P<0.01),其中在33.3mmol/L葡萄糖浓度培养HCM细胞中的表达最高(P<0.01,图1)。

图1 高糖培养心肌细胞中RP11-1C8.5的表达
2.RP11-1C8.5干扰腺病毒对HCM细胞中RP11-1C8.5表达的影响:RP11-1C8.5干扰腺病毒和对照腺病毒感染HCM细胞后,倒置荧光显微镜可见绿色荧光蛋白,提示腺病毒感染HCM细胞充分。对照组和实验组HCM细胞中RP11-1C8.5表达分别为8.68±1.47和1.04±0.58,RP11-1C8.5在实验组HCM细胞中表达含量显著降低(P<0.01,图2)。

图2 RP11-1C8.5干扰腺病毒和对照腺病毒感染HCM细胞的效率(×40)
3.敲减RP11-1C8.5对HCM细胞凋亡的影响:流式细胞术显示,RP11-1C8.5干扰腺病毒和对照腺病毒感染HCM细胞后,实验组和对照组HCM细胞凋亡率分别为7.85%±2.67%和16.33%±2.82%,与对照组比较,敲减RP11-1C8.5明显抑制HCM细胞的凋亡(P<0.01,图3)。

图3 流式细胞术检测敲减RP11-1C8.5对HCM细胞凋亡的影响
4.敲减RP11-1C8.5对HCM细胞活力的影响:CCK-8法结果显示,从2天起,实验组HCM细胞活力明显高于对照组,敲减RP11-1C8.5明显促进HCM细胞的活力(P<0.05,图4)。
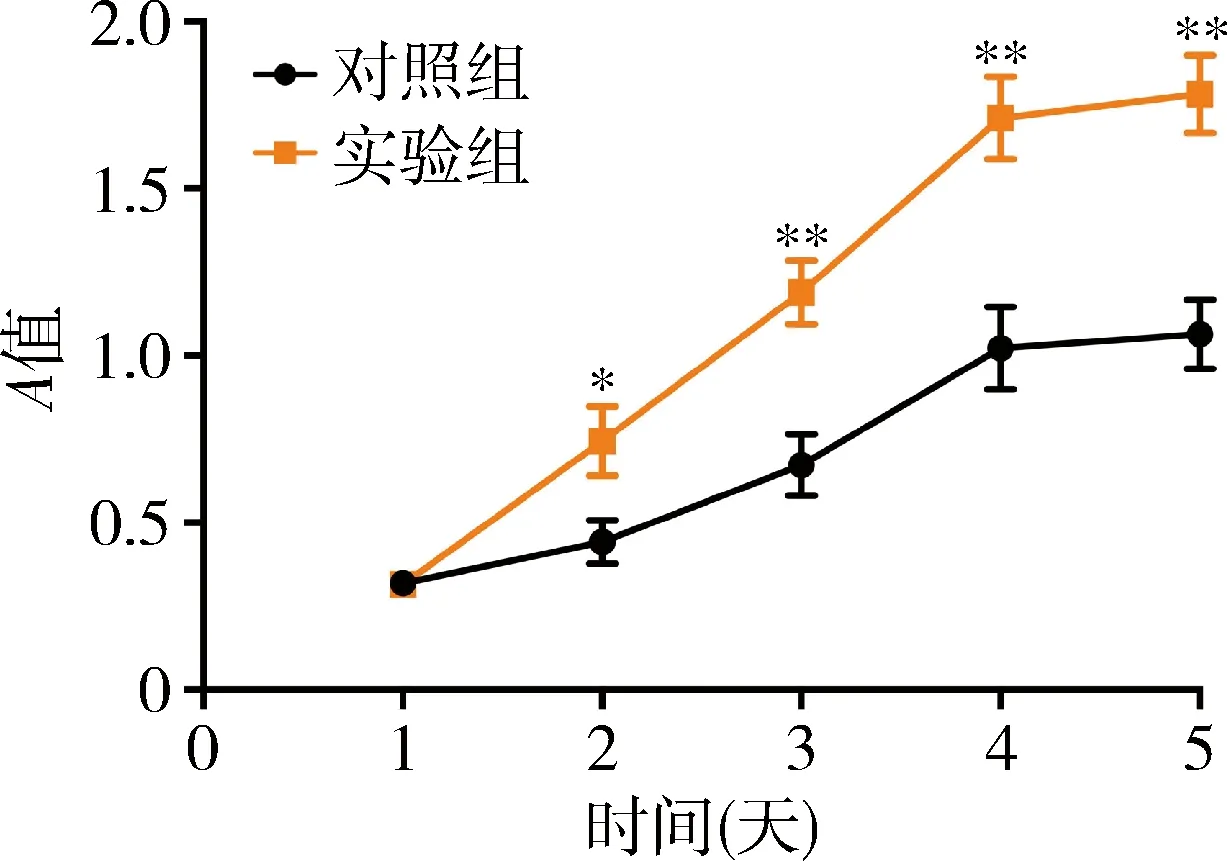
图4 CCK-8检测敲减RP11-1C8.5对HCM细胞活力的影响
5.RP11-1C8.5与miR-181a-5p相互作用的鉴定:通过生物信息学starBase v2.0软件预测(图5),RP11-1C8.5序列的4546-4562区域与miR-181a-5p存在结合位点,结合评分为0.992。双荧光素酶报告基因实验显示,共转染RP11-1C8.5-wt与miR-181a-5p mimic的相对荧光素酶活性相对于NC mimic显著降低(P<0.01),将结合位点突变后,两组相对荧光素酶活性比较差异无统计学意义(P>0.05,图6)。

图5 生物信息学预测RP11-1C8.5的作用机制
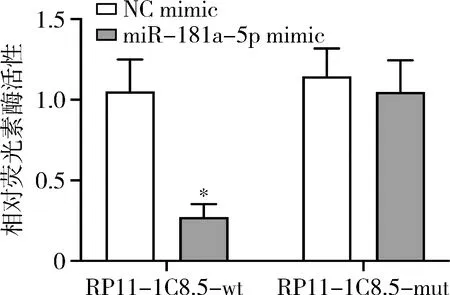
图6 双荧光素酶报告基因鉴定RP11-1C8.5与miR-181a-5p的相互作用
6.敲减RP11-1C8.5对miR-181a-5p表达的影响: qPCR结果显示,实验组和对照组HCM细胞miR-181a-5p的表达分别为0.30±0.15和1.02±0.22,敲减RP11-1C8.5可显著促进miR-181a-5p的表达(P<0.01)。
7.敲减RP11-1C8.5对凋亡相关蛋白表达的影响: Western blot法检测结果显示,与对照组比较,实验组HCM细胞促凋亡蛋白Bax、caspase3表达降低,抗凋亡蛋白Bcl-2、CED-9表达增加(图7)。

图7 Western blot法检测相关凋亡蛋白表达情况
讨 论
lncRNA是由外显子或内含子通过剪切形成的非编码RNA,广泛存在于真核细胞[11]。lncRNA通过调控基因的可变剪切和转录过程,参与细胞的各种生物学过程[12]。研究显示,lncRNA广泛影响心血管疾病如心肌纤维化、心室肥厚、心肌炎的进程[13~15]。lncRNA在糖尿病心肌病中的作用备受关注。Ni等[16]研究发现,下调lncRNA ZFAS1能够抑制心肌细胞的凋亡和铁死亡,减缓糖尿病心肌病的进展,miR-150-5p是lncRNA ZFAS1的靶基因。Xiao等[17]研究发现,lncRNA MIAT在糖尿病患者血清以及高糖诱导的心肌细胞中的表达均升高,沉默lncRNA MIAT后心肌细胞焦亡相关因子IL-1、IL-18表达水平下调,lncRNA MIAT通过调控心肌细胞焦亡参与糖尿病心肌病的进展。RP11-1C8.5是近年来新发现的lncRNA,其在心肌细胞中的作用未见报道。
本研究显示,与正常葡萄糖浓度比较,经过高糖培养后的心肌HCM细胞中RP11-1C8.5表达显著上调,且其表达水平与葡萄糖浓度呈现显著的相关性,提示RP11-1C8.5可能参与糖尿病心肌病的病理改变。为进一步明确RP11-1C8.5在糖尿病心肌病进展中的作用,本研究采用腺病毒感染技术在HCM细胞中沉默RP11-1C8.5表达。敲减RP11-1C8.5表达后,HCM细胞的凋亡率明显降低、细胞活力明显升高,同时促凋亡蛋白Bax、caspase3表达降低,抗凋亡蛋白Bcl-2、CED-9表达增加,提示RP11-1C8.5参与糖尿病心肌病的进展。已有研究证实,lncRNA通过海绵吸附下游微小RNA(miRNA),通过降低miRNA表达调节细胞的生物学行为[18~20]。本研究通过生物信息学预测与双荧光素酶报告基因实验,证实了RP11-1C8.5与miR-181a-5p的结合作用。Zhao等[21]研究发现,miR-181a-5p在高糖处理的心肌细胞中表达下调,miR-181a-5p可显著抑制炎性细胞因子的表达,促进心肌细胞活力,抑制心肌细胞炎症和凋亡。本研究进一步证实,在高糖培养的HCM细胞中敲减RP11-1C8.5可显著升高miR-181a-5p的表达水平,表明RP11-1C8.5通过结合miR-181a-5p在糖尿病心肌病中发挥作用。
综上所述,RP11-1C8.5在高糖培养的心肌细胞中表达上调,敲减RP11-1C8.5可通过上调miR-181a-5p表达,抑制心肌细胞的凋亡并促进心肌细胞的活力。敲减RP11-1C8.5可能是阻断糖尿病心肌病发展的有效策略。

