低位筛前动脉与周围解剖结构的影像学关系和临床意义
程翔宇 张欠欠 唐 如 茆 松 张维天 叶海波
鼻内镜手术是目前治疗慢性鼻窦炎等鼻科疾病的主要手段。随着手术适应证的扩大,手术安全性、并发症的处理越来越受到重视[1]。术中损伤筛前动脉(anterior ethmoidal artery,AEA)可致鼻出血、眶内血肿,严重时可致视力障碍。因此,减少AEA损伤所致的失明、出血等严重并发症至关重要,临床医生须在术前明确AEA与周围解剖结构之间的关系[2]。
AEA自眼动脉发出,是前颅底和额隐窝的标志,同时,其走行受周围气房及颅底解剖变异的影响[3~5]。AEA可紧贴颅底顶部走行,也可受气房影响低于颅底穿行或走行于气房周围。本研究将筛前动脉管(anterior ethmoid canal,AEC)与筛前动脉孔交点的上缘到颅底的竖直距离≥0.625mm的筛前动脉定义为低位筛前动脉(low-lying anterior ethmoidal artery,LAEA),LAEA因其低位走行更易发生医源性损伤引发眶内血肿、鼻出血等并发症,通过术前仔细阅片了解其解剖学特点及变异类型可以有效避免这些灾难性并发症的发生[6]。
2016年,Wormald等[7]18位国际顶尖鼻科专家撰写了《国际额窦解剖分类和内镜额窦手术分类》(international frontal sinus anatomy classification,IFAC)专家共识,进一步规范了额窦区域的解剖名词和手术分类。这种方法为气房类型提供更多精准的描述,为接下来描述额筛气房类型和筛前动脉的关系提供参考和指导。目前,国际额窦解剖分类的气房和低位筛前动脉的关系研究较少,本研究旨在明确LAEA解剖特点及与周围解剖结构影像学联系,为有效避免鼻内镜手术中AEA损伤提供解剖学依据。
对象与方法
1.研究对象:回顾性收集2018年5月~2021年5月在上海交通大学医学院附属第六人民医院完成鼻窦CT的126例(252侧)患者的临床资料,其中男性88例(69.8%),女性38例(30.2%)。入选标准:①患者年龄>18岁;②影像上能对额窦气房类型和AEA进行辨识。排除标准:①既往有鼻腔、鼻窦、眼眶手术史或鼻腔鼻窦恶性肿瘤病史或鼻眶外伤史者;②影像资料不完整者;③CT片上不能有效辨识额筛气房和AEA。本研究经笔者医院医学伦理学委员会审批通过(伦理审批号:2020-149)。
2.研究方法:选用light speed 64排螺旋CT对患者鼻部进行扫描,扫描范围由顶骨隆起至下颌骨牙槽,先进行轴位螺旋扫描,螺距为0.53∶1,层厚为0.625mm,再进行冠状位和矢状位的重建,设置窗宽2000Hu,窗位200Hu。使用Horos软件对影像CT片进行重建及数据测量,额筛气房确认以冠状位、水平位和矢状位连续切面出现含气腔为依据,AEA的确认以冠状位上出现鸟嘴样凸起即筛前孔(anterior ethmoidal foramen,AEF)为依据[7~10]。(1)在CT冠状位上测量AEA出眶与AEF交点的位置上缘到颅底的竖直距离作为AEA与颅底的距离(图1)。(2)测量筛板外侧板(lateral lamella of the cribriform plate,LLCP)的高度(筛骨水平板和筛顶的垂直距离)并按Keros 分型进行分类,Ⅰ型<4mm、Ⅱ型4~7mm、Ⅲ型>7mm[11]。(3)测量CT矢状位上测量额窦前壁到颅底(前颅底水平和垂直的交点)的最大水平距离(longest horizontal diameter diameter from the anterior wall of the frontal sinus to the skull base at which point the slope turns vertical to horizontal,APF),见图1。

图1 CT冠状位
(4)测量包含LAEA的纸板与颅底之间向额面的倾斜角(forward angle between the lamella containing the low anterior ethmoid artery and the skull base,FALS)(图2)(按锐角、直角、钝角进行分类)。(5)根据IFAC方法对额筛气房进行分类。本研究将AEA分为LAEA和非低位筛前动脉(non-low-lying Anterior ethmoidal artery,non-LAEA),将AEA与颅底的位置≥0.625mm的AEA称为LAEA,将嵌入或隆起于颅底的AEA及距颅底距离<0.625mm的AEA归为non-LAEA。通过统计并记录不同分型的AEA数量及AEA与颅底的距离,计算AEA的低位走行率,然后分析以上各种气房和解剖结构对AEA低位走行的影响。

图2 CT矢状位
3.统计学方法:应用 SPSS 22.0统计学软件对数据进行统计分析,t检验、χ2检验用作各类额筛气房、Keros分型及FALS与LAEA的差异性分析。Spearman、Pearson相关分析方法用于LAEA与LLCP、APF之间的相关性分析,以P<0.05为差异有统计学意义。
结 果
1.患者基本情况:共126例患者(252侧)满足纳入标准,男性88例(69.8%),女性38例(30.2%);其中153侧(60.7%)存在LAEA,98侧(39.3%)的AEA为non-AEA。LAEA到颅底的平均竖直距离为3.71±1.97mm;APF的平均距离为11.01±4.21mm。按照IFAC分类方法,在本研究中,最常见的额筛气房类型为鼻丘气房(agger nasi cell,ANC)98.8%,往后依次为筛泡上气房(supra bulla cell,SBC)70.2%、筛泡上额气房(supra bulla frontal cell,SBFC)67.5%、眶上筛房(supraorbital ethmoid cell,SOEC)51.6%、鼻丘上气房(supra agger cell,SAC)47.2%、鼻丘上额气房(supra agger frontal cell,SAFC)15.3%、额窦中隔气房(frontal septal cell,FSC)8.7%。
2.有、无SOEC的患者AEA低位走行率比较:研究发现,存在SOEC的侧别中(130侧),81.7%(125/130)合并LAEA;无SOEC的侧别中(122侧),仅18.3%(28/122)存在LAEA,有SOEC和无SOEC的患者的AEA低位走行率比较,差异有统计学意义(χ2=141.40,P<0.001),详见表1。

表1 SOEC和AEA类型的关系[n(%)]
3.有、无SBC的患者AEA低位走行率比较:有SBC的侧别当中(177侧),83.6%(148/177)存在LAEA,无SBC的侧别当中(75侧),仅6.7%(6/75)存在LAEA,有SBC和无SBC的患者之间的AEA低位走行率比较,差异有统计学意义(χ2=138.05,P<0.001),详见表2。

表2 SBC和AEA类型的关系[n(%)]
4.SOEC、SBC与LAEA的关系:SOEC、SBC分别与LAEA呈正相关(r=0.749,P<0.05;r=0.740,P<0.001),即当有SOEC、SBC时,LAEA发生率明显增加。在Keros分型当中,Ⅰ型占57.5%(145/262)、Ⅱ型占38.1%(96/262)、Ⅲ型占4.4%(11/262),三者LAEA的发生率分别为35.9%(52/145)、93.8%(90/96)和100%(11/11)。Keros Ⅰ型与LAEA呈负相关(r=-0.592,P<0.001);Keros Ⅱ型、Ⅲ型分别与LAEA呈正相关(r=0.531,P<0.001;r=0.172,P<0.001);即当患者Keros分型属于Ⅱ型、Ⅲ型时,LAEA发生率增加,详见表3。

表3 相应气房和Keros分型与LAEA的相关性分析
5.筛板外侧板(lamella of the cribriform plate,LLCP)、APF与LAEA的关系:LLCP平均为3.84±1.75mm,符合正态分布,LLCP在LAEA和non-LAEA患者的之间的高度比较,差异有统计学意义(t=10.47,P<0.001)。LAEA到颅底的距离和LLCP 高度在左侧、右侧或双侧都具有相关性,且相关系数大于0(P<0.001),即随着LLCP高度增加,LAEA到颅底的距离随之增加。其次,LAEA到颅底的距离和APF呈正相关(r=0.246,P<0.001),随着APF增加,LAEA到颅底的距离随之增加,二者之间呈正相关,详见表4。
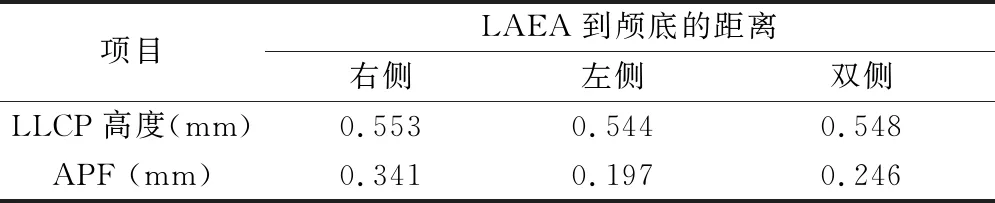
表4 LLCP、APF与LAEA到颅底的距离相关系数
6.双侧LAEA的关系、FALS与SOEC的关系:双侧LAEA到颅底的距离之间也存在相关性(r=0.58,P<0.001),即当一侧有LAEA时,另一侧也可能有LAEA。在153侧有LAEA的CT中均有FALS,而无LAEA的侧别中均无FALS。说明FALS也可有效定位LAEA。FALS类型当中,锐角占140侧(91.5%),其所在侧别中80.7%(113/140)有SOEC;直角占12侧(7.8%),所在侧别100%(12/12)有SOEC;钝角占1侧(0.7%),所在侧别无SOEC。通过统计分析后发现在不同类型的FALS之间,SOEC分布比较,差异无统计学意义(χ2=7.24,P=0.27),说明FALS与SOEC之间没有明确的解剖学联系。
讨 论
AEA低位走行的解剖因素和影像学特点是国际上的研究热点,而国内相关的研究较少[12~14]。Lannoy等[15]研究发现,当AEA低于颅底走行在骨系膜中时,同侧可存在眶上气房。但有研究认为,额气房和鼻丘气房与AEA的走行没有关系[16]。本研究对AEA与周围解剖结构关系进行相应的研究发现,SOEC、SBC都与LAEA存在密切的解剖联系(P<0.001)。SOEC通过气化到AEA前后或周围进一步达到眶的上方(图1、图2)影响AEA的走行;SBC作为后组气房的一种类型,位于筛泡上方,但并未气化进入额窦,SBC在气化过程中也有挤压AEA使其向前下移位(图2)[17]。既往研究表明,SOEC发生率为2.6%~62.0%[5,6,18~20]。
本研究中SOEC发生率为51.6%。当一侧有 SOEC时,同侧别AEA走行可能低于颅底并位于其后方[21];SBC的发生率为71.0%,当一侧有SBC时,同侧别的AEA可能低于颅底走行并位于其前方,SBC与SOEC在气化过程中互相挤压AEA使其呈现一种悬空的状态,当然,AEA低位走行的同时也通过系膜或骨板与颅底相连,内镜手术时,系膜或者骨板的损伤可能会连带AEA损伤。
国内外关于SOEC和AEA相关性的研究有不同的见解,Souza等[22]研究发现,在有SOEC的侧边AEA游离穿梭在筛窦气房中,但该研究并未测量AEA与颅底的距离。Phayvan等[6]测量了AEA和颅底的距离以及APF长度,并且通过统计学分析得出SOEC、更大的APF前后径都与LAEA之间的存在重要的影像学联系(P<0.001)。冯燕军等[23]对75例鼻窦炎患者CT进行研究发现,85.1%的AEA位于SOEC的后缘附近。Jang等[24]报道认为AEA位于SOEC的后缘。本研究中,有SOEC和AEA的影像CT片中,特别是矢状位片上可以辨识到SOEC的前方是额窦口而后方是LAEA,再往后则是SBC。因此当进行额窦手术时,不光要考虑保持额窦口通畅引流,还要注意SOEC后方及SBC前方的LAEA。
根据AEA与颅底的位置关系,不同的研究者有不同的分型,Moon等[4]研究发现,85.7%的研究对象的AEA附着于颅底走行,14.3%的AEA低于颅底走行,故将AEA分为颅底型和悬空型。有研究将AEA分为3种类型,Ⅰ型为 AEA 包含于颅骨内,Ⅱ型为AEA隆起于颅底但紧贴颅底,Ⅲ型为AEA低于颅底悬浮在筛窦内走行,且有系膜或骨板将其与颅底连接[14,15,25]。本研究以AEC与AEF交点至颅底的竖直距离作为 AEA 至颅底的距离,将此距离≥0.625mm的AEA定义为LAEA,由于Ⅰ型、Ⅱ型 AEA 为嵌入或隆起于颅底,AEA与颅底不存在距离,故本研究将两者和AEA至颅底距离<0.625mm的AEA归为一类,即non-LAEA[6]。本研究计算LAEA至颅底的距离并将LAEA的发生率作为 AEA 的低位走行率。Simmen等[26]和Abdullah等[9]研究认为低于颅底走行的AEA占1/3以上。潘振宇等[28]研究发现,AEA的低位走行率占比为58%,即Ⅲ型为主要类型。史慕寒等[14]研究发现,AEA的悬空率为39.4%,但最常见的AEA类型为Ⅱ型。也有部分研究报道,低于颅底走行的AEA占比不到20%,如Moon等[4]研究报道,AEA的低位走行率仅为14.3%。而本研究的AEA低位走行率为60.7%,为最主要的类型,这可能与计算测量的标准差异有关。对于低位走行的AEA而言,其虽然是游离在筛窦当中,但并非与颅底毫无联系,亦通过骨板或系膜与颅底相连。因此当进行内镜鼻窦手术时,损伤AEA与颅底间的系膜或骨板时,也有可能连带AEA一同损伤,从而增加AEA损伤的风险[9]。
颅底状态不同亦会不同程度地影响AEA的走行,Abdullah等[9]和Phayvanh等[6]认为,KerosⅡ型、Ⅲ型与AEA的低位走行率有关。Phayvanh等[6]还认为,当Keros分型级别越高时,LAEA发生率越高,损伤AEA的风险越高。笔者采用Keros的颅底分型方法判断颅底情况,测量LLCP深度,按Keros 分型分类并记录各组数据[11]。研究发现,最常见的Keros分型是Ⅰ型(57.5%),其次是Ⅱ型(38.1%),最后是Ⅲ型(4.4%),这与史慕寒等[14]的研究结果相似,但与Phayvanh等[6]报道最常见的类型是Ⅱ型不同。可能是因为本研究的研究对象为亚洲人群,而Phayvanh等[6]的研究对象是欧美人群,颅底的发育程度可能存在种族差异,进而导致研究结果的不同。尽管笔者的研究和其他研究的Keros各类分型的占比存在差异,但是在Keros分型和AEA低位走行的关系方面,Phayvanh等[6]和本研究得出的结果一致,即Keros分型级别越高(LLCP高度越高),LAEA发生率越高(P<0.001)。因此,对于LLCP深度较大的患者,AEA可能会走行在相对颅底更低的位置,术前阅片应该精确定位,术中仔细操作,避免损伤AEA和LLCP。
对于APF的测量,在CT矢状位上测量额窦前壁到颅底水平与垂直交叉点的最大水平距离,国内外相关研究较少,目前只有Phayvanh等[6]对其进行了相应的研究,报道了APF的平均长度为16.80±5.10mm。而本研究的平均长度为11.01±4.21mm,比Phayvanh等[6]的研究数值要小,这可能与种族差异有关。尽管数值上存在一定程度的差异,但是本研究和Phayvanh等[6]研究均发现AEA与颅底的距离和APF之间呈正相关,即APF的数值越大,AEA与颅底的距离就越大。这可能是因为额窦气化越好,空间上位置就增加了AEA与颅底的距离,从而增加损伤的AEA损伤的风险。
当LAEA出现时,AEA与颅底之间通过系膜或骨板结构连接,且系膜或骨板与颅底之间形成一定角度,为了表述方便,将之称为包含LAEA的骨板,将骨板与颅底之间向前方额面的角度称为夹角(FALS)。本研究中,FALS 91.5%(140/153)为锐角,7.8%(12/153)为直角,仅0.7%(1/153)为钝角;FALS为锐角与直角的患者其AEA到颅底的距离比较,差异有统计学意义(P<0.001)。当FALS为直角时AEA与颅底之间的距离更大,手术时损伤AEA的风险增大,因此可将骨板及其与颅底的夹角作为CT影像片上判断LAEA存在的标志,提醒医生在手术中避免损伤夹角类型为直角的LAEA。
近年来,随着技术的进步,发展较好的医院将术前CT片与导航系统同步化结合术中实时定位,但是这种方法辨别颅底和AEA依旧可能存在2mm左右的误差[28]。因此术中仅靠导航并不完全可靠,还需要手术医生术前精准判读CT了解LAEA位置及颅底与周围解剖结构关系,以避免医源性并发症的发生。对于鼻内镜手术(如Draf手术)或者难治性鼻出血的AEA结扎,术前需了解AEA变异情况、预测其走行方式。而国外的研究利用鼻腔内解剖标志如上颌骨额突、额隐窝、中鼻甲基板、筛板外侧板高度、SOEC来评估AEA的研究较多[3,4]。而国内相关研究较少,本研究详尽描述了CT上LAEA与IFAC气房类型、LLCP、Keros分型的关系,并测量FALS以评估LAEA,以详尽描述AEA的变异类型和走行,为耳鼻喉科医生提供参考。
综上所述,当存在SOEC、SBC、较高级别Keros分型、更大的APF前后径及FALS等可靠的指标时,LAEA发生率增高,术前进行详尽的三维重建影像学评估,了解颅底情况,明确AEA与周围解剖结构的位置关系,可降低AEA医源性损伤的风险。

