MicroRNA-146a通过靶向调控TGF-β/SMAD对后纵韧带细胞成骨分化的影响
张海涛,王 磊,刘伟静,于康威,张 前,袁素平,刘丽丽
颈椎后纵韧带骨化症是机体颈椎后纵韧带出现异位骨化,并且对神经产生压迫从而产生了一系列的临床症状[1]。现在颈椎后纵韧带骨化症发病机制还未得到明确[2]。近几年研究表明,微RNA(microRNA,miRNA)在颈椎后纵韧带骨化症的发生过程中有着相当重要的作用,其能够与mRNA 3"端的非翻译区相结合[3]。还有研究表明miRNA-146a与后纵韧带细胞成骨分化有关,但是其具体的作用机制还不明确[4]。转化生长因子-β(transforming growth factor-β,TGF-β)作为一种促纤维因子,其能够对细胞的成骨化进行促进,SMAD2(mothers against decapentaplegic homolog 2 gene)是其下游基因,其能够对韧带干细胞的迁移和转录产生影响[5]。TGF-β/SMAD2信号通路能够对基因的转录进行调控,而且转录后的mRNA能够对TGF-β/SMAD2信号通路的其他相关基因进行调控[6]。笔者通过对miR-146a在颈椎后纵韧带细胞成骨化过程中的功能和机制进行研究,探讨miRNA-146a表达对颈椎后纵韧带骨化症进展的影响。
1 材料与方法
1.1 实验材料
1.1.1 临床材料
选择2020年5月至12月在陆军第八十二集团军医院骨外科进行手术治疗的颈椎后纵韧带骨化症患者8例(观察组),其中男性5例,女性3例;年龄28~37岁,平均年龄33.83岁(标准差3.29岁)。在进行颈椎前路减压手术时,收集患者的未骨化的后纵韧带部分。
在同一时期选择接受治疗的颈椎外伤患者4例(对照组),其中男性2例,女性2例;年龄27~36岁,平均年龄34.03岁(标准差4.29岁)。在手术中以相同的手法收集患者的后纵韧带部分。
所有患者及家属对此项研究知情,并签署知情同意书;该研究经过医院伦理委员会审批通过。
1.1.2 主要试剂与仪器
10%胎牛血清(大连美伦生物科技有限公司,中国);1%双抗的杜尔贝科改良伊格尔培养液(Dulbecco’s modified Eagle medium,DMEM)(Gibco,美国);TRIzol(Invitrogen,美国);SYBR Green(Roche,美国);转染试剂(Promega,美国);RNA oligo(上海吉玛公司,中国);茜素红染色剂(SclenCell,美国);碱性磷酸酶染色试剂盒(上海斯丹赛生物技术有限公司,中国)。
1.2 方法
1.2.1 后纵韧带细胞的分离、培养
应用胎牛血清对收集的韧带组织进行清洗,将其剪碎后进行贴壁培养,从而获得所需要的后纵韧带细胞。细胞培养液为10 %胎牛血清和1 %双抗的DMEM。对收集的细胞进行再培养,实验选择2~3代细胞进行。
1.2.2 细胞RNA的提取与实时聚合酶链式反应
采用实时聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)进行检测。应用两组的第3代细胞,提前1 d更换新鲜的培养液,确定细胞生长状态良好。应用TRIzol对RNA进行提取,应用酶标仪对RNA的纯度和浓度进行检测。RNA的总量小于5μg,调节各RNA总量相同,应 用ReverTra Ace qPCR RT Kit进行cDNA逆转录合成,荧光染料为SYBR Green;应用RT-PCR对两组细胞中miR-146a的相对表达量进行检测,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。各样本的目的基因的相对表达量应用StepOneTMSoftware V2.1进行计算。每个样本重复3次,每组设置2副孔。
上海杰里生物技术公司提供PCR引物。GAPDH:下游引物序列,5"-CCAGCCCCAGCGTCAAAGGTG-3",上游引物序列,5"-CGCGGGCTCCAGAACATCAT-3"。miR-146a,下游引物5"-GCTGAAGAACTGAATTTCAGAGGTC-3",上游引物,5"-CCGATGTGTATCCTCAGC-3"。TGF-β下游引物5"-CCACCTGCAAGACCATCGAC-3",上游引物,5"-CCACCTGCAAGACCATCGAC-3"。SMAD2下游引物5"-GTCGTAGCAAACCACCAAG-3",上游引物5"-GGTATGAAATGGCAAATCG-3"。
1.2.3 抑制或者过表达miR-146a对成骨细胞表型的检测
选择观察组第2代细胞,实验前1 d更换新鲜培养液以保证细胞的活力。将细胞接种在24孔板中,培养箱中培养8 h待细胞贴壁。将细胞分为miR-146a过表达组、miR-146a抑制组和对照组。
对照组转染试剂和RNA oligo稀释液,抑制组RNA oligo抑制miR-146a的功能,过表达组RNA oligo应用于miR-146a的过表达。转染试剂每孔加入0.5μL,RNA oligo的质量浓度为100 nmol/L,进行10 min室温孵育,然后在各组样品细胞中加入转染混合液。进行6 h的转染后,培养液更换为骨诱导培养液进行诱导培养,每3 d换1次液;在培养14 d后,采用碱性磷酸酶染色试剂盒应用于细胞染色,然后在340 nm下应用酶标仪进行光密度测量。培养21 d后,将茜素红染色剂用于细胞染色;在550 nm下应用酶标仪对光密度进行测量,应用RT-PCR对各组细胞的骨相关基因中TGF-β和SMAD2 mRNA的表达量进行检测。应用Western blot对细胞中TGF-β和SMAD2蛋白表达进行测量(用相对表达量表示),应用β-actin作为内标。
1.3 统计学方法
所有数据分析均使用SPSS 19.0软件。数据采用均数±标准差表示,使用t检验确认各组数据之间的差异性,当计数资料以百分率表示时使用χ2检验。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 两组患者韧带细胞中miR-146a表达水平比较
对两组韧带细胞的miR-146a表达量进行检测,观察组细胞miR-146a的表达量(8.83±0.62)要高于对照组(1.02±0.13),差异有统计学意义(t=21.35,P<0.05)。
2.2 miR-146a抑制和过表达对后纵韧带细胞骨化的影响
miR-146a抑制组茜素红染色水平和碱性磷酸酶水平低于对照组,差异有显著统计学意义(P<0.01);miR-146a过表达组茜素红染色水平和碱性磷酸酶水平高于对照组,差异有显著统计学意义(P<0.01)。见表1、图1。

图1 miR-146a过表达和抑制细胞骨化茜素红染色对比图(×200)Fig.1 Comparison of alizarin red staining of miR-146a overexpression and inhibition of ossification in cells(×200)

表1 miR-146a抑制和过表达对细胞骨化指标水平影响比较Tab.1 Comparison of miR-146a inhibition and overexpression effect on cell ossification levels
2.3 miR-146a抑制和过表达对后纵韧带细胞TGF-β和SMAD2 mRNA表达的影响
miR-146a抑制组TGF-β和SMAD2 mRNA表达水平低于对照组,差异有显著统计学意义(P<0.01)。miR-146a过表达组TGF-β和SMAD2 mRNA的表达高于对照组,差异有显著统计学意义(P<0.01)。见表2。

表2 miR-146a抑制和过表达对后纵韧带细胞TGF-β和SMAD2 mRNA水平影响比较Tab.2 Comparison of miR-146a inhibition and overexpression effect on TGF-βand SMAD2 mRNA levels in posterior longitudinal ligament cells
2.4 miR-146a抑制和过表达对后纵韧带细胞TGFβ和SMAD2蛋白表达影响比较
miR-146a抑制组TGF-β和SMAD2蛋白表达水平低于对照组,差异有显著统计学意义(P<0.01);miR-146a过表达组TGF-β和SMAD2蛋白表达高于对照组,差异有显著统计学意义(P<0.01)。见表3、图2。
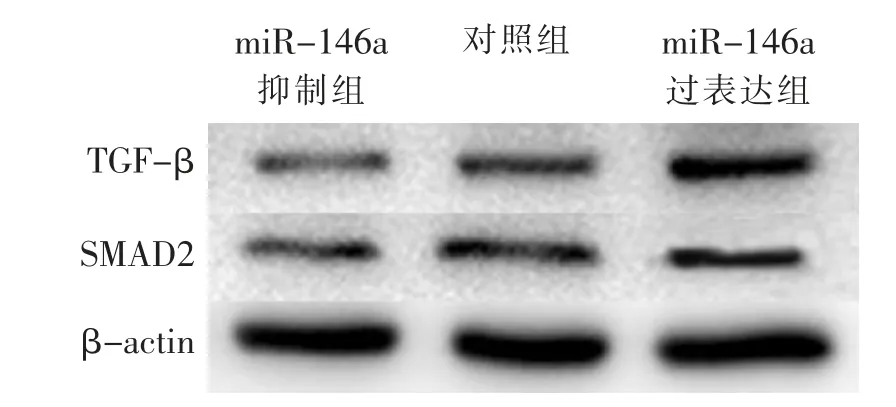
图2 miR-146a抑制和过表达对后纵韧带细胞中TGF-β和SMAD2蛋白表达影响电泳图Fig.2 Electrophoretograms of miR-146a inhibition and overexpression effect on TGF-βand SMAD2 protein expression in posterior longitudinal ligament cells

表3 miR-146a抑制和过表达对后纵韧带细胞中TGF-β和SMAD2蛋白表达比较Tab.3 Comparison of miR-146a inhibition and overexpression on TGF-βand SMAD2 protein expression in posterior longitudinal ligament cells
3 讨论
颈椎后纵韧带成骨化是临床上较为常见的一种脊柱疾病,其具体的发病机制还有待研究[7]。一般认为该疾病的发生是多种因素影响的结果,具体的发病因素可以分为局部因素和系统因素,其中局部因素主要包括椎体不稳和椎间盘退行性变,而系统因素主要包括基因变异、激素功能异常、糖钙代谢异常和饮食及年龄等[8]。
在颈椎后纵韧带成骨化综合征发生的过程中,存在于后纵韧带内部的间质细胞能够与各种生长因子发生反应,进而形成钙化,分化为类成骨细胞,随着新生血管的产生其会慢慢转化为板层骨[9]。研究显示,通过对miRNA-146a进行调控对于后纵细胞成骨化有一定的治疗作用,但是其具体的治疗机制还有待研究[10]。TGF-β能够刺激骨化的进程,而SMAD2是TGF-β的下游蛋白,其能对韧带干细胞的迁移和生长产生影响[11]。此外,颈椎后纵韧带成骨化在钙代谢异常、肥胖症、甲状腺功能衰退及非胰岛素依赖型糖尿病患者中具有较高的发病率,其还受到降钙素、前列腺素-2及甲状旁腺素等相关激素的调控[12]。
miRNA是基因表达调控的重要组成,其通常由20~24个核苷酸组成,在机体的免疫应答、肿瘤发生和生长发育等方面具有较为广泛的应用,而且其具有时空特异性[13]。miRNA发生作用常与靶基因结合位点的序列相关,而此序列常常仅包括6~8个碱基序列,所以单个miRNA可能会对多个mRNA产生作用,而且一个mRNA可能会受到多个miRNA的调控,所以一些miRNA的缺失可能不会影响机体的生长发育,但是可能会引发一些疾病。miRNA特殊的作用方式,导致很多慢性疾病的发生均与其有关。近几年miRNA对骨分化的影响受到大家的关注。有研究表明miR-150-3p能够通过对β-catenin产生作用来对间充质干细胞的成骨分化产生影响;miR-23b能够对SMAD3产生影响进而对MC3T3-E1细胞的成骨化进行抑制[14]。
对于颈椎后纵韧带成骨化患者后纵韧带细胞的培养,大量研究表明,通过组织块贴壁培养能够获得形态学表现较好的颈椎后纵韧带细胞,而且体外培养此细胞发现其具有较好的成骨性[15]。笔者所在课题组前期研究发现,在颈椎后纵韧带成骨化患者的后纵韧带组织中miR-146a的表达与颈椎外伤患者存在差异。笔者研究便通过对相应患者的后纵韧带细胞进行培养,发现观察组细胞的miR-146a的表达水平明显高于对照组。笔者研究还发现,过表达miR-146a能够对后纵韧带细胞骨化水平进行增强,且会增加细胞钙质的沉积及碱性磷酸酶的活性,当对miR-146a活性进行抑制后,细胞的成骨化也相对受到了抑制。这表明miR-146a对于颈椎后纵韧带细胞成骨化过程有着调控作用,其在颈椎后纵韧带成骨化患者的高表达促使了后纵韧带骨化的进程。
RT-PCR结果显示,miR-146a过表达组后纵韧带细胞的TGF-β和SMAD2 mRNA表达明显增加,而且miR-146a抑制组TGF-β和SMAD2 mRNA表达明显降低,这表明miR-146a是通过对TGF-β和SMAD2进行调控,进而促使后纵韧带细胞成骨化。
尽管笔者研究已经初步对miR-146a的下游调控机制进行明确,但是为何在颈椎后纵韧带成骨综合征患者中的miR-146a水平会出现特异性升高的原因还不明确,其具体的功能也还有待进一步的研究。笔者研究对miR-146a进行分析,从细胞层面揭示了miRNA在颈椎后纵韧带细胞成骨分化的重要意义。当然,也期望更多的研究能够揭示miRNA在颈椎后纵韧带细胞成骨化疾病中的作用。

