LncRNA FGD5-AS1靶向miR-195-5p调控弥漫型大B细胞淋巴瘤细胞活性
罗蔓琳 郑兴萍 杨娅娟 张 良(云南省第二人民医院输血科,昆明 650021)
弥漫型大B细胞淋巴瘤是临床常见的成人非霍奇金淋巴瘤,占非霍奇金淋巴瘤发病率的30%左右,利妥昔单抗标准化治疗方案可明显改善弥漫型大B细胞淋巴瘤患者五年生存率,但仍有部分患者死于耐药或复发。已知长链非编码RNA(LncRNA)在肿瘤发生发展过程中发挥重要调控作用,但作用机制尚未阐明[1-4]。FGD5-AS1在肾细胞癌中表达升高,并可调控miR-5590-3p及ERK/AKT信号通路从而促进肾细胞癌细胞增殖及转移[5]。miR-195-5p通过靶向CEP55抑制非小细胞肺癌细胞增殖并诱导其凋亡[6]。但FGD5-AS1与miR-195-5p在弥漫型大B细胞淋巴瘤中的表达及其可能作用机制尚未可知。因此,本研究主要探讨FGD5-AS1对弥漫型大B细胞淋巴瘤细胞增殖、凋亡的影响,及其对miR-195-5p的调控作用。
1 材料与方法
1.1 材料 人B淋巴母细胞IM-9、弥漫型大B细胞淋巴瘤细胞系OCI-Ly1、OCI-Ly4、OCI-Ly10购自美国ATCC细胞库;DMEM培养基、胎牛血清购自美国Gibco公司;Lipofectamine2000、胰蛋白酶购自美国Thermo Fisher公司;Trizol试剂购自美国Invitrogen公司;反转录试剂盒、SYBR Green试剂盒购自北京天根生化科技有限公司;si-NC、si-FGD5-AS1、miR-NC、miR-195-5p mimics、anti-miR-NC、anti-miR-195-5p购自广州锐博生物科技有限公司;MTT试剂、AnnexinⅤ-FITC/PI双染法细胞凋亡检测试剂购自北京索莱宝科技有限公司;兔抗人CyclinD1、Cleaved-caspase-3、β-catenin抗体购自美国Santa Cruz公司;HRP标记的山羊抗兔IgG二抗购自武汉艾美捷科技有限公司;StepOnePlus实时荧光定量PCR仪购自美国ABI公司。
1.2 方法
1.2.1 分组IM-9、OCI-Ly1、OCI-Ly4、OCI-Ly10细胞培养于含10%胎牛血清、100 U/ml青霉素、100µg/ml链霉素的DMEM培养液,生长至80%汇合时传代。取对数生长期OCI-Ly1细胞(2.5×105个/ml)接种于96孔板(100µl/孔),参照Lipofectamine2000转染试剂说明书分别转染si-NC、si-FGD5-AS1、miR-NC、miR-195-5p mimics、anti-miR-NC、anti-miR-195-5p、si-FGD5-AS1+anti-miR-NC、si-FGD5-AS1+anti-miR-195-5p,分别记为si-NC组、si-FGD5-AS1组、miR-NC组、miR-195-5p组、anti-miR-NC组、anti-miR-195-5p组、si-FGD5-AS1+anti-miR-NC组、si-FGD5-AS1+antimiR-195-5p组,同时将正常培养的细胞作为NC组。
1.2.2 qRT-PCR检测细胞FGD5-AS1、miR-195-5p表达 采用Trizol法提取IM-9、OCI-Ly1、OCI-Ly4、OCI-Ly10细胞及各组转染后的OCI-Ly1细胞总RNA,紫外分光光度计测定RNA浓度。参照反转录试剂说明书配制反应体系与设置反应条件,将总RNA反转录合成cDNA,稀释20倍后进行qRT-PCR反应,反应体系:SYBR Green Master Mix 10µl、正反向引物各0.8µl、cDNA 1µl、ddH2O补足至20µl;反应条件:95℃预变性2 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,40个循环。实时荧光定量PCR仪检测FGD5-AS1、miR-195-5p相对表达。
1.2.3 MTT检测细胞增殖 取各组OCI-Ly1细胞(2.5×105个/ml)接种于96孔板(100µl/孔),继续培养24 h,20µl/孔加入MTT溶液,继续培养4 h,弃上清,150µl/孔加入DMSO,室温避光孵育5 min,酶标仪检测各孔吸光度(A)。
1.2.4 流式细胞术检测细胞凋亡 取各组OCI-Ly1细胞,预冷PBS洗涤,3 000 r/min离心5 min,弃上清,加入500µl结合缓冲液重悬细胞,分别加入5µl AnnexinⅤ-FITC与5µl PI,室 温 振 荡 孵 育10 min,FACS Calibur流式细胞仪检测细胞凋亡率。
1.2.5 双荧光素酶报告基因检测FGD5-AS1与miR-195-5p的靶向关系starbase预测显示FGD5-AS1与miR-195-5p存在结合位点,将含有结合位点的序列载入荧光素酶报告基因载体构建野生型载体FGD5-AS1-WT,采用基因突变技术突变结合位点,将含有突变位点的序列载入荧光素酶报告基因载体构建突变型载体FGD5-AS1-MUT,miR-NC、miR-195-5p mimics分 别 与FGD5-AS1-WT、FGD5-AS1-MUT共转染至OCI-Ly1细胞,继续培养24 h,检测荧光素酶活性。
1.2.6 Westernblot检测CyclinD1、Cleaved-caspase-3、β-catenin蛋白表达 取各组OCI-Ly1细胞加入400µl RIPA裂解液提取细胞总蛋白,BCA法检测蛋白浓度,将上样缓冲液加入蛋白样品后置于沸水中煮10 min变性蛋白,取40µg蛋白进行SDS-PAGE,转至PVDF膜,5%脱脂奶粉封闭2 h,加入一抗稀释液(1∶1 000)4℃孵育24 h,TBST洗涤,加入二抗稀释液(1∶2 000)室温条件孵育1 h,滴加ECL,暗室曝光显影,Image J软件分析各条带灰度值。
1.3 统计学处理 采用SPSS21.0软件分析数据,计量资料以±s表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 弥漫型大B细胞淋巴瘤细胞系FGD5-AS1和miR-195-5p表达 与IM-9细胞比较,弥漫型大B细胞 淋 巴 瘤 细 胞 系OCI-Ly1、OCI-Ly4、OCI-Ly10中FGD5-AS1表达升高(P<0.05),miR-195-5p表达降低(P<0.05),OCI-Ly1细胞变化最为显著(表1),因此选择OCI-Ly1细胞进行后续研究。
表1 弥漫型大B细胞淋巴瘤细胞系FGD5-AS1和miR-195-5p表达(±s,n=9)Tab.1 Expressions of FGD5-AS1 and miR-195-5p in diffuse large B-cell lymphoma cell lines(±s,n=9)

表1 弥漫型大B细胞淋巴瘤细胞系FGD5-AS1和miR-195-5p表达(±s,n=9)Tab.1 Expressions of FGD5-AS1 and miR-195-5p in diffuse large B-cell lymphoma cell lines(±s,n=9)
Note:Compared with IM-9 cells,1)P<0.05.
Groups IM-9 OCI-Ly1 OCI-Ly4 OCI-Ly10 F P FGD5-AS1 1.00±0.10 2.26±0.211)2.01±0.171)1.82±0.161)98.682 0.000 miR-195-5p 1.02±0.10 0.32±0.031)0.43±0.041)0.51±0.051)230.560 0.000
2.2 FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响 与si-NC组比较,si-FGD5-AS1组细胞活力降低(P<0.05),凋亡率升高(P<0.05),CyclinD1蛋白水平降低(P<0.05),Cleaved-caspase-3蛋白水平升高(P<0.05,图1、表2)。
表2 FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.2 Effect of down-expression of FGD5-AS1 on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)
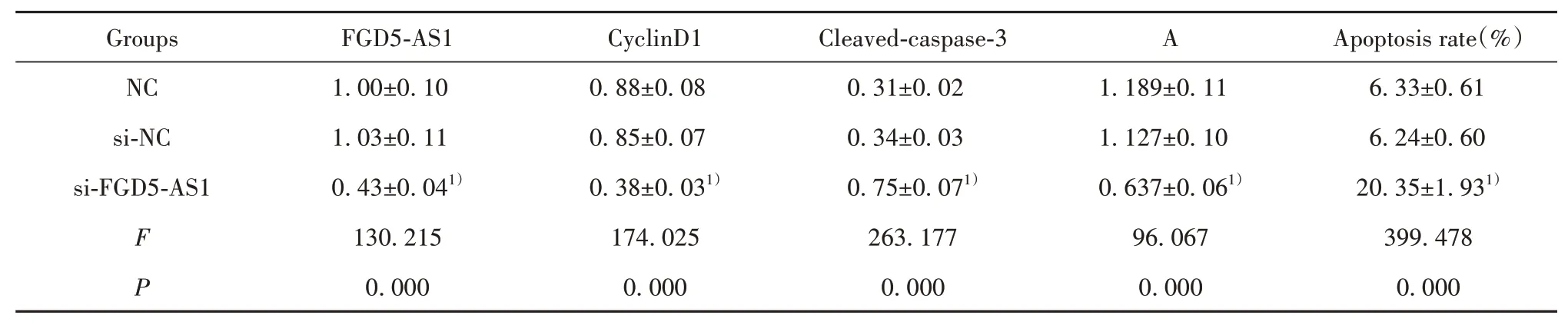
表2 FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.2 Effect of down-expression of FGD5-AS1 on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)
Note:Compared with si-NC group,1)P<0.05.
Groups NC si-NC si-FGD5-AS1 F P FGD5-AS1 1.00±0.10 1.03±0.11 0.43±0.041)130.215 0.000 CyclinD1 0.88±0.08 0.85±0.07 0.38±0.031)174.025 0.000 Cleaved-caspase-3 0.31±0.02 0.34±0.03 0.75±0.071)263.177 0.000 A 1.189±0.11 1.127±0.10 0.637±0.061)96.067 0.000 Apoptosis rate(%)6.33±0.61 6.24±0.60 20.35±1.931)399.478 0.000

图1 FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响Fig.1 Effect of down-expression of FGD5-AS1 on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1
2.3 过表达miR-195-5p对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响 与miR-NC组比较,miR-195-5p组细胞活力降低(P<0.05),凋亡率升高(P<0.05),CyclinD1蛋白水平降低(P<0.05),Cleaved-caspase-3蛋白水平升高(P<0.05,表3、图2)。

图2 Western blot检测CyclinD1、Cleaved-caspase-3蛋白表达Fig.2 Western blot to detect CyclinD1,Cleaved-caspase-3 protein expressions
表3 过表达miR-195-5p对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.3 Effect of over-expression of miR-195-5p on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)
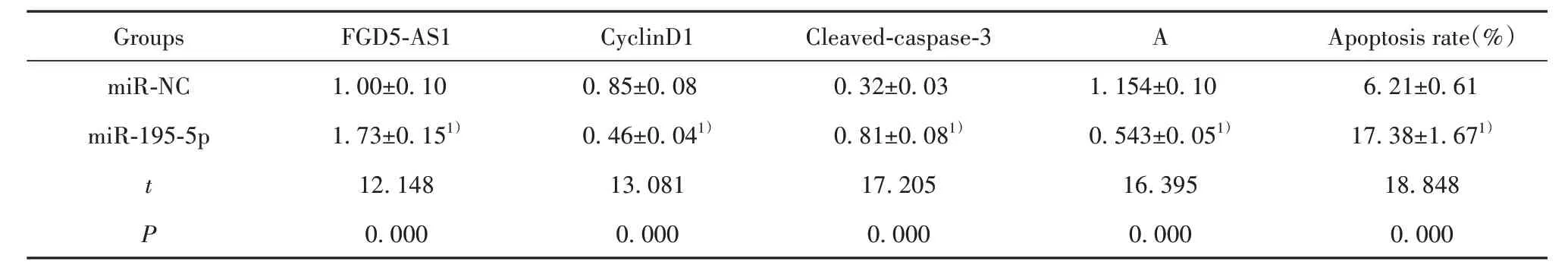
表3 过表达miR-195-5p对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.3 Effect of over-expression of miR-195-5p on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
Groups miR-NC miR-195-5p t P 1.00±0.10 1.73±0.151)12.148 0.000 0.85±0.08 0.46±0.041)13.081 0.000 0.32±0.03 0.81±0.081)17.205 0.000 1.154±0.10 0.543±0.051)16.395 0.000 6.21±0.61 17.38±1.671)18.848 0.000 FGD5-AS1 CyclinD1 Cleaved-caspase-3 A Apoptosis rate(%)
2.4 FGD5-AS1靶向调控miR-195-5p表达starbase预测显示FGD5-AS1与miR-195-5p存在结合位点(图3)。miR-195-5p过表达可明显降低野生型载体FGD5-AS1-WT荧光素酶活性(P<0.05),而对突变型载体FGD5-AS1-MUT荧光素酶活性无明显影响(P>0.05,表4)。表明FGD5-AS1可靶向结合miR-195-5p。与si-NC组比较,si-FGD5-AS1组miR-195-5p表达升高(P<0.05);与pcDNA-NC组比较,pcDNA-FGD5-AS1组miR-195-5p表 达 降 低(P<0.05,表5)。
表4 miR-NC或FGD5-AS1-野生型及突变型报告质粒共转染H9C2细胞后双荧光素酶活性(±s,n=9)Tab.4 Dual luciferase activity after co-transfection of miR-NC or FGD5-AS1-wild-type and mutant-type reporter plasmids into H9C2 cells(±s,n=9)

表4 miR-NC或FGD5-AS1-野生型及突变型报告质粒共转染H9C2细胞后双荧光素酶活性(±s,n=9)Tab.4 Dual luciferase activity after co-transfection of miR-NC or FGD5-AS1-wild-type and mutant-type reporter plasmids into H9C2 cells(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
Groups miR-NC miR-195-5p t P FGD5-AS1-WT 1.00±0.10 0.45±0.041)15.320 0.000 FGD5-AS1-MUT 1.03±0.11 0.99±0.10 0.807 0.431
表5 qRT-PCR检测miR-195-5p表达(±s,n=9)Tab.5 qRT-PCR to detect expression of miR-195-5p(±s,n=9)

表5 qRT-PCR检测miR-195-5p表达(±s,n=9)Tab.5 qRT-PCR to detect expression of miR-195-5p(±s,n=9)
Note:Compared with si-NC group,1)P<0.05;compared with pcDNANC group,2)P<0.05.
Groups si-NC si-FGD5-AS1 pcDNA-NC pcDNA-FGD5-AS1 F P miR-195-5p 1.00±0.10 2.11±0.201)0.96±0.09 0.47±0.042)289.789 0.000

图3 Starbase预测miR-195-5p与FGD5-AS1结合Fig.3 Starbase prediction of combination of miR-195-5p and FGD5-AS1
2.5 低表达miR-195-5p可逆转FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响 与anti-miR-NC组比较,anti-miR-195-5p组细胞活力升高(P<0.05),凋亡率降低(P<0.05),CyclinD1蛋白水平升高(P<0.05),Cleaved-caspase-3蛋白水平降低(P<0.05);与si-FGD5-AS1+anti-miRNC组比较,si-FGD5-AS1+anti-miR-195-5p组细胞活力升高(P<0.05),凋亡率降低(P<0.05),CyclinD1蛋白水平升高(P<0.05),Cleaved-caspase-3蛋白水平降低(P<0.05,图4、表6)。
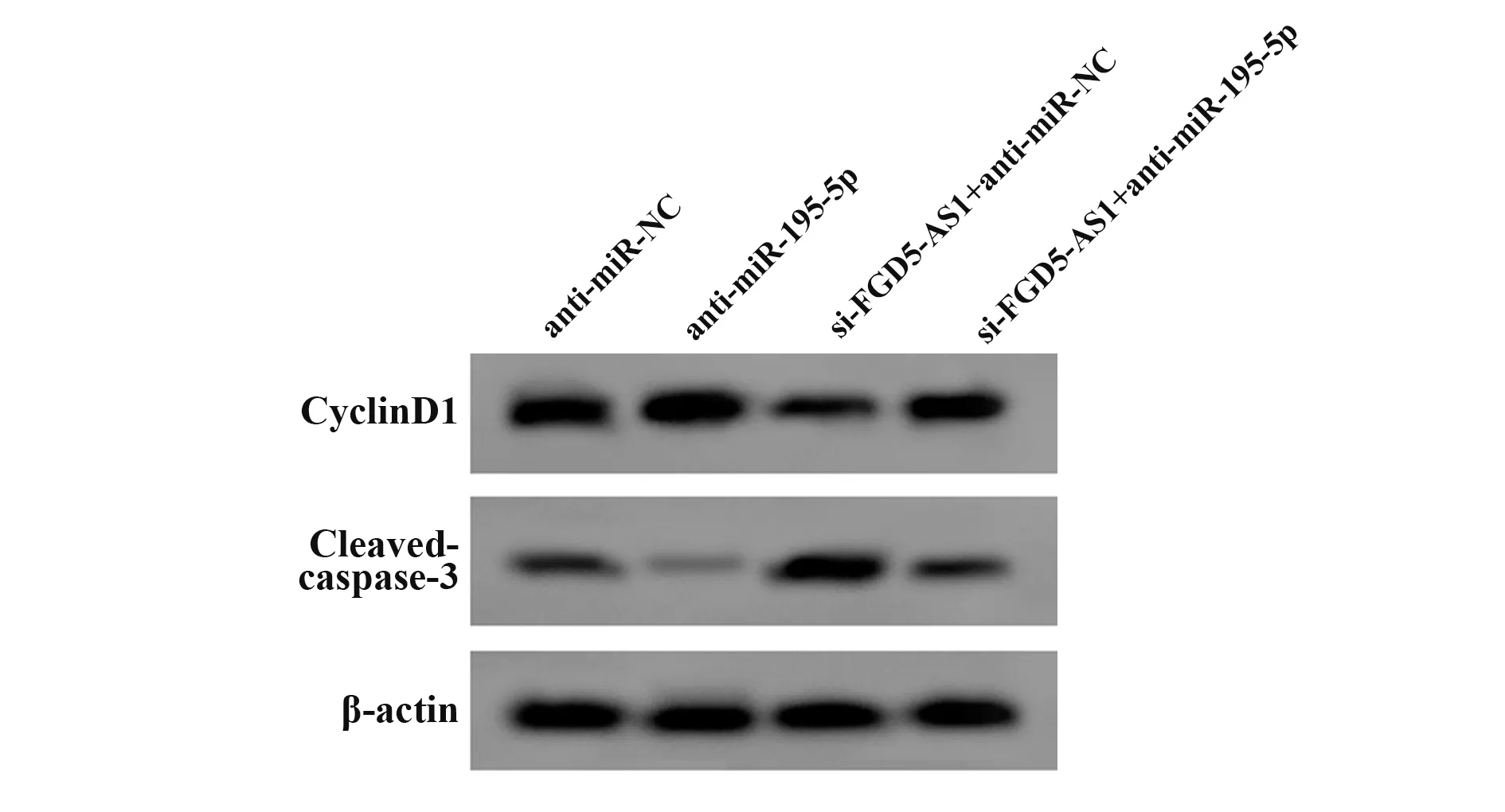
图4 Western blot检测CyclinD1、Cleaved-caspase-3表达Fig.4 Western blot to detect expressions of CyclinD1 and Cleaved-caspase-3
表6 低表达miR-195-5p可逆转FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.6 Down-expression of miR-195-5p reversed effect of down-expression of FGD5-AS1 on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)

表6 低表达miR-195-5p可逆转FGD5-AS1低表达对弥漫型大B细胞淋巴瘤细胞OCI-Ly1增殖、凋亡的影响(±s,n=9)Tab.6 Down-expression of miR-195-5p reversed effect of down-expression of FGD5-AS1 on proliferation and apoptosis of diffuse large B-cell lymphoma cells OCI-Ly1(±s,n=9)
Note:Compared with anti-miR-NC group,1)P<0.05;compared with si-FGD5-AS1+anti-miR-NC group,2)P<0.05.
Groups anti-miR-NC anti-miR-195-5p si-FGD5-AS1+anti-miR-NC si-FGD5-AS1+anti-miR-195-5p FP miR-195-5p 1.00±0.11 0.36±0.031)2.03±0.18 1.17±0.112)296.557 0.000 CyclinD1 0.83±0.08 1.28±0.121)0.40±0.04 0.88±0.082)161.948 0.000 Cleaved-caspase-3 0.31±0.03 0.04±0.011)0.73±0.07 0.34±0.032)427.235 0.000 A 1.148±0.11 1.486±0.141)0.641±0.05 1.024±0.102)99.151 0.000 Apoptosis rate(%)6.30±0.62 2.11±0.201)19.83±1.87 8.02±0.752)462.985 0.000
2.6 Wnt/β-catenin信号通路蛋白表达 与si-NC组比较,si-FGD5-AS1组β-catenin蛋白水平降低(P<0.05);与anti-miR-NC组比较,anti-miR-195-5p组β-catenin蛋白水平升高(P<0.05);与si-FGD5-AS1+anti-miR-NC组比较,si-FGD5-AS1+anti-miR-195-5p组β-catenin蛋白水平升高(P<0.05,图5、表7)。

图5 Western blot检测β-catenin蛋白表达Fig.5 Western blot to detectβ-catenin protein expression
表7 Wnt/β-catenin信号通路蛋白表达(±s,n=9)Tab.7 Wnt/β-catenin signaling pathway protein expression(±s,n=9)
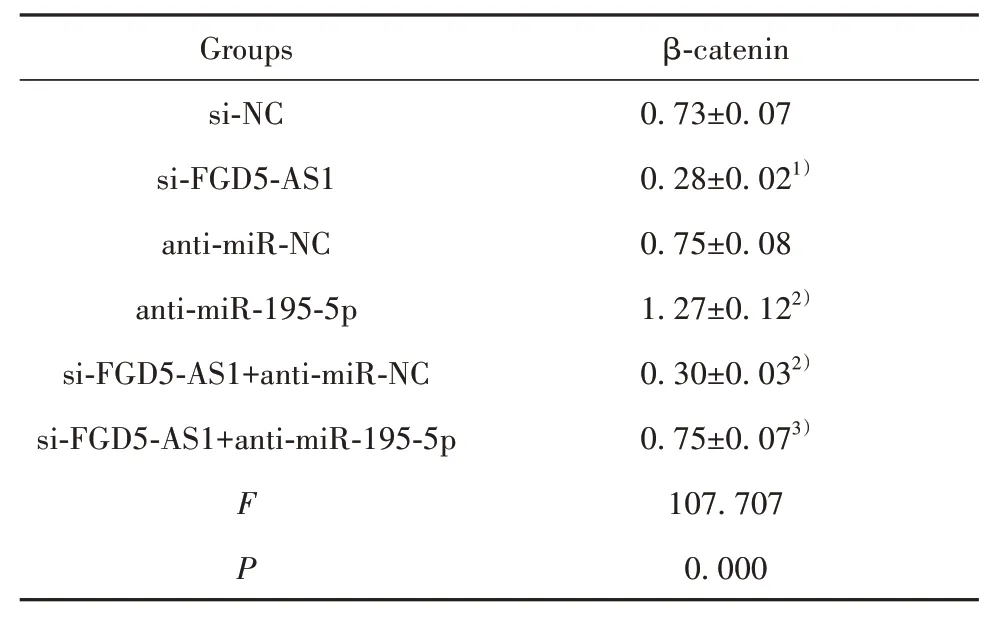
表7 Wnt/β-catenin信号通路蛋白表达(±s,n=9)Tab.7 Wnt/β-catenin signaling pathway protein expression(±s,n=9)
Note:Compared with si-NC group,1)P<0.05;compared with anti-miRNC group,2)P<0.05;compared with si-FGD5-AS1+anti-miRNC group,3)P<0.05.
Groups si-NC si-FGD5-AS1 anti-miR-NC anti-miR-195-5p si-FGD5-AS1+anti-miR-NC si-FGD5-AS1+anti-miR-195-5p F P β-catenin 0.73±0.07 0.28±0.021)0.75±0.08 1.27±0.122)0.30±0.032)0.75±0.073)107.707 0.000
3 讨论
FGD5-AS1通过充当miR-302e的竞争性内源RNA分子而上调CDCA7表达,从而促进结直肠癌细胞增殖、迁移和侵袭[7]。FGD5-AS1通过竞争性结合miR-153-3p调节MCL1表达而促进口腔癌进展[8]。FGD5-AS1通过miR-153-3p/CITED2轴调节胃癌细胞增殖[9]。本研究显示,弥漫型大B细胞淋巴瘤细胞FGD5-AS1表达升高,提示FGD5-AS1在弥漫型大B细胞淋巴瘤发生过程中可能发挥癌基因作用,原因可能为FGD5-AS1在不同肿瘤组织中表达不同。CyclinD1与CDK4/6结合形成复合物,可正向调控细胞周期,促进细胞增殖[10]。本研究显示,干扰FGD5-AS1表达可明显降低弥漫型大B细胞淋巴瘤细胞活力,抑制CyclinD1表达,提示干扰FGD5-AS1表达可抑制弥漫型大B细胞淋巴瘤细胞增殖。线粒体途径是细胞凋亡主要途径之一,当细胞接收凋亡信号时,线粒体释放细胞色素C,激活caspase级联反应从而促进细胞凋亡[11]。本研究显示,干扰FGD5-AS1表达可明显提高弥漫型大B细胞淋巴瘤细胞凋亡率,促进Cleaved-caspase-3表达,提示干扰FGD5-AS1表达可促进弥漫型大B细胞淋巴瘤细胞凋亡。
本研究证实FGD5-AS1能够竞争性结合miR-195-5p,并负向调控miR-195-5p表达。miR-195-5p通过抑制ARL2表达抑制宫颈癌细胞迁移和侵袭[12]。miR-195-5p通过靶向YAP1抑制宫颈癌恶性进展[13]。miR-195-5p通过FOXK1抑制肺癌细胞增殖、迁移和侵袭[14]。本研究显示,弥漫型大B细胞淋巴瘤细胞miR-195-5p表达降低,进一步研究显示,miR-195-5p过表达可明显降低弥漫型大B细胞淋巴瘤细胞活力,提高细胞凋亡率,而抑制miR-195-5p表达可明显增强弥漫型大B细胞淋巴瘤细胞活力,降低凋亡率,促进CyclinD1表达而抑制Cleaved-caspase-3表达,提示miR-195-5p过表达可抑制弥漫型大B细胞淋巴瘤细胞增殖及促进细胞凋亡,同时,干扰FGD5-AS1表达与抑制miR-195-5p表达联合处理可明显提高弥漫型大B细胞淋巴瘤细胞活力,降低细胞凋亡率,提示抑制miR-195-5p表达可明显逆转干扰FGD5-AS1表达对弥漫型大B细胞淋巴瘤细胞增殖及凋亡的作用。Wnt/β-catenin信号通路与肿瘤发生发展密切相关,可调控细胞增殖、黏附等生物学过程,在肿瘤形成过程中异常活化,GSK3β磷酸化可减少胞浆内β-catenin降解,导致细胞内β-catenin聚集,细胞核内β-catenin含量增加,最终促进CyclinD1、MMP-7等下游基因表达[15-16]。本研究显示,干扰FGD5-AS1表达后β-catenin蛋白水平降低,抑制miR-195-5p表达后β-catenin蛋白水平升高,而干扰FGD5-AS1与抑制miR-195-5p表达联合处理后β-catenin蛋白水平升高,提示FGD5-AS1/miR-195-5p调控弥漫型大B细胞淋巴瘤细胞增殖及凋亡的生物学过程与Wnt/β-catenin信号通路活化密切相关。
综上,弥漫型大B细胞淋巴瘤细胞FGD5-AS1表达升高,而miR-195-5p表达降低,干扰FGD5-AS1表达可通过负调控miR-195-5p表达抑制弥漫型大B细胞淋巴瘤细胞增殖及促进细胞凋亡,其作用机制可能与抑制Wnt/β-catenin信号通路活化有关,为弥漫型大B细胞淋巴瘤治疗提供了潜在靶标。本研究仅采用弥漫型大B细胞淋巴瘤细胞OCI-Ly1进行研究,弥漫型大B细胞淋巴瘤细胞系OCI-Ly4、OCILy10中FGD5-AS1/miR-195-5p是否可发挥相似作用及可能作用机制仍需进一步探究。

