lncRNA-GAS5/miRNA21 ceRNA调控网络在高氧性急性肺损伤发病过程中的作用研究①
石 磊 付 豹 何 英 廖贞亮 陈 涛 陈 淼(遵义医科大学附属医院重症医学科,遵义 563000)
高氧性急性肺损伤(hyperoxia-induced acute lung injury,HALI)是氧疗最典型的并发症,可进一步发展为成人急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)及新生儿支气管肺发育不良,是导致患者死亡及新生儿支气管发育不良的主要原因之一[1-2]。肺泡上皮细胞参与肺组织免疫调节、肺水转运、肺泡表面活性物质合成分泌、增殖、分化和修复等过程。研究表明,高氧可导致肺泡上皮细胞凋亡,促进HALI发生发展[3]。微小RNAs(miRNAs)是一组由18~25个核苷酸组成的高度保守的非编码单链RNAs,长链非编码RNA(lncRNA)是一组不具有编码蛋白质能力的功能性长链RNA,两者参与多种疾病(包括急性肺损伤)发病过程[4-5]。研究表明,miR-21在HALI进展中表达下调,且miR-21可抑制大鼠肺泡上皮细胞早期凋亡,采用慢病毒过表达miR-21能够显著改善大鼠HALI[6-7]。近年研究发现,lncRNA能够作为竞争性内源RNA(ceRNA,一个RNA可调节多个靶基因,同一个靶基因可被不同RNA调节,调控同一靶点RNA间构成竞争关系)吸附miRNAs,上调miRNA靶基因表达,发挥生物学功能。研究表明,lncRNA-GAS5能够通过负调节细胞内miR-21水平从而调控miR-21对靶基因的抑制[8-10]。因此推测HALI发病过程中miR-21水平可能受lncRNA-GAS5调节。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级雄性SD大鼠购于北京维通利华实验动物技术有限公司,体质量约200 g,许可证号:SCXK(京)2019-0009。
1.1.2 主要试剂 慢病毒载体由北京博恒科创生物科技有限公司制备;IL-1β、IL-6、TNF-αELISA试剂盒购于R&D system公司;AnnexinⅤ-PI凋亡染色试剂盒购于美国BD公司;抗大鼠GAPDH、IκBα、NF-κB p65、Lamin B1抗体均购于Abcam公司。
1.2 方法
1.2.1 动物干预方式SD大鼠随机分为空白组(n=6)、模型组(n=12)、lncRNA组(n=12)和lncRNA联合miRNA组(n=12),所有大鼠采用异氟烷麻醉,空白组不做任何处理,模型组静脉注射200µl慢病毒空载体(6×106TU/ml,饱和转染剂量),lncRNA组静脉注射200µl lncRNA-GAS5过表达慢病毒载体(6×106TU/ml),lncRNA联 合miRNA组 静 脉 注 射200µl lncRNA-GAS5过表达慢病毒载体(6×106TU/ml)和200µl miR-21过表达慢病毒载体(6×106TU/ml),转染72 h(饱和转染时间)后,模型组、lncRNA组和lncRNA联合miRNA组大鼠给予高氧处理,建立HALI模型:自制高氧箱(45 cm×30 cm×35 cm的有机玻璃容器,顶端开孔接氧气接头,侧面有等大出气孔,可接氧气检测仪),将SD大鼠置于高氧箱中饲养,25~27℃,50%~70%湿度,箱内氧浓度持续≥90%,箱内放置钠石灰吸收大鼠呼出的CO2,保持箱内CO2浓度<0.5%,23.5 h/d持续给氧,上午定时开舱0.5 h添加食物、水以及更换垫料[11]。
1.2.2 呼吸指标检测 高氧处理48 h后取大鼠动脉血检测,分析氧合指数(oxygenation index,OI)和呼吸指数(respiration index,RI)。OI=PaO2/FiO2,其中PaO2为动脉氧分压,FiO2为吸入氧浓度,本研究FiO2均记为90%。RI=P(A-a)O2/PaO2,其中P(A-a)O2为肺泡-动脉血氧分压差,PaO2为动脉血氧分压。
1.2.3 肺组织病理及湿/干重比(W/D)分析 高氧处理48 h后麻醉处死各组大鼠,取大鼠右肺组织,10%甲醛固定24 h,脱水,石蜡包埋,制备石蜡切片,进行HE染色。每只大鼠随机选取20个高倍视野(×400),采用Gustavo Matute-Bello等评分系统进行独立评分。按照肺泡及肺泡间质中性粒细胞个数、透明膜个数、蛋白碎片填充个数及肺泡间隔厚度进行评分,并取评分平均值。取大鼠左肺,快速去除周围结缔组织,滤纸擦干组织表面水分称重,记为肺湿重(W),将肺组织80℃烘烤,每日称重至恒重,记为肺干重(D),计算肺W/D。
1.2.4 血浆细胞因子水平检测 高氧处理48 h后麻醉各组大鼠,取各组大鼠外周血,离心分离血浆,ELISA检测各组大鼠血浆IL-1β、IL-6、TNF-α水平,参照IL-1β、IL-6、TNF-αELISA试剂盒说明书操作。
1.2.5 肺组织细胞凋亡分析 取20 mg左肺组织,0.25%胰酶+0.1%Ⅰ型胶原酶1∶1混合后注入肺组织,快速剪碎,放入摇床,150 r/min、37℃消化18 min,等体积终止液终止消化,并加入5 ml DNaseⅠ防止细胞成团,200目不锈钢滤网过滤,收集滤液,离心,弃上清,红细胞裂解液重悬沉淀,室温静置1 min,等体积2×EDTA终止,离心,弃上清,收集沉淀,即得到肺组织细胞(主要由肺泡上皮细胞和巨噬细胞组成)。AnnexinⅤ-PI凋亡染色试剂盒对分离的细胞进行染色,流式细胞仪分析细胞凋亡情况。
1.2.6 RT-PCR高氧处理48 h后麻醉处死各组大鼠,取大鼠右肺组织,采用Trizol法提取海马中RNA,反转录得到cDNA,RT-PCR检测海马组织细胞因子lncRNA-GAS5、miR-21、IL-1β、IL-6、TNF-α RNA表达。lncRNA-GAS5正向引物:5'-ATTTCAAGGGCTCCTCT-3',反向引物:5'-TTGGCAAATCTTCTGTTC-3';miR-21正向引物:5'-TGTACCACCTTGTCGG-3',反向引物:5'-TGCTGTTGCCATGAGAT-3';IL-1β正向引物:5'-GATGTCGAGAGTCCCAATGA-3',反向引物:5'-GCTGGCATTCTGAGGCAAAA-3';IL-6正 向 引 物:5'-GATTAGCCGAGGTATAGCCA-3',反向引物:5'-ACTTGGAGCTTCGGACAAGA-3';TNF-α正向引物:5'-GGCTAATTCAGTTAGGCGGC-3',反向引物:5'-CGGAGGACTTTGTAATGCAC-3';GAPDH正向引物:5'-CGTATCGGACGCCTGGTT-3',反向引物:5'-CGTGGGTAGAGTCATACTGGAAC-3'。
1.2.7 Western blot高氧处理48 h后麻醉处死各组大鼠,取大鼠右肺组织,RIPA裂解液对组织进行裂解,Western blot检测裂解液中IκBα磷酸化及细胞核内NF-κB p65核积累量。
1.3 统计学处理 采用GraphPad 8.0软件进行统计学分析,计量资料(xˉ±s)先进行正态检验,若服从正态分布,两组间比较采用独立t检验,多组间比较采用单因素方差分析;若不服从正态分布,则选择非参数秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 HALI大鼠肺组织lncRNA-GAS5和miR-21表达RT-PCR结果显示,模型组大鼠肺组织lnc-RNA-GAS5表达显著高于空白组,而miR-21表达显著低于空白组(P<0.01);lncRNA组大鼠肺组织lncRNA-GAS5表达显著高于模型组和空白组,而miR-21表达显著低于模型组和空白组(P<0.01);lncRNA联合miRNA组大鼠肺组织lncRNA-GAS5和miR-21表达均显著高于模型组和空白组(P<0.01,表1)。
表1 HALI大鼠肺组织lncRNA-GAS5和miR-21表 达(±s)Tab.1 lncRNA-GAS5 and miR-21 expressions in lung tissue of HALI rats(±s)
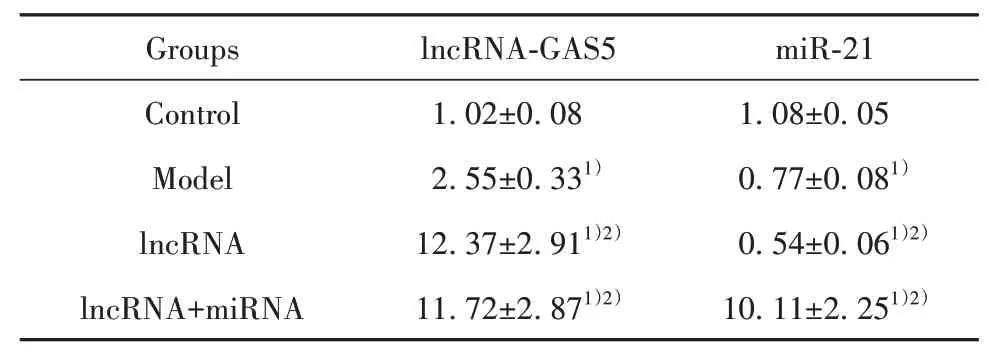
表1 HALI大鼠肺组织lncRNA-GAS5和miR-21表 达(±s)Tab.1 lncRNA-GAS5 and miR-21 expressions in lung tissue of HALI rats(±s)
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.01.
Groups Control Model lncRNA lncRNA+miRNA lncRNA-GAS5 1.02±0.08 2.55±0.331)12.37±2.911)2)11.72±2.871)2)miR-21 1.08±0.05 0.77±0.081)0.54±0.061)2)10.11±2.251)2)
2.2 各组大鼠呼吸指标及肺W/D相比于空白组,模型组大鼠OI显著降低,RI和W/D显著升高(P<0.01);相比于模型组,lncRNA组大鼠OI显著降低,RI和W/D显著升高(P<0.01);相比于lncRNA组,lncRNA联合miRNA组大鼠OI显著升高,RI和W/D显著降低(P<0.05),接近模型组水平(表2)。
表2 各组大鼠呼吸指标及肺W/D(±s)Tab.2 Respiratory indexes and lung W/D of rats in each group(±s)
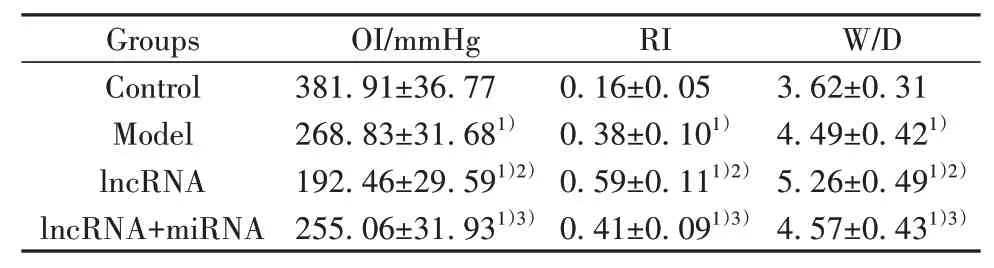
表2 各组大鼠呼吸指标及肺W/D(±s)Tab.2 Respiratory indexes and lung W/D of rats in each group(±s)
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.01;compared with lncRNA group,3)P<0.01.
Groups Control Model lncRNA lncRNA+miRNA OI/mmHg 381.91±36.77 268.83±31.681)192.46±29.591)2)255.06±31.931)3)RI 0.16±0.05 0.38±0.101)0.59±0.111)2)0.41±0.091)3)W/D 3.62±0.31 4.49±0.421)5.26±0.491)2)4.57±0.431)3)
2.3 各组大鼠血清IL-1β、IL-6、TNF-α水平 与空白组相比,模型组大鼠血清IL-1β、IL-6、TNF-α水平显著升高(P<0.05);与模型组相比,lncRNA组大鼠血清IL-1β、IL-6、TNF-α水平显著升高(P<0.01);与lncRNA组 相 比,lncRNA联 合miRNA组 大 鼠 血 清IL-1β、IL-6、TNF-α水平显著降低(P<0.01,表3),接近模型组水平。
表3 各组大鼠血清IL-1β、IL-6、TNF-α水平(±s,ng/L)Tab.3 Serum levels of IL-1β,IL-6 and TNF-αof rats in each group(±s,ng/L)

表3 各组大鼠血清IL-1β、IL-6、TNF-α水平(±s,ng/L)Tab.3 Serum levels of IL-1β,IL-6 and TNF-αof rats in each group(±s,ng/L)
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.01;compared with lncRNA group,3)P<0.01.
Groups Control Model lncRNA lncRNA+miRNA IL-1β 6.47±1.12 14.06±3.181)21.73±4.251)2)15.26±3.881)3)IL-6 22.24±7.24 47.74±10.871)69.86±14.161)2)49.02±11.621)3)TNF-α 40.70±14.33 80.60±21.851)117.73±26.381)2)82.12±25.751)3)
2.4 各组大鼠肺组织病理 与空白组相比,模型组大鼠肺间质中性粒细胞显著增多、肺泡间隔明显增厚、病理评分显著升高(P<0.01);与模型组相比,lncRNA组大鼠肺间质中性粒细胞显著增多、肺泡间隔明显增厚及病理评分升高更为显著(P<0.01);与lncRNA组相比,lncRNA联合miRNA组大鼠肺间质中性粒细胞、肺泡间隔明显增厚及病理评分显著改善(P<0.01,图1)。

图1 各组大鼠肺组织病理变化Fig.1 Pathological changes of lung tissues in each group
2.5 各组大鼠肺组织凋亡细胞数 流式细胞术结果显示,与空白组相比,模型组大鼠肺组织凋亡细胞数显著增多(P<0.01);与模型组相比,lncRNA组大鼠凋亡细胞数显著增多(P<0.01);与lncRNA组相比,lncRNA联合miRNA组大鼠肺组织凋亡细胞数显著减少(P<0.01,图2)。
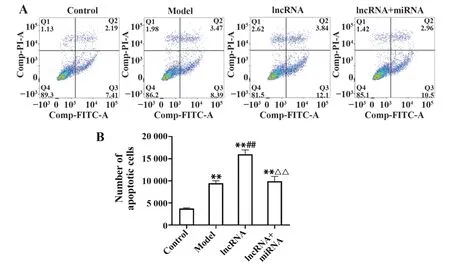
图2 各组大鼠肺组织细胞凋亡情况Fig.2 Apoptosis in lung tissue of rats in each group
2.6 各组大鼠肺组织IL-1β、IL-6、TNF-αmRNA表达 与空白组相比,模型组大鼠肺组织IL-1β、IL-6、TNF-αmRNA表达显著升高(P<0.01);与模型组相比,lncRNA组大鼠肺组织IL-1β、IL-6、TNF-αmRNA表达显著升高(P<0.01);与lncRNA组相比,lncRNA联合miRNA组大鼠肺组织IL-1β、IL-6、TNF-αmRNA表达显著降低(P<0.01,表4),接近模型组水平。
表4 各组大鼠肺组织IL-1β、IL-6、TNF-αmRNA水平(±s)Tab.4 IL-1β,IL-6 and TNF-αmRNA levels of rats in each group(±s)

表4 各组大鼠肺组织IL-1β、IL-6、TNF-αmRNA水平(±s)Tab.4 IL-1β,IL-6 and TNF-αmRNA levels of rats in each group(±s)
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.01;compared with lncRNA group,3)P<0.01.
Groups Control Model lncRNA lncRNA+miRNA IL-1β 0.97±0.06 3.87±1.161)5.69±1.631)2)3.96±1.281)3)IL-6 1.02±0.04 6.78±1.921)11.79±2.531)2)7.01±2.311)3)TNF-α 1.04±0.08 10.03±2.671)18.61±4.061)2)10.73±3.121)3)
2.7 各组大鼠肺组织NF-κB通路激活水平Western blot结果显示,与空白组相比,模型组大鼠肺组织IκBα磷酸化及细胞核内NF-κB p65水平显著升高(P<0.01);与模型组相比,lncRNA组大鼠肺组织IκBα磷酸化及细胞核内NF-κB p65水平显著升高(P<0.01);与lncRNA组相比,lncRNA联合miRNA组大鼠肺组织IκBα磷酸化及细胞核内NF-κB p65水平显著降低(P<0.01,图3)。

图3 各组大鼠肺组织NF-κB通路激活水平Fig.3 Activation level of NF-κB pathway in lung tissues of rats in each group
3 讨论
miR-21是一种抗细胞凋亡基因,在细胞凋亡发生发展中起重要作用,在HALI动物模型及肺泡上皮细胞损伤模型中表达显著降低。进一步实验证明,miR-21能够通过抑制肺泡上皮细胞中PTEN蛋白表达抑制肺泡上皮细胞凋亡,改善HALI[6-7]。miR-21参与HALI发生发展,但其特定的ceRNA调节网络涉及的分子机制尚不明确。
近年lncRNA-GAS5已成为ceRNA调控基因的研究热点。研究发现,人和鼠骨骼肌分化过程中,lncRNA可竞争性结合miRNA,调控miRNA及其靶基因表达,同时也受miRNA调控[12]。lncRNA-GAS5是一种在哺乳动物细胞生长和凋亡过程中起关键调控作用的lncRNA。研究显示,乳腺肿瘤患者miR-21与lncRNA-GAS5表 达 呈 负 相 关,lncRNAGAS5是miR-21的负调节因子,可调节骨关节炎发展过程中软骨细胞存活[8-9]。本研究发现,HALI大鼠肺组织中lncRNA-GAS5表达显著升高;miR-21水平显著下降,与既往研究结果一致。提示lnc-RNAGAS5/miRNA21 ceRNA调控网络可能参与HALI发病过程。
通过慢病毒感染大鼠使大鼠体内高表达lnc-RNA-GAS5或miR-21,给予48 h持续高氧处理,观察大鼠呼吸指标及组织病理变化。OI反映肺部氧合功能,与肺损伤呈负相关;RI反映肺部气体交换功能,与肺功能呈正相关[13]。W/D反映肺泡毛细血管膜通透性变化,通透性改变是急性肺损伤病理生理学的重要参数之一。研究发现,高氧处理的大鼠出现明显急性肺损伤症状,表现为OI显著降低,RI、肺W/D、病理评分、肺组织凋亡细胞数增多,而体内过表达lncRNA-GAS5大鼠OI水平显著低于模型组大鼠,RI、肺W/D、病理评分、肺组织凋亡细胞数显著高于模型组大鼠,表明lncRNA-GAS5能够加剧急性肺损伤。进一步发现,过表达miR-21能够逆转过表达lncRNA-GAS5介导的HALI,表明lncRNA-GAS5通过抑制miR-21表达促进HALI。
炎症细胞,如中性粒细胞浸润及炎症因子(IL-1β、IL-6、TNF-α等)的分泌是HALI发病的重要原因[14]。本研究发现,HALI模型组大鼠外周血IL-1β、IL-6、TNF-α蛋白水平及肺组织IL-1β、IL-6、TNF-αmRNA表达相比于健康大鼠显著升高,而单独过表达lncRNA-GAS5大鼠体内IL-1β、IL-6、TNF-α mRNA及蛋白水平相比于模型组进一步升高,而同时过表达lncRNA-GAS5和miR-21的大鼠体内IL-1β、IL-6、TNF-αmRNA及蛋白水平显著低于单独过表达lncRNA-GAS5大鼠,且其水平接近模型组大鼠,提示lncRNA-GAS5/miR-21调控网络可能通过调控机体炎症反应调节肺损伤。NF-κB信号通路在炎症反应中扮演核心角色,控制转录DNA、细胞因子产生。静息状态下NF-κB与IκB结合,分布于细胞浆,机体受到刺激后,IκB发生磷酸化,磷酸化的IκB与NF-κB分离,NF-κB分子进入核内调控生物学活动[15]。NF-κB信号通路在HALI发病过程扮演重要角色[16]。本研究发现,HALI模型组大鼠肺组织IκBα磷酸化及细胞核内NF-κB p65水平显著高于健康大鼠,单独过表达lncRNA-GAS5的大鼠肺组织IκBα磷酸化及细胞核内NF-κB p65水平相比于模型组进一步升高,而同时过表达lncRNA-GAS5和miR-21的 大 鼠 肺 组 织IκBα磷 酸 化 及 细 胞 核 内NF-κB p65水平显著低于单独过表达lncRNA-GAS5的大鼠,且其水平接近模型组。表明lncRNA-GAS5/miR-21 ceRNA调控网络可能通过调节NF-κB信号通路激活调节HALI发生发展。
综上,lncRNA-GAS5/miR-21参与HALI发病过程,lncRNA-GAS5通过负调节miR-21表达,间接激活NF-κB通路,促发HALI。本研究明确了lncRNAGAS5/miR-21 ceRNA在HALI中的调控机制,可通过开发以lncRNA-GAS5或miR-21为靶点的药物为HALI防治提供新方法。

