ABCG2过表达促进HDAC泛抑制剂帕比司他治疗抵抗
窦永海,高晓丽
(1.天津市永久医院,天津 300450;2.天津市第五中心医院,天津 300450)
表观遗传修饰可在不改变脱氧核糖核酸(DNA)序列的情况下调节基因表达方面起着重要作用[1]。最近,许多证据表明,组蛋白的功能由各种类型的可逆修饰(如甲基化和乙酰化)调节,在遗传信息传递和肿瘤进展中至关重要。在这些修饰中,由组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)动态调控的组蛋白乙酰化修饰被认为是肿瘤治疗的有效靶点[2]。若干HDAC抑制剂已投入临床使用或正在开发中,其对HDAC同工酶的亲和力各不相同[3]。帕比司他是一种口服的泛HDAC抑制剂,在多种恶性肿瘤中显示出强大的活性,是目前已知的最强效HDAC抑制剂,目前已被FDA批准用于复发和难治性多发性骨髓瘤[4]。
临床证据表明,抗肿瘤药物的效力受到多药耐药性(MDR)的限制[5]。药效学和/或药代动力学耐药性可以进一步限制细胞毒性和靶向药物的效力[6]。分布在某些细胞的脂质筏中的ATP结合盒(ABC)转运体,可通过介导抗肿瘤药物外排,以减少药物在细胞内的蓄积而介导MDR的发生和发展[7]。ABC亚家族G成员Ⅱ(ABCG2,乳腺癌抗性蛋白/BCRP)是介导肿瘤细胞MDR发生发展的关键蛋白[8],可介导一系列蛋白激酶抑制剂的外排,并且与急性淋巴细胞白血病(ALL)和急性骨髓性白血病(AML)患者的耐药高度相关[9]。本研究主要探究ABCG2转运蛋白介导帕比司他在肿瘤细胞中耐药的机制。
1 资料(材料/对象)与方法
1.1 细胞及试剂 亲本细胞(NCI-H460、S1、HEK293/pcDNA3.1)及过表达ABCG2的肿瘤MDR细胞(NCI-H460/MX20、S1-M1-80、HEK293/ABCG2)均由美国St.John’s University的Zhe-Sheng Chen教授赠与。帕比司他(批号S1030)、Ko143(批号S7043)、依鲁替尼(批号S2680)、尼罗替尼(批号S5205)、拉帕替尼(批号S2111)、厄洛替尼(批号S1023)、紫杉醇(批号S1150)、阿霉素(批号S1208)以及顺铂(批号S1166)购置于美国Selleck公司。牛血清白蛋白(BSA)(批号37525)、特级胎牛血清(FBS)(批号10099)、二甲基亚砜(批号D5879)、DMEM基础培养基(批号2323405)、青/链霉素(批号30-001-CI)以及胰蛋白酶(批号25-051-CI)购置于美国Corning公司。PVDF膜(批号ISEQ00010)以及绿色荧光标记的Goat-anti-mouse IgG抗体(批号A-11029)购自美国Thermo Fisher Scientific公司。ABCG2单克隆抗体(批号GTX23380)购置于GeneTex公司,DAPI(批号D9542)、MTT(批号M2128)以及BCA蛋白定量试剂盒(批号71285-M)购置于美国Sigma公司。氚标米托蒽醌(批号301739)购置于美国Moravek公司。
1.2 仪器 细胞恒温CO2培养箱(HERAA cell 150i)以及超净工作台(C1112B)购置于美国Sigma公司。全自动酶标仪(I Mark)以及SDS-PAGE蛋白质电泳-转膜系统购买于美国Bio-Rad公司。低温冷冻离心机(5418R)购置于美国Eppendorf公司。倒置荧光显微镜(DMI 3000B)购置于瑞士Leica公司。液体闪烁分析仪(Tri Carb 2100TR)购置于美国Packard公司。
1.3 细胞培养 本研究利用的全部细胞均在含有10% FBS的DMEM培养基中,并于含有5%浓度的CO2培养箱以37℃的潮湿温度培养。NCI-H460/MX20(人非小细胞肺癌耐药细胞)以及S1-M1-80(人结直肠癌耐药细胞)为药物诱导的耐药细胞,在使用前需要加入相应的抗肿瘤药物维持其耐药性。具体方法为,在NCI-H460/MX20细胞中以20 nmol/L的米托蒽醌培养72 h,在S1-M1-80细胞中以80 μmol/L的米托蒽醌培养72 h,并更换无药物的完全培养基,培养并正常传代两周后使用。HEK293/ABCG2(人肾胚细胞)为稳定转染全长ABCG2编码区的带有G418抗性细胞,使用前采用2 mg/ml的G418筛选稳定细胞72 h后,更换无药物的完全培养基,培养并正常传代两周后使用。
1.4 基于MTT法的细胞增殖检测及逆转实验 显微镜下观察处于对数生长期状态良好的细胞,PBS进行清洗,然后加入0.25%胰酶进行消化(37℃培养箱),消化时间根据细胞特点有些许差别,消化完成后制备单细胞悬液,并利用血球计数板计数,规定细胞密度为3×104个/ml,根据细胞实际浓度吸取特定体积的细胞悬液,并加入一定体积的培基,吸管吹打混合均匀,吸取200 μl液体加入到96孔板中,并设置空白对照,即不含细胞悬液的培基,并将边缘孔用PBS填充,细胞铺板完成后轻轻拍打培养板使细胞悬液均匀分布在孔中,于倒置光学显微镜下观察细胞铺板密度和细胞状态,将培养板置于37℃、5%CO2培养箱中过夜稳定培养使细胞贴壁。细胞贴壁后,加入按浓度梯度配置好的PBST,以DMSO处理组为对照组,培养72 h。给药培养72 h后,给药组和对照组每个孔加20 μl MTT溶液,培养4 h。经过4 h孵育,从培养箱中取出培养板,用负压泵吸去上清液,移液枪吸取100 μl DMSO加入到孔中,并放置于摇床上震荡混合,使甲瓒充分溶解,溶液呈透明色即可于酶标仪490 nm处检测OD值。采用Graphpad 7.00软件计算药物对细胞的半数抑制浓度。针对逆转实验,按照上述体系,将特定浓度的逆转药物加入96孔板中,于培养箱中孵育2 h,并按照上述步骤进行后续处理。
1.5 Western blot法评价ABCG2蛋白表达水平 取对数生长期的NCI-H460/MX20细胞,消化并计数,并以2×104个/孔的浓度接种于6孔板,转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的帕比司他,使其在NCI-H460/MX20细胞药物终浓度为100 nmol/L,加药处理不同时间(24、48以及72 h)。处理完成后,取出细胞培养板,将细胞从培养皿底部刮下来,吸管吸取含有细胞的培养液加入到1.5 ml EP管中,放置于低温离心机中进行离心,并采用冰PBS洗涤细胞,清洗1~2次。将提前配好的细胞裂解液(RAPA∶Cocktail A∶Cocktail B=100∶1∶1)加入到细胞沉淀中裂解细胞,收集裂解组分于离心管中,以14 000 g转速离心15 min,取上清液为总蛋白提取液。采用BCA法进行蛋白定量,按一定比例混匀蛋白原液和超纯水,使上样蛋白量为20 μg,并加入5×SDS上样缓冲液。在95℃水浴中孵育样品10 min使其变性。根据比例配制凝胶,待胶凝后向孔中加入制备好的蛋白样品和预染marker,进行电泳。电泳完成后,进行转膜,设置转膜条件:电流200 mA,电转2.5 h。结束后,将PVDF膜放在提前用1×TBST缓冲溶液配置好的5%的脱脂牛奶中,于室温置于低速摇床1 h。牛奶封闭结束。按照抗体说明书配置适当浓度的一抗(抗ABCG2,1∶1 000;抗GAPDH,1∶1 000)。将膜放入杂交带中,加入一抗稀释液,封口机封口。放在4℃摇床上,慢摇孵育过夜。一抗孵育结束后,一抗进行回收,使用TBST缓冲液清洗PVDF膜2~3次,每次5 min。孵育二抗1 h(HRP兔抗,1∶2 000),使用TBST缓冲液清洗PVDF膜2~3次,每次5 min。配置ECL显影液(A液∶B液=1∶1),将配置好的发光显影液(ECL)均匀加到目的蛋白条带上进行显影拍照。
1.6 免疫荧光法评价ABCG2质膜定位 取处于对数生长周期的NCI-H460/MX20细胞,消化并计数,并以2×104个/孔的浓度接种于6孔板,转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的帕比司他,使细胞药物终浓度为100 nmol/L,加药处理不同时间(24、48以及72 h)。实验同时设置阴性对照组(亲本细胞)和模型组(经DMSO处理的耐药细胞)。作用完成后,采用4%多聚甲醛作为固定液,吸取一定体积加入到孔中,固定时间为30 min。固定结束之后,弃去多聚甲醛溶液,用冰PBS洗涤两次。然后采用0.25%的Triton X-100溶液进行透化,透化时间为5 min,再用PBS清洗液清洗2次。加入5% BSA,在37℃孵箱中进行封闭,时间为1 h。封闭结束之后,加入一定体积按照抗体说明书使用5% BSA配置的一抗稀释液(抗ABCG2,1∶1 000),于37℃培养箱中孵育1 h并用PBS进行清洗。然后孵育二抗(绿色荧光标记的Goat-anti-mouse IgG,1∶500)。利用抗荧光猝灭封片剂覆盖板中细胞,并置于倒置荧光显微镜下观察成像。
1.7 以氚标米托蒽醌为探针评价药物蓄积水平 取处于对数生长周期的细胞,消化,计数,并接种于6孔板中(2×104个/孔),转移到培养箱中过夜稳定培养。细胞贴壁后,每孔加入2 μl的帕比司他,使细胞药物终浓度分别为3 μmol/L和6 μmol/L,加药处理不同时间(24、48以及72 h)。实验同时设置加ABCB2特异性逆转剂(Ko 143)阳性对照组,加药处理2 h。2 h后,向孔中加入氚标米托蒽醌,使其终浓度为10 μmol/L,继续处理2 h,然后使用PBS清洗氚标抗肿瘤药物。同时进行细胞消化操作,收集细胞转移到液体闪烁计数瓶中,根据液体闪烁计数仪的数值确定药物的蓄积能力。
1.8 ATPase活性实验ATP酶检测缓冲系统中分别加入经过预制的ABCG2膜囊泡[10](总量为10 μg),其中PC组加入0.3 mmol/L的钒酸酯,调整反应温度为37℃,作用时间为4 min。加入Mg-ATP(5 mmol/L)促使反应的开始,调整帕比司他的浓度,范围在0~40 μmol/L。调整反应温度为37℃,作用时间为25 min,加入5% SDS终止反应液使反应停止。于酶标仪600 nm处测量最大吸收OD值绘制相关酶活曲线,ATP酶反应活性为游离的磷酸。
1.9 计算机辅助分子对接评价PBST与ABCG2的潜在结合位点 利用ChemBioDraw Ultra 14.0和AutodockTools软件评价PBST与ABCG2底物结合空腔的结合。首先导入PBST的分子结构,使用Chem-Bio3D Ultra 14.0模块转换结构,使其最终为三维结构,并利用MMFF94将力场优化。ABCG2的三维结构(PDB ID:6ETI)从RCSB Protein Data Bank(www.rcsb.org)下载得到。ABCG2和帕比司他均使用Autodock-Tools 1.5.6转化为PDBQT格式。分子对接部分,采用Autodock vina 1.1.2软件进行。根据ABCG2原配体的位置,确定ABCG2活性位点的坐标为:X-144.124、Y-137.956、Z-145.139。调整参数exhaustiveness的值为20。对接结束后,根据评分结果选取打分值最高的构象,并利用Free Meastro 11.9对结果进行分析。
1.10 统计学方法 采用SPSS 22.0软件进行统计学处理。计量资料结果以±s表示,采用单因素方差分析进行多组间比较,采用LSD-t法进行多重比较,采用用χ2检验进行组间比较。P<0.05为具有统计学意义。
2 结果
2.1 ABCG2过表达细胞对帕比司他耐药 首先,利用MTT法评价帕比司他在亲本细胞以及过表达ABCG2的肿瘤MDR细胞中的增殖抑制活性差异。如图1A所示,在亲本细胞NCI-H460细胞中,帕比司他的IC50值为0.031 μmol/L,仅为其在过表达ABCG2的NCI-H460/MX20细胞中的1/10;同时,在亲本细胞S1以及耐药细胞S1-M1-80中,帕比司他的抗肿瘤活性同样存在显著差异,IC50值分别为0.027以及0.605 μmol/L(图1B),提示ABCG2可能是介导帕比司他耐药的关键蛋白。为了验证ABCG2在帕比司他耐药中的重要作用,本研究评价了过表达外源性ABCG2的HEK293细胞对帕比司他抗肿瘤活性的敏感性变化。结果表明,帕比司他在亲本细胞HEK293/pcDNA3.1中的抗肿瘤活性显著低于过表达外源性ABCG2的HEK293细胞(HEK293/ABCG2),提示ABCG2的过表达可介导帕比司他耐药(图1C)。
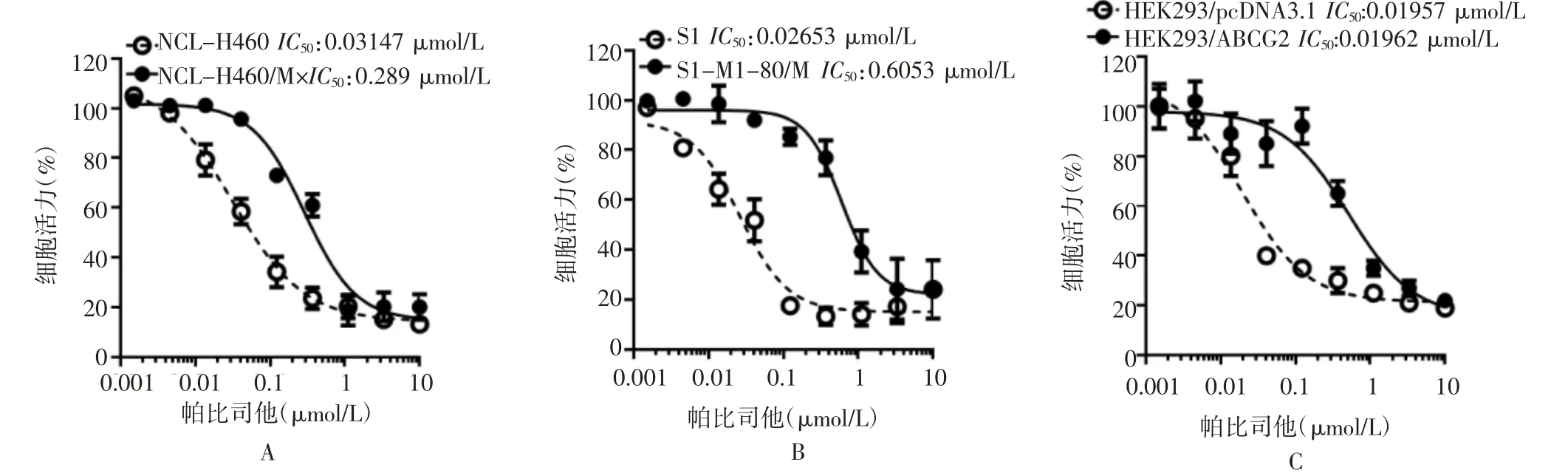
图1 帕比司他对亲本细胞和ABCG2过表达的肿瘤细胞的增殖抑制活性差异
2.2 已报道的ABCG2逆转药物可逆转帕比司他耐药 为了进一步明确ABCG2介导帕比司他耐药的作用,笔者在过表达ABCG2的肿瘤细胞中以帕比司他联合应用已报道的ABCG2逆转药物,评价肿瘤细胞活力。如图2A所示,已知的ABCG2逆转药物Ko143(10 μmol/L)、依鲁替尼(5 μmol/L)、尼罗替尼(5 μmol/L)、拉帕替尼(5 μmol/L),以及厄洛替尼(5 μmol/L)可显著降低帕比司他对NCI-H460/MX20细胞的IC50值(n=3,F=197,P<0.05),但不显著影响帕比司他对NCI-H460细胞的敏感性(n=3,F=1.031,P=0.312);此外,在S1-M1-80细胞(ABCG2过表达)中,Ko143等ABCG2抑制剂亦可逆转帕比司他耐药(n=3,F=132,P<0.05),同时不显著影响帕比司他在亲本细胞S1中的抗肿瘤活性(n=3,F=0.823,P=0.292)。
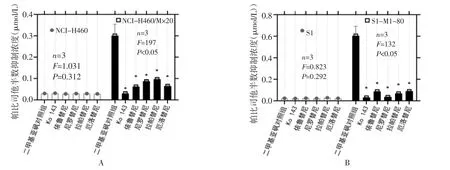
图2 ABCG2抑制剂可逆转帕比司他耐药
2.3 帕比司他上调ABCG2蛋白表达水平,但对其质膜定位无影响 在低浓度帕比司他处理NCI-H460/MX20细胞后,NCI-H460/MX20细胞中ABCG2的蛋白表达水平较对照组显著上调(图3A),提示帕比司他极有可能是通过上调ABCG2蛋白表达水平从而增强药物外排作用的。然而,如图3B所示,帕比司他并不明显改变ABCG2的质膜定位水平,提示帕比司他并不是通过改变ABCG2质膜定位协同增强其耐药作用。
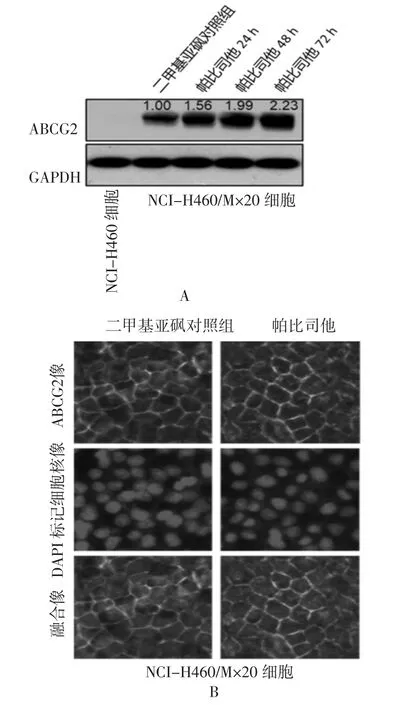
图3 帕比司他上调ABCG2蛋白表达但不改变质膜定位
2.4 帕比司他上调化疗药物在ABCG2过表达肿瘤细胞中的蓄积水平 本阶段研究以氚标抗肿瘤药物[3H]-米托蒽醌为探针,评价帕比司他对[3H]-米托蒽醌在亲本细胞及ABCG2过表达的耐药细胞中蓄积水平的差异。结果表明,不同浓度的帕比司他并不显著改变[3H]-米托蒽醌在亲本细胞NCI-H460中的蓄积水平(图4A);然而,在过表达ABCG2的耐药细胞NCI-H460/MX20中,帕比司他可显著上调[3H]-米托蒽醌的胞内蓄积水平,并呈现一定的剂量依赖性特征,且上调程度接近于阳性对照-ABCG2抑制剂ko143(图4B)。本结果提示帕比司他极有可能通过与米托蒽醌竞争性结合ABCG2的底物结合活性位点,从而竞争性抑制米托蒽醌的外排,即帕比司他可能呈现为ABCG2的特异性底物特征,从而可被过表达ABCG2的肿瘤细胞逆浓度梯度外排至胞外。

图4 帕比司他上调过表达ABCG2的耐药细胞中氚标米托蒽醌的蓄积水平
2.5 帕比司他上调ABCG2的ATP酶活性,并与ABCG2底物结合口袋的氨基酸残基发生相互作用ATP水解过程可为ABCG2转运体提供能量,以运输各种内源配体和外源药物。为了进一步评估帕比司他对ABCG2功能的影响,在不同浓度的帕比司他作用下,笔者对从转运体高表达昆虫细胞获得的膜蛋白中ABCG2的钒酸盐敏感ATP酶活性进行评价。结果表明,帕比司他在10 μmol/L范围内对ABCG2转运体显示出浓度依赖性的激活作用(图5)。为了进一步探究帕比司他与人源ABCG2蛋白质底物结合空腔的潜在相互作用,笔者利用计算机分子对接技术模拟帕比司他与ABCG2的对接情况。ABCG2(PDB ID1:6ETI)与帕比司他的结合位点之间的整体相互作用如图6A和6B所示。结果表明,帕比司他与ABCG2获得了较好的结合得分,结合能力为-10.3 kcal/mol。此外,帕比司他通过氢键和π-π相互作用在ABCG2的底物结合口袋内的氨基酸残基ASN436、THR436以及PHE439形成相互作用。上述结果表明,帕比司他可以底物形式与ABCG2的底物结合空腔发生相互作用。
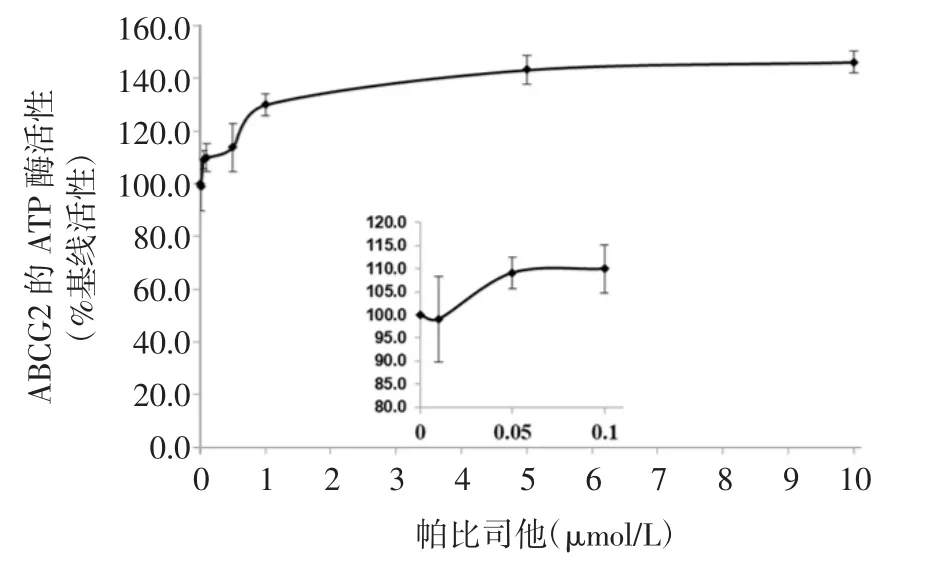
图5 帕比司他上调ABCG2的ATP酶活性
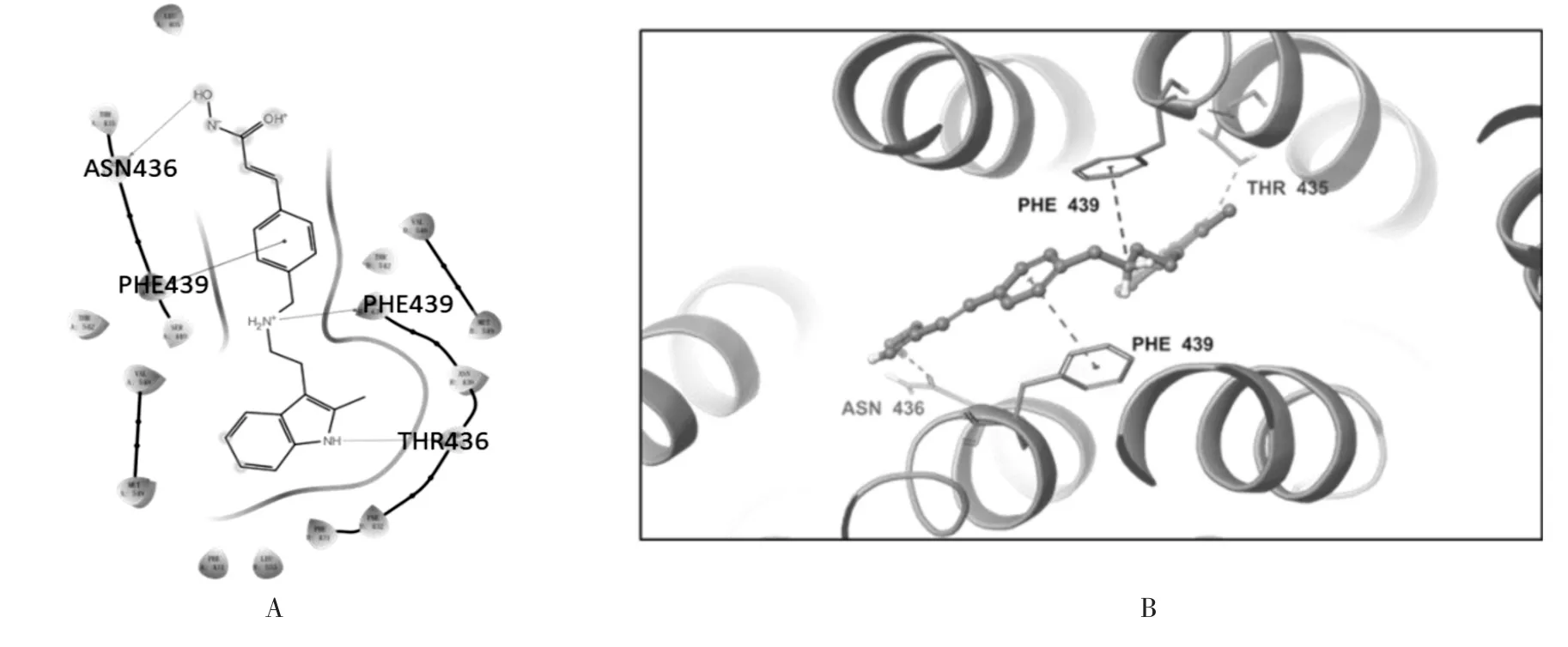
图6 帕比司他和ABCG2底物结合口袋的部分氨基酸发生相互作用
3 讨论
HDAC活性失调是包括多发性骨髓瘤在内的多种恶性肿瘤的重要表观遗传学特征之一[11],HDAC也因此被认为是恶性肿瘤的重要表观遗传学靶点。近年来,开发针对HDAC活性的新型抑制剂是靶向药物开发的一个重要领域[12]。帕比司他是一种非选择性口服组蛋白去乙酰化酶(HDAC)抑制剂,是目前已知的体外活性最强的HDAC抑制分子。2015年,FDA批准帕比司他用于复发/难治性多发性骨髓瘤[13]。与此同时,帕比司他也在多种血液和实体肿瘤的联合治疗中表现出较好的应用前景,大量的临床试验相继开展,如帕比司他与比卡鲁胺联合可缓解趋势抵抗前列腺癌对比卡鲁胺的耐药[14];帕比司他联合利妥昔单抗可使部分弥漫性大B淋巴瘤患者临床获益等[15]。尽管如此,但临床上针对帕比司他的潜在治疗抵抗机制尚未充分阐明,这给帕比司他的进一步单药临床应用带来了巨大的挑战。有研究表明,在外周T细胞淋巴瘤中,肿瘤细胞固有凋亡信号转导途径在介导帕比司他耐药方面扮演重要角色,通过与抗凋亡因子的抑制作用相结合,可进一步提高肿瘤细胞对帕比司他治疗的敏感性[16]。此外,骨髓瘤细胞中mTOR-CXCR4途径的过度活化可促进其对帕比司他的治疗抵抗,而帕比司他与依维莫司联合引用将极大程度上缓解骨髓瘤细胞对帕比司他的耐药[17]。遗憾的是,迄今为止尚无相关研究明确ABC转运蛋白家族在帕比司他耐药过程中扮演的关键角色。
作为一种膜蛋白,ABC转运蛋白可以利用ATP水解产生的能量将多种化学物质(包括大部分药物)从胞内逆浓度梯度泵出胞外。因此,一种或多种ABC转运蛋白在肿瘤细胞中的过度表达可以显著降低功能和结构不相关的化疗药物的疗效,导致肿瘤细胞出现多药耐药(MDR)表型。在众多与肿瘤MDR表型相关的ABC转运蛋白亚型中,ABCB1和ABCG2是目前有证据支持其在临床耐药性中发挥作用的两种ABC转运蛋白。在药效学角度,ABCB1和ABCG2可以赋予一些最广泛使用的常规抗肿瘤药物以抗性,如蒽环类药物、甲氨蝶呤、拓扑替康、SN-38、长春花生物碱以及许多蛋白激酶抑制剂。此外,ABCB1和ABCG2在形成血液-组织屏障部位的细胞中的高表达可以对大多数药物在患者体内的口服生物利用度、分布、代谢和消除产生重大影响。更重要的是,ABCG2亚型与多发性骨髓瘤的耐药高度相关。临床研究表明,ABCG2在人类骨髓瘤细胞中原发表达,并且其表达水平可通过其启动子的甲基化和化疗药物的处理得以强化,进一步促进MDR的发生[18]。此外,也有大量研究表明,诸如部分microRNA和部分信号转导通路参与到ABCG2的蛋白表达中,促进多发性骨髓瘤的治疗抵抗[19]。因此,阐明ABCG2对于抗多发性骨髓瘤药物的影响,对药物上市后的临床再评价以及联合用药策略的开发具有重要意义。
在本研究中,笔者初步发现帕比司他对过表达ABCG2的肿瘤细胞的增殖抑制活性显著低于亲本细胞,提示ABCG2极有可能是参与帕比司他耐药的关键机制。为了进一步明确ABCG2对于帕比司他耐药的特异性作用,笔者利用了转染ABCG2全长基因的HEK293细胞验证上述假设,并且得到了一致结论。迄今已有大量研究报道ABCG2的高效抑制剂,笔者利用无毒性浓度的部分ABCG2抑制剂与帕比司他联合应用,评价帕比司他的增殖抑制活性变化。结果表明,包括Ko143在内的一系列ABCG2抑制剂均可不同程度上逆转帕比司他在ABCG2过表达肿瘤细胞中的耐药现象。上述结果明确了ABCG2是介导帕比司他耐药的关键蛋白。
ABCG2在肿瘤细胞中的原发表达可介导帕比司他耐药,而帕比司他应用后是否会进一步影响ABCG2的表达水平,进一步诱导耐药的进展?在以低浓度帕比司他处理NCI-H460/MX20细胞后,ABCG2的蛋白表达水平呈剂量依赖性地上调,但帕比司他并不影响ABCG2蛋白的质膜定位,提示帕比司他是通过提高ABCG2的蛋白表达水平从而推动耐药的发生和发展。有研究表明,部分化疗药物可刺激ABC转运蛋白家族启动子区域的元件从而诱导ABC转运蛋白的转录激活[20];此外,部分药物可能影响泛素-蛋白酶体降解系统的功能,从翻译后修饰水平抑制ABC转运蛋白的降解,上调其表达水平[21]。本研究尚未明确帕比司他是否通过上述途径提高ABCG2的蛋白表达水平,这是本研究的不足之处。
在针对ABCG2介导帕比司他耐药的机制研究部分,还同时发现ABCG2可介导帕比司他在肿瘤细胞中的蓄积水平的变化。本部分研究以氚标米托蒽醌为探针,间接探究帕比司他在过表达ABCG2的肿瘤细胞中蓄积水平的改变。结果表明,帕比司他可显著上调氚标米托蒽醌在ABCG2高表达肿瘤细胞中的蓄积水平,且与阳性对照药物Ko143水平相当,提示帕比司他可能为ABCG2的良好底物。此外,帕比司他显著上调ABCG2的ATP酶活性,并且在计算机辅助分子对接中,帕比司他分子可以与ABCG2蛋白底物结合空腔的部分氨基酸残基发生相互作用,提示ABCG2可以将帕比司他特异性地泵出胞外,促进帕比司他的耐药发生和发展。
帕比司他作为迄今为止最强效的HDAC非选择性抑制剂,目前已被FDA批准多发性骨髓瘤的二线用药,并且在多种血液肿瘤和实体瘤的临床试验中表现良好。但其耐药现象仍是其进一步应用的巨大障碍。本研究明确了ABCG2是介导帕比司他耐药发生发展的关键蛋白。基于本研究的发现,将为帕比司他的联合用药提供基本的思路,即帕比司他联合ABCG2抑制剂(或有ABCG2抑制活性的分子)可能会为帕比司他临床效果的提高有关键作用。诚然,该假设仍需要更多的体内和临床试验进一步验证。

