运动对血管钙化的调控及其分子机制的研究进展
徐港港 ,马春莲 ,2,3*,杨 翼 ,2,3
(1.武汉体育学院 健康科学学院,湖北 武汉 430079;2.武汉体育学院 体质监测与慢病干预研究中心,湖北 武汉 430079;3.武汉体育学院 运动训练监控湖北省重点实验室,湖北 武汉 430079)
世界卫生组织(World Health Organization,WHO)2021年统计数据显示,全球约有4 100万人死于非传染性疾病,而因糖尿病心血管并发症、动脉粥样硬化、高血压等心血管疾病死亡的约有1 790万人,占非传染性疾病总死亡人数的44%。血管钙化是动脉粥样硬化、高血压、糖尿病等疾病常见的病理表现。临床研究发现,动脉钙化的发病率随年龄的增加而增加,70岁以上的男性和女性动脉钙化的发生率分别是90%和67%(Liu et al.,2015)。羟基磷灰石在血管壁中大量堆积是导致血管钙化发生的主要原因。有证据显示,血管平滑肌细胞(vascular smooth muscle cell,VSMCs)、内皮细胞(endothelial cell,ECs)、干/祖细胞等直接或间接参与调控了羟基磷灰石的沉积,在血管钙化的发生中发挥了关键作用(周子皓等,2020)。
久坐以及不良的饮食习惯是引发血管钙化及其他心血管疾病的重要危险因素。规律运动在促进心血管健康,降低心血管疾病死亡率方面具有重要作用。研究表明,运动能有效调节血压、血糖及血脂指数,降低心血管发病风险(Aengevaeren et al.,2020)。前期研究显示,运动能改善动脉粥样硬化和血管钙化(王帝之等,2019)。然而,血管钙化的发生与发展是由多种细胞广泛参与的复杂过程。运动对血管钙化的调控及其潜在的分子机制尚不清楚。因此,本文论述了血管钙化的形成,总结了运动对血管钙化的调控作用及其分子机制,凝练出了预防和辅助治疗血管钙化的运动方案。
1 血管钙化的发生
血管钙化是由多种因素诱导羟基磷灰石堆积于血管壁的病理现象。根据钙化发生的部位可分为内膜钙化和中膜钙化,前者主要发生于动脉粥样硬化,影响斑块的稳定性(Durham et al.,2018);后者多发生于慢性肾病和糖尿病,引发动脉壁硬化,降低血管顺应性,促进血压升高(Mizobuchi et al.,2009)。血管平滑肌细胞、内皮细胞以及干/祖细胞等广泛参与了血管钙化发生发展的调控(图1)。

图1 血管钙化的发生Figure 1. Occurrence of Vascular Calcification
1.1 平滑肌细胞与血管钙化的形成
平滑肌细胞是构成血管中膜的主要细胞类型,作为非终末细胞表现为收缩型、成骨型和合成型等不同表型。在正常情况下VSMCs表现为收缩型,收缩产生压力来维持正常的血压。在高糖、炎症刺激等异常情况下,VSMCs会从收缩型向成骨型转换,使收缩型特异蛋白平滑肌22α(smooth muscle 22α,SM22α)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等表达下降,而骨形态发生蛋白(bone morphogenetic protein,BMP)、runt相关转录因子 2(runt related transcription factor 2,Runx2)、骨钙素(osteocalcin,OCN)等成骨型特异蛋白表达上升(Leopold,2015)。有证据表明,VSMCs的表型转换与血管钙化的发生密切相关。研究发现,氧化应激发生时线粒体释放大量活性氧(reactive oxygen species,ROS)把低密度脂蛋白(low density lipoprotein,LDL)氧化为氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)并堆积于血管壁,诱发VSMCs由收缩型向成骨型转换,进而引发血管钙化(Kattoor et al.,2017)。在动脉粥样硬化、糖尿病等疾病中,炎症因子如肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)以及ROS会促进ox-LDL的增加,使VSMCs的Runx2、OCN、碱性磷酸酶(alkaline phosphatase,ALP)表达显著上调(Boström et al.,2011),提示VSMCs的表型转换是血管钙化发展中的关键步骤。
基质Gla蛋白(matrix Gla protein,MGP)是一种主要由VSMCs分泌的维生素K依赖的蛋白,被认为是天然钙化抑制因子。正常情况下,VSMCs分泌的基质囊泡中包含MGP,能够抑制血管钙化(Barrett et al.,2018)。细胞研究发现,在钙化诱导的VSMCs分泌的基质囊泡中MGP缺乏,而钙化促进因子基质金属蛋白酶2(matrix metalloproteinases 2,MMP2)活性增强,进一步研究发现钙化诱导的VSMCs分泌的基质囊泡会诱发细胞内钙稳态失衡,从而使血管发生钙化(Kapustin et al.,2011)。衰老也是血管钙化的重要影响因素,研究发现伴随血管的衰老,血管中MGP的表达下降,而骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)、骨保护素(osteoprotegerin,OPG)、骨桥蛋白(osteopontin,OPN)等表达增加,这些VSMCs成骨型特异蛋白的表达增加又会进一步加重血管钙化(Bjørklund et al.,2020)。
外泌体是一类由多种细胞分泌的可在细胞和组织间发挥重要调控和信号转导作用的细胞外囊泡(extracellular vesicles,EVs)。近期研究发现,VSMCs可通过外泌体调控血管钙化(Qin et al.,2021)。有报道称,钙化血管来源的外泌体中MGP含量降低,羟基磷灰石含量升高(Kapustin et al.,2015),而将钙化血管中VSMCs来源的外泌体和正常VSMCs共培养可以诱导正常VSMCs向成骨型分化(Pan et al.,2020)。与此类似,将高糖培养的ECs来源外泌体用于VSMCs的共培养,除引发线粒体功能障碍外也会诱导VSMCs向成骨型转换(Li et al.,2019)。动脉粥样硬化的研究也发现,在硬化斑块纤维帽的微钙化灶内也存在钙化的外泌体(Kelly-Arnold et al.,2013)。此外,有证据表明,外泌体中存在许多微小RNA(microRNA,miRNA)。在生理及病理情况下,miRNA可通过上调Runx2的表达和激活Wnt/β-catenin信号通路来调控VSMCs的表型转换从而调节血管钙化(Zhang et al.,2018)。
1.2 内皮细胞与血管钙化的形成
ECs是构成血管壁内膜的单层细胞,参与调控血压、血管再生,维持血管稳态。当内皮功能失调时会引发氧化应激加强、炎症反应、血栓形成,刺激血管引发血管钙化。类似于VSMCs,ECs也具有多向分化潜能。当血管内钙化抑制因子和促进因子调控失衡时,ECs会发生内皮-间充质转化(endothelial-to-mesenchymal transition,EndMT),失去内皮细胞特征并逐渐向间充质细胞和成纤维细胞转变,导致黏附能力下降,而侵袭、迁移能力增强。多种小鼠模型的研究证据表明,在血管钙化中存在内皮功能障碍和EndMT,提示EndMT参与了血管钙化的调控(Zhang et al.,2021)。在MGP敲除的小鼠模型中发现,由于MGP的缺乏降低了对钙化促进因子BMP的抑制,进而使BMP活化增强并引发EndMT的发生,最终导致动脉粥样硬化和血管钙化(Yao et al.,2015)。Boström等(2016)对高脂肪高胆固醇喂养的ApoE转基因小鼠的研究发现,EndMT促进了动脉粥样硬化向血管钙化的转变。有证据显示,TNF-α和白介素-1β(interleukin-1β,IL-1β)等炎症因子可通过下调骨形态发生蛋白受体2(bone morphogenetic protein receptor 2,BMPR2)的表达来促进EndMT的发生,进而上调骨形态发生蛋白9(bone morphogenetic protein 9,BMP-9)的表达进一步诱导血管钙化(Sanchez-Duffhues et al.,2019)。
微囊泡是细胞和组织间物质转运及信息传递的重要载体。ECs产生的微囊泡(endothelial microparticles,EMPs)在血管钙化中也发挥了重要的调控作用,如运输BMP-2和Ca,诱导血管钙化。研究发现,用TNF-α刺激ECs会导致BMP-2表达增加和EMPs的分泌增强,深入研究发现这些EMPs中包含大量BMP-2,通过EMPs转运到VSMCs调控其向成骨型分化和促进血管钙化(Buendia et al.,2015)。血小板衍生生长因子(platelet derived growth factor,PDGF)是贮存于血小板α颗粒中的一种碱性蛋白质。在炎症刺激下,ECs会分泌包含大量miRNA的EVs,靶向血管周围细胞,通过上调PDGF的表达诱导VSMCs增殖、迁移及向成骨型转换,促进血管炎症并加速血管钙化(Ouyang et al.,2018)。将自发性高血压大鼠血管来源的ECs与正常大鼠血管来源的VSMCs共培养,结果发现6天后VSMCs中钙沉积及ALP活性显著升高,深入研究发现高血压状态下ECs通过上调MMP-2和基质金属蛋白酶9(matrix metalloproteinases 9,MMP-9)促进了血管钙化(Meng et al.,2018)。
1.3 干/祖细胞与血管钙化的形成
干细胞是具有多向分化潜能的细胞。在体内的骨髓、外周血、脑、血管壁等组织有适合干/祖细胞存在的特定环境,这种特定环境被称为干/祖细胞“生态位”。在血管壁中 ,平 滑 肌 祖 细 胞(smooth muscle progenitor cells,SMPCs)、内皮祖细胞(endothelial progenitor cells,EPCs)、造血干细胞(hematopoietic stem cells,HSCs)和间充质干细胞(mesenchymal stem cells,MSCs)驻留或迁移至血管内皮下区和血管外膜区,通过储存、释放和回收多种细胞因子来调节血管壁内稳态(Yu et al.,2018)。有证据表明,血管常驻的SMPCs、EPCs、MSCs以及循环的HSCs在调节VSMCs表型转换、新内膜生成、血管内皮修复及再内皮化、炎症反应、血管骨化和矿化中扮演了重要角色(Leszczynska et al.,2018)。研究发现,在血管壁中存在一些细胞表达Sca-1、c-kit、CD34、CD90等干细胞的标志物以及CD73、CD45等间充质干细胞的标志物,这些细胞具有很高的向成骨细胞或破骨细胞分化的潜能,能促进动脉粥样硬化中钙化斑块的发展(Yu et al.,2018)。内皮的功能完整性对于防止血管钙化发展至关重要,EPCs可促进受损内皮再生,维持血管完整性,而EPCs数量的下降可增加动脉粥样硬化(Leszczynska et al.,2018)。伴随血管衰老,基质细胞会产生过量的ROS,从而引发HSCs的衰老和EPCs的分化障碍(Yu et al.,2018),诱发动脉粥样硬化和血管钙化。MSCs是一种具有很强可塑性的干细胞,在不同条件下能分化为成骨细胞、软骨细胞和肌细胞等多种细胞类型。在炎症和氧化应激导致血管损伤后,转化生长因子 β1(transforming growth factor β1,TGF-β 1)、基质细胞衍生因子 1(stromal cell derived factor-1,SDF-1)、PDGF等因子的激活可诱导骨髓来源MSCs迁移到受损血管壁,上调血管中OCN的表达,促进成骨细胞生成并诱导主动脉钙化(Wang et al.,2014)。将MSCs与ECs或软骨细胞共培养,可提高细胞ALP的活性,促进成骨细胞和血管生成(Freeman et al.,2016)。此外,相较于正常小鼠,动脉粥样硬化小鼠来源的MSCs显示出更高的骨化能力(Leszczynska et al.,2016),提示异常的环境刺激可促使MSCs发生骨化而引发血管钙化。
2 运动对血管钙化的调控
作为一种非药物手段,运动在防治慢性疾病、降低死亡率、促进心血管健康、提高生活质量方面日益受到关注。心血管的相关研究发现,血脂异常会引起动脉血管内膜形成粥样斑块诱发血管损伤。运动可以提高血浆中高密度脂蛋白(high density lipoprotein,HDL)水平,降低LDL和甘油三酯水平,减少脂质在血管内膜下层聚集,降低动脉粥样硬化风险(王帝之等,2019;Muscella et al.,2020)。运动还能使病理状态下异常的血压、血糖、血脂水平趋于正常,稳定血管功能状态(王潆等,2021)。研究发现,规律运动还能降低动脉粥样硬化斑块的大小,缓解血管的炎症反应(Yang et al.,2017),从而有效抑制斑块钙化灶的形成,缓解血管钙化。运动还可以增加动脉粥样硬化斑块中胶原蛋白、弹性蛋白含量以及斑块纤维帽厚度,减少脂质并增强斑块的稳定性(Fiuza-Luces et al.,2018)。
2.1 有氧耐力运动对血管钙化的调控


身体活动水平是影响运动与动脉粥样硬化的重要原因。值得注意的是,有报道称在低水平的身体活动中,运动与动脉粥样硬化呈负相关(Delaney et al.,2013);在高水平的身体活动中,运动与动脉粥样硬化呈正相关(Laddu et al.,2017)。在专业运动员中冠状动脉钙化和动脉粥样硬化斑块的患病率比一般人高,高强度运动员比非高强度运动员高(Aengevaeren et al.,2020)。经历过高强度、高运动量耐力训练的中老年运动员,冠状动脉钙化指数和心肌纤维化的发生率比一般人高(Parry-williams et al.,2021)。但目前并没有直接证据证明高水平耐力运动员发生心血管事件的概率比低水平运动员高,所以高水平耐力运动易引发血管钙化的结果令人困惑。近期对硬化斑块的形态学研究为解除这一困惑提供了线索。研究发现,在耐力运动员动脉中最易导致心血管事件发生并产生最差预后的混合斑块较少,而与最佳无事故生存相关的钙化斑块较多(Aengevaeren et al.,2020)。更值得注意的是,他汀类是治疗动脉硬化的常用药物,在降低动脉粥样硬化斑块体积和心血管风险的同时,也会促进斑块钙化。高水平耐力运动应该是如他汀类药物那样产生了促进动脉粥样斑块钙化的效果,使斑块更加稳定而不至于破裂产生心血管事件,是一种运动性的适应。太极拳是以有氧运动为主的中国传统项目。Mori等(2020)研究发现,6个月的太极拳运动(60 min/次,3次/周)除能降低老年人体质量、腰围外,还能使心踝血管指数(cardio-ankle vascular index,CAVI)从基础状态的8.44显著降到8.20,显示出太极拳降低中心动脉硬度的良好效应。然而,当运动频率从3次/周降到2次/周后,太极拳改善老年人体成分的有益作用虽然存在,而降低血管硬度的显著效应却消失了(Mori et al.,2020),提示运动频率是运动调节血管硬度,改善血管顺应性的重要参数,需达到至少3次/周才能起到较好的干预效果。
2.2 力量训练对血管钙化的调控

Maeda等(2006)研究了下肢力量训练与血管钙化的关系,发现老年男性[(64±1)岁]以60(°)/s的速度进行12周双侧膝关节等速屈、伸运动后(100%1RM,10次/组,3组,2次/周),下肢肌肉力量和血清一氧化氮(NO)水平显著升高,而主动脉PWV(aortic PWV,aPWV)未发生显著改变,说明下肢的抗阻力量训练没有增加中心动脉钙化,这与Cortez-Cooper等研究的抗阻运动增加中心动脉钙化的结果出现分歧。上肢和下肢抗阻力量训练对血管钙化影响的对比研究似乎为这一分歧提供了答案。以70%1RM的负荷进行一次性上肢或下肢的抗阻运动(上肢为背阔肌下拉和卧推,下肢为大腿的屈伸运动,8次/组,4组,2次/周),结果发现上肢抗阻运动后主动脉增强压(augmentation pressure,AP)、AIx、75次心率校正增强指数(augmentation index normalized to 75 bpm,AIx75)显著增加,而下肢抗阻运动后主动脉反射波传输时间显著降低(Tai et al.,2021),说明相比于上肢,下肢的抗阻运动对动脉硬度、脉搏反射的不利影响更小。综合以上研究可见对于缓解血管钙化和动脉硬化来说抗阻力量训练并不是一个很好的运动形式,尤其是长期上肢以及全身的抗阻力量训练还可能增加动脉钙化。
2.3 高强度间歇训练对血管钙化的调控


2.4 拉伸训练对血管钙化的调控
绝经后的久坐肥胖女性[(57±1)岁,BMI>30 kg/m]进行全身大肌群拉伸训练(最大关节运动角度拉伸30 s,放松15 s,2次/组,1组,3次/周),运动使满分为20分的RPE>18。结果发现,8周的拉伸训练能显著降低肱动脉收缩压、主动脉收缩压、平均动脉压、主动脉舒张压、主动脉AIx,但未能使心率、baPWV、aPWV和faPWV发生显著变化(Wong et al.,2014)。中老年久坐者(40~80岁)进行13周全身大肌群的拉伸训练(最大关节运动角度拉伸20 s,重复3次,30~45 min,3次/周),结果发现拉伸运动后颈动脉血压从(46±4)mmHg显著降低到(40±3)mmHg,血管顺应性显著增加了23%,肱动脉收缩压,平均动脉压、脉压、颈动脉舒张压虽没有发生显著变化但有降低趋势(Cortez-Cooper et al.,2008)。以上研究中由于受试者年龄、拉伸时间的不同使拉伸训练对血管功能各参数的影响不同,但总体上长期拉伸训练对降低血管钙化,提高顺应性方面发挥了积极作用。新近研究发现,一次性躯干被动静态拉伸也能降低血管钙化,提高动脉顺应性。Ikebe等(2022)借助健身球对12名年轻健康男性(20~23岁)进行躯干被动拉伸。拉伸包含躯干前、后、侧3个方位的6种动作姿势,每种姿势维持30 s,相邻动作设30 s的放松(重复5次,30 min/次)。结果发现,30 min的躯干被动静态拉伸能使cfPWV显著降低,提示躯干的柔韧性练习能降低中央动脉的钙化,提高其顺应性。
3 运动调控血管钙化的分子机制
运动作为一种非药物手段对心血管的有益作用已被熟知,运动对血管钙化的影响也日益受到学者们的关注。研究表明,运动可通过调控VSMCs的表型转换、提高血管内皮功能、调控miRNA的表达来调节血管钙化发展,降低心血管疾病发生风险(图2)。

图2 运动调节血管钙化的分子机制Figure 2.Molecular Mechanism of Exercise Regulating Vascular Calcification
3.1 运动通过调控VSMCs的表型转换改善血管钙化
VSMCs由收缩表型向成骨型转换可引发血管钙化,而运动可以通过恢复VSMCs的收缩表型来改善血管钙化。Liu等(2021)对运动与VSMCs功能相关的35篇文献进行Meta分析发现,HIIT和联合运动对VSMCs的功能具有积极作用,而激烈的有氧运动和联合运动是促进VSMCs扩张反应的最佳方式,尤其是运动周期超过12周能够显著增强血管的功能,并且对40岁以上患有高胆固醇血症或类风湿性关节炎患者的血管功能影响更加显著。相比于青年大鼠,老年大鼠的VSMCs增殖能力加强并向合成表型转换,平滑肌肌球蛋白重链1(smooth muscle myosin heavy chain 1,SM1)表达下降,而磷酸组蛋白H3和合成蛋白核糖体蛋白S6(phospho-histone H3 and of the synthetic protein ribosomal protein S6,rpS6)表达增加,10周跑台运动后大鼠冠状动脉收缩反应增强、VSMCs增殖能力及rpS6表达下降,而SM1表达升高(Muller-Delp et al.,2018),提示长期运动可通过调控VSMCs的表型转换逆转增龄性的冠状动脉收缩障碍。Chen等(2015)研究发现,中等强度有氧运动能有效逆转高血压患者VSMCs质膜上L型电压门控通道的构型,重塑血管平滑肌结构和功能,产生了与治疗心血管药物类似的作用。8周中等强度跑台运动可以使自发性高血压大鼠肠系膜小动脉VSMCs收缩型蛋白钙调蛋白(calponin)表达增加,而成骨型蛋白OPN的表达则下降,深入研究发现,运动上调了血管miRNA-145的表达及丝氨酸苏氨酸蛋白激酶(protein kinase B,Akt)的磷酸化水平(Liao et al.,2018)。Zhang等(2019)研究发现,磷酸化Akt表达的降低显著抑制了VSMCs收缩型标志物α-SMA的表达,增强了合成表型标志物OPN的表达,而丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路与Akt的调控作用相反,说明有氧运动通过调控Akt和MAPK信号通路的平衡维持自发性高血压大鼠肠系膜小动脉VSMCs的收缩表型。
3.2 运动通过调控内皮功能改善血管钙化
血管内皮位于血管壁最内层,对于感应血管微环境,维持血管内稳态至关重要。内皮功能障碍与血管炎症、血管收缩障碍以及血管钙化的发生发展密切相关。NO作为天然的血管扩张剂在调控血压、促进血管内皮修复、重塑血管基质、减少血管炎症和血管钙化以及稳定钙化斑块中发挥了重要作用(王秀芬等,2016)。动物实验证明,少至7天的运动就可以增强内皮依赖的血管扩张功能,人体研究也发现运动促进内皮依赖性的血管扩张作用不仅是运动肌群产生的局部现象,而且是大肌肉群被激活后的系统反应,潜在原因是运动促进了NO的生物活性(Maiorana et al.,2003)。去卵巢引发的雌激素不足会导致血管钙化,而去卵巢大鼠进行8周自由转轮运动后,主动脉钙含量、内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和内皮素 1(endothelin-1,ET-1)的表达下降(Park et al.,2008),提示运动通过调控eNOS改善了动脉内皮功能,缓解了动脉钙化。衰老和高脂饮食会引发血管内皮依赖性扩张受损导致动脉硬化,而整个生命周期的有氧运动可以显著降低氧化应激和血管炎症,预防增龄和不良饮食导致的血管功能障碍(Gioscia-Ryan et al.,2021)。肥胖引发的内皮功能紊乱也是产生心血管疾病的重要原因。Lee等(2020)研究发现,肥胖小鼠主动脉内皮细胞中炎症相关因子IL-1β和caspase-1的基因以及蛋白表达上升,而12周的自由转轮运动抑制了NLRP3炎症小体的产生和IL-1β、caspase-1的表达,促进了NO的生成并改善了氧化应激和炎症诱发的血管功能障碍。循环EPCs由于可以归巢到缺血性损伤部位来修复受损血管内皮已经成为治疗心血管疾病的新靶点。运动可以改变血管切应力,增强eNOS的活性,而eNOS活性增加能诱导NO分泌进而刺激骨髓释放EPCs。人体研究发现,28天中等强度运动能减少稳定型冠心病患者EPCs的凋亡,促进循环EPCs的水平,进一步研究发现,最大运动负荷测试在增强患者血管扩张能力的同时促进了VEGF和NO的释放(De Biase et al.,2014),提示运动可能通过增强NO的释放来促进循环EPCs的水平。
3.3 运动通过miRNA改善血管钙化
miRNA是一种长度约21~23个核苷酸的非编码RNA,可以靶向调控多个蛋白在多种疾病的发生和发展中发挥复杂的病理生理调节作用。血管中特异性miRNA水平的变化提示miRNA对血管结构和功能的重要调控作用。在2型糖尿病合并冠状动脉和心肌功能障碍的小鼠血管中miRNA-126表达下调,而小鼠经过8周的跑台运动后血管中miRNA-126的表达增加,冠状动脉和心肌功能障碍得到缓解,并且高强度运动组较中强度运动组表达更高(Lew et al.,2020)。Naderi等(2019)研究发现,6周自由转轮运动联合服用大蒜能促进糖尿病模型大鼠血清HDL显著升高,LDL和甘油三酯水平显著降低,心肌中miRNA-126和VEGF表达上调以及心肌血管生成增加,提示运动可能通过miRNA-126上调VEGF的表达来促进血管生成。Paula等(2020)研究发现,13周的跑台运动增强了股动脉血管功能,上调了eNOS的表达和NO的分泌,下调了miRNA-124a和miRNA-155的表达水平,深入研究发现运动通过 miRNA-124a和 miRNA-155介导 PI3K/Akt信号通路促进NO的分泌来提高血管扩张功能。肥胖会引起血管炎症,表现为血管TNF-α、血管细胞黏附分子(vascular cell adhesion molecule 1,VCAM-1)等炎症因子的表达增加,而8周跑台运动显著降低了小鼠胸主动脉TNF-α的表达,缓解了内皮损伤。深入研究发现,运动通过上调血管miRNA-126的表达抑制VCAM-1的产生发挥了对血管内皮的保护作用(白爽等,2018)。肥胖引起的代谢紊乱会更容易引发胰岛素抵抗和动脉粥样硬化。研究发现,12周游泳运动改善了ApoE肥胖小鼠的内皮功能和胰岛素抵抗,降低了血管中膜厚度,深入研究发现运动通过上调miRNA-492的表达达到修复内皮损伤和抑制动脉粥样硬化发展的作用(Cai et al.,2018)。冠心病模型鼠的血管miRNA-20a表达下降,而通过15周的游泳训练,血管miRNA-20a、eNOS蛋白表达上调,深入研究发现,miRNA-20a通过靶向激活PI3K/Akt信号通路来促进内皮细胞增殖和存活,改善内皮功能(Wang et al.,2017)。
4 运动预防和治疗血管钙化的实践
流行病学、临床和实验研究提供了确凿的证据证明运动(体力活动)能够改善健康状况,降低心血管疾病的发病率和死亡率。冠状动脉钙化和心肺体适能的降低会增加心血管事件发生风险,当校正冠状动脉钙化水平后,运动每增加1 MET,心血管事件发生风险就降低11%(Radford et al.,2018)。多元回归分析显示,对于65岁以上老年人,平均每日步数和活动持续时间>3 METs都是cfPWV的显著预测因子,每天走≥6 600步和/或每天以3 MET的强度运动超过16 min可以使cfPWV达到最小值,而那些较低强度的习惯性活动虽不足以显著增强心肺健康,但可通过调节动脉壁即时硬度、血管脂肪和钙含量的长期变化对中心动脉顺应性产生有益影响(Ayabe et al.,2015)。运动对心血管健康的有益作用已被熟知,但在我国及全球其他国家进行规律性运动的人数比例依然不高。


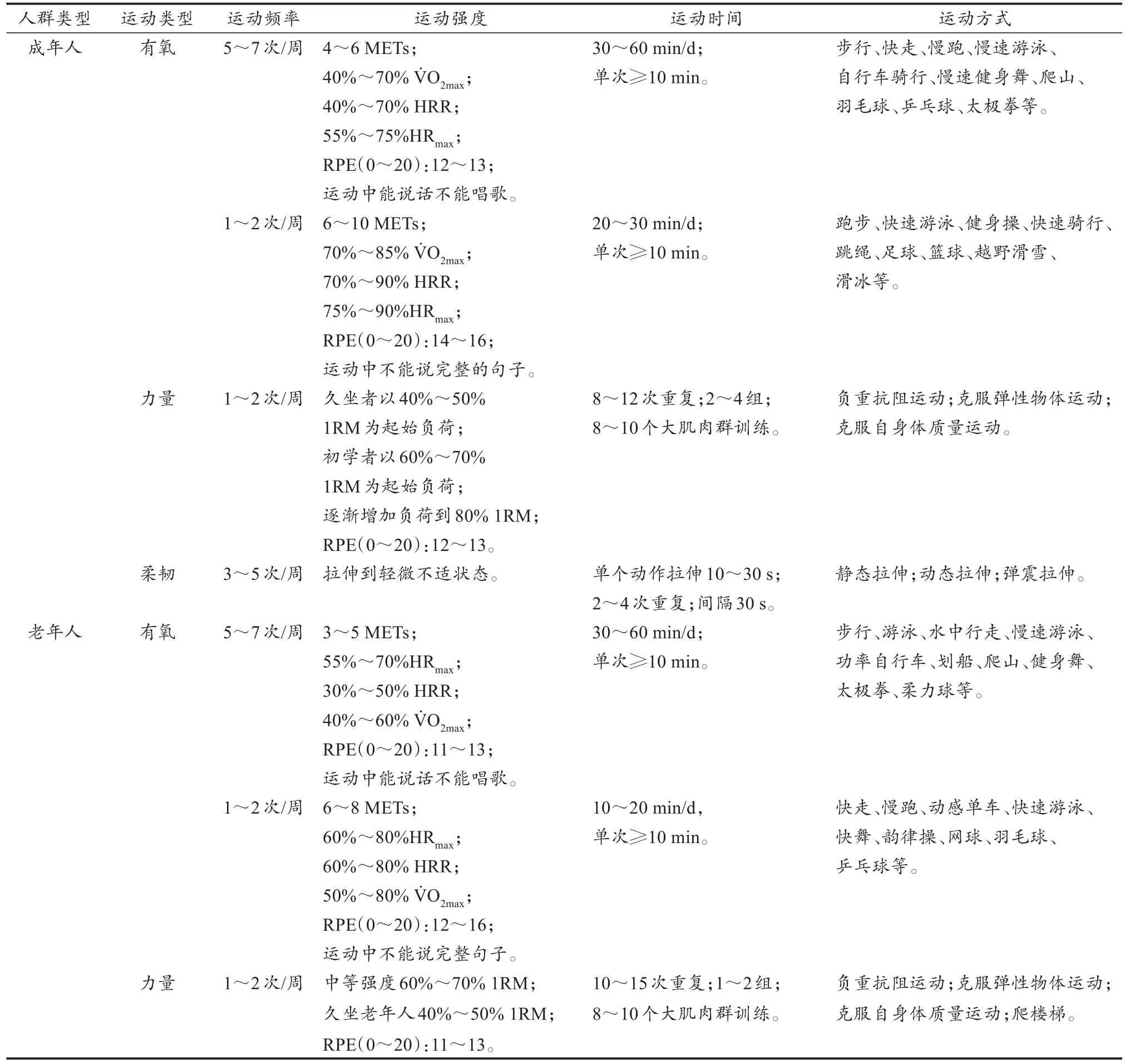
表1 预防和辅助治疗血管钙化的大众化运动方案Table 1 Public Exercise Program for Prevention and Adjuvant Treatment of Vascular Calcification

续表1
5 小结与展望
血管钙化的发展会诱发血管功能障碍,导致严重的心血管疾病。血管钙化的形成过程是涉及众多细胞参与的复杂调控,主要包括VSMCs由收缩表型向成骨表型转换、ECs发生内皮功能失调以及EndMT、干/祖细胞向成骨细胞分化的调节等。运动作为一种非药物干预手段在抑制血管钙化的发展中发挥了积极作用。运动可通过调节平滑肌的表型转换,减轻血管炎症,改善内皮细胞功能,介导多种miRNAs的表达从而有效抑制血管钙化的病理性发展。血管钙化是动脉粥样硬化、高血压、糖尿病等不同慢病常见的病理表现。然而,目前已有文献中尚缺乏同一实验中对不同疾病状态下血管钙化的对比研究。运动干预中患者用药与否以及运动对不同疾病状态下血管钙化调控的分子机制或许不同,以上疑惑尚需在未来研究中进一步的阐明。此外,目前运动对血管钙化的相关研究主要为动物实验,人体研究主要以PWV间接反映运动对血管钙化的影响,血管钙化的直接研究较为匮乏。在血管钙化的运动干预研究中,关于运动类型、运动量、运动强度等指标的对比研究尚不丰富。因此,在未来研究中需要更多地开展运动对人体血管钙化的直接研究,并且在运动类型、运动时间、运动强度等方面进行细化,为科学地制定个性化运动处方,广泛开展运动手段预防和治疗慢性心血管疾病提供依据。

