基于功能性磁共振成像技术的运动疲劳“中枢控制器模型”理论在体研究
郭振向,周开祥,陈 岩,矫 玮,王霄英,张 珏,包大鹏
(1.南京航空航天大学 体育部,江苏 南京 210016;2.成都中医药大学 体育健康学院,四川 成都 611137;3.北京体育大学 竞技体育学院,北京 100084;4.北京体育大学 运动医学与康复学院,北京 100084;5.北京大学第一医院 影像科,北京 100034;6.北京大学 前沿交叉学科学院,北京 100871;7.北京体育大学 中国运动与健康研究院,北京 100084)
随着神经生物学研究的发展及其在运动医学领域的应用,研究者们对运动疲劳产生机制的认识逐渐由外周开始深入到中枢,那些无法被割裂开审视且无法被外周疲劳理论解释的问题开始在运动时中枢的状态变化中找到答案(Gibson et al.,2004;Lambert et al.,2005;Noakes,2010;Noakes et al.,2004b,2004c)。Noakes所提出的“中枢控制器模型”理论认为,运动疲劳是由整个中枢运动神经控制系统(脊髓、脑干和大脑皮层三级结构,小脑和基底神经节2个监控系统)根据外周各脏器及脑组织自身的感觉传入信息主动调控运动单位的神经控制指令的结果(Noakes,2012a,2012b;Noakes et al.,2004a,2005)。该理论一经提出便引起了研究者们的广泛关注,国际运动医学领域顶级期刊BJSM()曾连续多期开辟专题报道和讨论该模型理论(Gibson et al.,2004;Lambert et al.,2005;Noakes et al.,2004b,2004c,2005),为探究运动疲劳的中枢机制提供了理论依据并指明了研究方向。该理论提出至今由于受到研究手段的制约并没有在人体中进行证实,因此将该模型理论进行在体验证对于探究运动疲劳机制、揭开运动疲劳中枢机制的“黑箱”有重要意义。
多年来,研究者们在“中枢控制器模型”理论的指引下尝试通过多种研究手段来探究运动疲劳背后的中枢机制,包括大脑皮层、小脑和基底节区在运动疲劳中所扮演的角色。已有研究者通过动物实验发现,大脑皮层运动区的脑电变化以及基底神经节相关核团神经元的电活动与运动疲劳有关(侯莉娟 等,2013,2016;乔德才 等,2005,2010;杨东升 等,2012)。Świątkiewicz等(2017)发现,力竭性耐力运动后小鼠的小脑和海马回的谷氨酰胺和谷氨酸增高,说明小脑与运动疲劳有关。在人体研究方面,研究者们已经开始使用脑电图(electroencephalography,EEG)和功能性近红外光谱技术(functional near-infrared spectroscopy,fNIRS)对运动过程中大脑皮层的激活情况进行研究(Bediz et al.,2016;Robertson et al.,2015),但小脑和基底神经节位于大脑的深层区域,需要探测范围更广、质量更高的神经影像学工具来对其进行探究。近年来,功能性磁共振成像(functional magnetic resonance imaging,fMRI)开始被用来探测大脑在运动过程中更深层脑区的激活情况(Fontes et al.,2015,2020),这就为在体验证“中枢控制器模型”理论提供了可能。因此本研究拟通过使用fMRI技术中的氢质子磁共振波谱(H-magnetic resonance spectroscopy,H-MRS)方法探究运动员疲劳前后相应脑区的代谢物质变化,探寻与疲劳相关的大脑区域;使用全脑血氧水平依赖功能磁共振成像(bloodoxygenleveldependent-functionalmagnetic resonance imaging,BOLD-fMRI)观察运动员疲劳前后脑区之间的功能连接变化,探讨运动疲劳对相应脑功能区激活与连接的影响,在体验证“中枢控制器模型”理论。
1 研究对象与方法
1.1 研究对象
Shibuya等(2010)的研究提示,应招募具有良好训练水平的人群来参与运动疲劳的相关实验研究。所以,本研究首先招募了20名身体健康,无代谢病史,无神经系统疾病且800 m跑成绩≤2 min 3 s的男性运动员(均为右利手),年龄(19.47±0.78)岁,身高(174.85±6.61)cm,体质量(67.94±8.42)kg。所有被试均自愿同意参与实验,在实验前均填写《实验知情同意书》,知晓实验目的和方法。之后依据国际上界定被试具备良好训练水平(心肺能力)的最大摄氧量范围标准(Bosquet et al.,2007a,2007b),在实验前对20名运动员进行最大摄氧量测试,根据测试结果最终选择相对最大摄氧量≥55 ml/(kg·min)的11名被试进行递增负荷至疲劳实验,平均年龄(20.27±0.79)岁,身高(172.46±6.67)cm,体质量(64.19±6.14)kg,平均相对最大摄氧量为(60.05±3.30)ml/(kg·min)。在实验正式开始前的48 h内要求被试禁止摄入含咖啡因或酒精物质的饮料,并告诫避免进行任何类型的剧烈运动。本研究已通过运动科学实验伦理审查。
1.2 被试最大摄氧量的测试方法
每次测试时保持室温在20℃~25℃,相对湿度在40%~50%范围内。测试前先对气体代谢分析仪(AEITechnologies,美国)进行校正。在正式测试前先询问被试运动史、家族史、疾病史等后称量被试体质量。使用功率自行车(Monark893E,瑞典)进行测试。准备活动5 min,起始负荷为90 W,每2 min递增30 W,要求转速保持在(60±5)r/min(测试过程中使用节拍器并不断鼓励被试)。当出现以下3种情况中的任意2种时可以确定被试达到最大摄氧量:1)心率≥180次/min;2)呼吸熵>1.10;3)耗氧量不再随负荷的增加而线性增加,开始出现平台或缓慢下降且最后2个耗氧量值的差异<±2 ml/(min·kg)。此外,当被试不能维持功率自行车转速在60 r/min达5 s以上时终止测试。为了消除最大摄氧量测试给被试带来的疲劳效应,在最大摄氧量测试完成的7天后开始正式实验。
1.3 实验流程

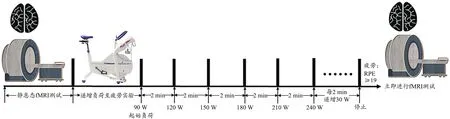
图1 实验流程图Figure 1. Protocol of the Experiment
1.4 功能核磁成像测试
1.4.1H-MRS测试指标
H-MRS是现阶段唯一能够无创检测活体组织代谢及生化变化的技术,其原理是利用傅立叶转换将不同电化学环境下原子核共振频率所发生的偏移(化学偏移)转换成按频率-信号强度分布的谱线,然后根据某些物质在特定频率下产生的信号强度来判断该物质的浓度(侯莉娟等,2010a)。H-MRS能检测的代谢物质主要有:
1)N-乙酰天门冬氨酸(N-acetylaspartate,NAA)主要位于2.02 ppm,正常浓度6.5~9.7 mmol,仅见于神经组织,存在于神经元胞体及轴索中,是正常神经元的标志物。
2)胆碱化合物(Choline,Cho)主要位于 3.20 ppm,正常浓度0.8~1.6 mmol,是细胞膜翻转的标志物。
3)肌酸(Creatine,Cr)主要位于 3.05 ppm,正常浓度3.4~5.5 mmol,是能量利用、储存的重要化合物,是细胞的能量状态标志(图2)。

图2 1H-MRS测试指标示意图Figure 2.Schematic Diagram of1H-MRS Index
1.4.2 被试的体位
被试仰卧并将头部正放于线圈中。被试在检查时要保证头部位置不动,然后在其膝下及后颈部均使用软垫固定。通过记录被试下颏尖至胸骨切迹的距离来确保每次扫描的定位一致,记录下颏至胸骨上窝正中的距离确保每次定位时体素一致。
1.4.3 MRS序列扫描参数
在进行MRS采集之前应确定MRS的定位像,即形成一个正轴位的成像序列(选择FSE T2W1),层厚5 mm,无间隔,作为最终MRS体素的定位显示。然后对大脑左侧顶叶初级运动区(primary motor areas,M1)、右侧顶叶M1区、左侧基底节RBG区和右侧基底节RBG区进行单体素波普采集。在定位容积内进行均匀磁场操作,使水信号半峰全宽达到8 Hz以下;用chess序列抑制水峰,激励特定频率范围信号;用点分辨采集技术(point resolved spectoroscopy,PRESS)采集氢谱(空间分辨率:2 cm×2 cm×2 cm;TR=1 500 ms;TE=144 ms;Voxel=2 cm×2 cm×2 cm,采集次数 128次;NEX=200;Matrix=1 020;扫描时间:1 min)。
1.5 BOLD系列扫描参数
使用带有8通道标准头部矩阵线圈的3T核磁共振扫描仪(通用电气医疗系统,美国)来获取MRI数据,使用三维梯度回波脉冲序列(3D-FSPGR)扫描来获取高分辨率全脑解剖图像。采用单激发平面回波扫描序列进行数据采集(single-shot echo-planar imaging,EPI),扫描参数包括:层厚:4 mm;扫描层数:33层;层间距:0 mm;FOV:240 mm;矩阵:64×64;TR:2 000 ms;翻转角:90°;TE:30 ms;扫描时间:5 min。
1.6 数据处理与统计分析
1.6.1 波谱分析
使用Elscint/GE软件包对氢谱图像进行统计分析,将NAA位置确定为2.02 ppm,并以此为参照确定其他物质的化学转移。Cho为3.20 ppm,Cr为3.05 ppm。分别测量各峰的峰高和峰下面积。根据脑H-MRS分析惯例,脑内Cr浓度相对恒定,故以Cr浓度作为内参计算NAA、Cho相当于Cr的比值,然后计算左侧初级运动区(BA4)、右侧初级运动区(BA4)、左侧基底节区(RGB)及右侧基底节区(RBG)运动前后的H-MRS的峰高和峰下面积。
1.6.2 图像数据处理
使用SPM8软件(伦敦大学威康神经影像科学系,英国)和动脉自旋标记灌注磁共振成像信号处理工具包(ASLtbx)对数据进行预处理(Liu etal.,2013;Wang etal.,2008):
时间校正(slice timing),剔除静息态扫描前10个时间点的图像数据;
头动校正(realignment),剔除头动在、、轴的平动超过2 mm或旋转角超过2°的被试数据;
空间标准化(normalization),将图像配准到蒙特利尔神 经病 学 研究所(Montreal NeurologicalInstitute,MNI)标准;
高斯平滑(smoothing)处理,选择8 mm半峰全宽(fullwidth half-maximum,FWHM),以提高图像的信噪比(Bao et al.,2019;Griffis et al.,2016;Mikl et al.,2008);
去除数据线性漂移,0.01~0.08 Hz带通滤波提取低频振荡信号部分,消除生理噪声。
对预处理后的图像选取感兴趣区域(region of interest,ROI)。按照“中枢控制器模型”理论(脊髓、脑干和大脑皮层三级结构,小脑和基底神经节2个监控系统)假说的指导与目前人们对于大脑中与运动相关区域的认识来选择ROI(Carter,2019;Noakes et al.,2005),然后按照 AAL 模板(2×2×2像素,模板大小为91×109×91)对选取的ROI进行合并标记选取,最终选择的ROI如表1所示。

表1 感兴趣区域模板(2×2×2,91×109×91)Table 1 Area of Interest Template(2×2×2,91×109×91)
计算被试大脑功能像中每个ROI数据的平均值,形成该ROI区域数据的时间曲线(time course,TC),之后对该TC进行去线性趋势(detrend)和带通滤波(band pass,2prder butter worth filter,0.01~0.08 Hz)。随后对单个被试的不同状态下每两两ROI的TC进行相关分析,计算相关系数,以此反映ROI之间的联接程度。
1.6.3 数理统计
数据采用平均值±标准差(±)表示,使用RStudio软件进行统计分析与数据可视化。使用双尾配对样本检验比较运动后疲劳态与运动前静息状态的脑功能核磁差异,同时通过计算Cohen效果量(effect size,)来评价运动前静息态和运动后疲劳态脑功能核磁变化的差异大小,使用绝对值统一效应量的方向尺度。效果量的大小范围为:<0.2为微小效果,0.2~0.5为小效果,0.5~0.8为中效果,>0.8为大效果(Hopkins et al.,2009)。对于组群之间ROI联接程度的改变计算步骤如下:对每组内被试不同状态下每两两ROI之间的相关系数提取出来(个数为组内被试个数),之后对这些相关数据进行组间(疲劳后<正常)单尾配对样本检验,显著性水平定义为<0.05。
2 研究结果
2.1 运动性疲劳前后脑功能区代谢物质的变化
如表2、表3和图3、图4所示,与静息态相比,运动性疲劳发生后左右两侧初级运动区和左右两侧基底核区的NAA/Cr均无显著性变化(>0.05,=0.01~0.32);左侧基底节区的Cho/Cr显著降低(<0.05,=0.89),左右两侧初级运动区和右侧基底节区的Cho/Cr无显著性变化(>0.05,=0.33~0.49)。

表2 运动性疲劳前后脑功能区NAA/Cr变化Table 2 Changes of NAA/Cr Before and After Exercise Fatigue in Brain

表3 运动性疲劳前后脑功能区Cho/Cr变化Table 3 Changes of Cho/Cr Before and After Exercise Fatigue in Brain

图3 运动性疲劳前后脑功能区NAA/Cr变化Figure 3.Changes of NAA/Cr Before and After Exercise Fatigue in Brain

图4 运动性疲劳前后脑功能区Cho/Cr变化Figure 4.Changes of Cho/Cr Before and After Exercise Fatigue in Brain
2.2 运动性疲劳对终极ROI之间功能连接的影响
通过表4和图5显示,与静息态脑功能连接相比,被试递增负荷运动至疲劳后小脑和M1、小脑和躯体感觉运动区(sensory motor cortex,SMC)、小脑和海马/海马旁回网络脑区之间的功能连接减弱(<0.05)。

表4 不同状态下每两两ROI之间的相关系数对比Table 4 Comparison of the Correlation Coefficients of Each Two ROIs in Different States
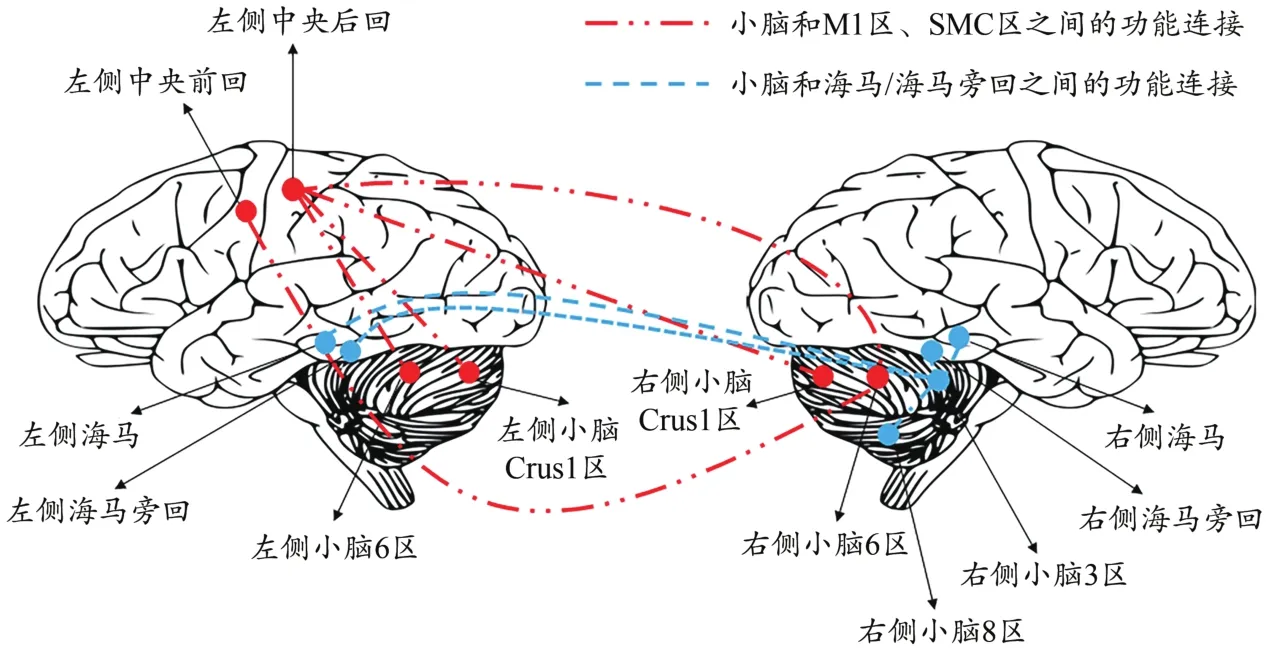
图5 运动性疲劳对终极ROI之间功能连接的影响Figure 5.Effect of Exercise Fatigue on Functional Connection among Ultimate ROI
3 讨论
研究发现,被试左侧基底节区的Cho/Cr在运动疲劳后显著下降(<0.05,=0.89);同时,运动疲劳发生后被试的M1、SMC,以及海马/海马旁回与小脑之间的功能连接程度减弱(<0.05)。说明运动疲劳发生后基底节区代谢物质下降,小脑与其他脑区的联系减弱,此结果从一定程度上反映了“中枢控制器”模型理论中基底节区和小脑作为监控系统来调控运动疲劳的假说。
H-MRS主要检测脑内与三羧酸循环和(或)能量代谢有关的物质。Cho是组成卵磷脂的强有机碱,既是乙酰胆碱的前体,又是机体可变甲基的来源(作用于合成甲基的产物),主要存在于神经鞘磷脂之中,负责信息传递、调控细胞凋亡以及构成生物膜。NAA是反映神经元损伤程度的指标,所以目前关于NAA的研究多集中于卒中后的代谢变化等方面,NAA对于卒中后缺血半暗带的判定和预后均有重要意义(Igarashi et al.,2015;Mazibuko et al.,2020)。Cr作为机体能量利用和储备的重要化合物,代表着细胞的能量状态并维持脑细胞中的能量代谢(Braissant et al.,2011)。由于Cr在大脑内的浓度是相对恒定的,所以Cr浓度常被用作内参来比较NAA和Cho的值。在以下肢发力为主的蹬车运动中,优势侧和非优势侧肢体分别激活了大脑皮层的不同区域。其中优势侧主要激活对侧M1区,双侧运动辅助区(supplementary motor area,SMA)以及小脑区,而非优势侧除激活与优势侧一致的区域外,还能激活基底神经节区域,同时两侧踝关节的随意运动也会激活基底神经节区域(侯莉娟等,2010b)。基底神经节是由豆状核(壳核和苍白球)、尾状核以及屏状核组成的灰质团块,埋藏在双侧大脑半球的深部,是组成锥体外系的主要结构,具有运动皮质下整合中枢的作用,因此又被称为皮层下的运动中枢。主要包括调节运动、协调椎体系功能、支持空间知觉、条件反射、注意转换等(黄浩洁 等,2019;乔德才 等,2014;Florio et al.,2018)。本研究发现被试处于运动疲劳状态时,左侧基底节区的Cho/Cr值显著降低,反映了基底节区的膜代谢状态(大分子跨膜转运以及离子的通透性)发生了变化,提示基底节区神经元活性出现功能障碍(Bekdash,2019)。同时膜代谢状态的改变会使得膜受体接受刺激,然后激活相应的磷脂酶促发信息传递的功能也发生改变,所以Cho/Cr降低会导致基底节区神经元之间的信息传递功能下降。除此之外,与其他甲基供体相比,Cho在调控细胞凋亡方面有其不可替代的特异性功能,因此运动疲劳发生后Cho下降导致甲基供应减少,从而启动了基底节区的细胞凋亡。基于上述的一系列变化最终导致了基底节整合中枢的功能下降,造成调节运动、协调椎体系调节空间知觉、条件反射、注意转换等的功能降低或受限(Dezfouli et al.,2017),从而人体会表现出运动疲劳的状态。
功能连接作为脑功能研究中度量不相邻脑区间功能活动同步性的一种方式,被定义为“空间上远离的神经生理活动之间在时间上的相关性”(Friston et al.,1993)。Biswal等(1995)首先通过分析静息态BOLD扫描信号中的低频成分(<0.1 Hz)证明了感觉运动皮层之间存在功能连接。此后,有更多的研究者开始关注脑区之间的功能连接,通过分析人体不同系统(如运动系统、语言系统等)在静息状态下的BOLD扫描数据发现大脑的功能活动有其特定的规律和联系,并非如噪声般杂乱无章。本研究发现,被试无论处在运动前的静息状态还是运动后的疲劳状态,其大脑中的各脑区均与小脑为中心形成了稳定的网络连接结构,但人体处于运动疲劳状态时,小脑与M1区、SMC区以及海马/海马旁回之间的连接程度会减弱。这表明运动疲劳发生后大脑的功能活动出现变化,小脑与其他脑区之间的连接程度下降有关可能是导致运动疲劳出现的因素之一。除fMRI研究发现各脑区之间存在功能连接外,解剖学的研究也为此提供了证据,如基底节和小脑半球与大脑皮层之间存在环路。这个环路使得基底节与大脑皮层以及小脑半球之间相互联系,既能为广泛的大脑皮层功能服务,还能通过组成更为复杂的系统使得基底节和小脑半球的神经活动影响运动功能,基底节、小脑半球和额叶前部区域内的神经元活动影响认知功能(Bostan et al.,2018)。还有研究发现,运动共济能力下降且大脑活动处于非正常状态的帕金森综合征患者,其大脑活动表现出以壳核为中心的网络连接功能下降(Fransson,2005)。目前,无论运动疲劳还是不同运动能力退化下脑功能网络连接的变化仍需要进一步深入研究,随着无创神经调控技术的出现将为“中枢控制器模型”理论在人体研究提供新的验证策略。
本研究尚存不足之处,首先,虽然本研究共招募了20名被试,但最后仅有11名被试符合研究的入组标准,被试数量相对较少导致统计效应偏弱,后续研究应增加被试数量,以更严格的统计检验标准来验证本研究的发现。此外,本研究受限于目前的技术手段只分析了基底节区和小脑区在运动疲劳发生后的相应变化,要完全验证“中枢控制器模型”理论需要更全面的分析和更强的证据支持,未来可针对其他相关脑区展开更细致的研究,为运动疲劳背后的中枢机制提供现实证据。
4 研究结论
运动疲劳发生后基底节区的代谢物质下降,以小脑为中心的脑功能默认网络连接降低,基底节区和小脑可能是使人体出现运动疲劳状态的重要脑功能区,这也初步验证了“中枢控制器模型”理论中基底神经节和小脑作为2个监视系统来调控人体产生运动疲劳的理论假说。

