肺转移瘤合并肺栓塞与下肢深静脉血栓合并肺栓塞的SCTPA表现的对比分析
张祥
(北京市石景山医院放射科,北京 100043)
恶性肿瘤引起凝血状态异常等因素可造成肺栓塞,同时肺动脉也是恶性肿瘤发生肺内转移的重要路径,之前临床有过肺动脉内肿瘤栓塞以及恶性肿瘤合并肺栓塞的报道[1-2],有文献认为肺内肿瘤合并肺栓塞的患者的预后与无肺栓塞者可能存在着差异[3]。下肢深静脉血栓脱落是导致肺栓塞的常见原因之一,近年来临床研究较多,在以往的文献中,对下肢静脉血栓脱落引起的肺栓塞的螺旋CT肺动脉造影(SCTPA)表现报道亦较多[4-6],而对肺转移瘤合并肺栓塞的SCTPA表现研究较少[7]。本文通过对比分析两组病例,进一步研究肺转移瘤合并的肺栓塞与下肢静脉血栓合并的肺栓塞有无不同,以提高影像诊断能力。
1 资料与方法
1.1 一般资料 收集我院2005年3月至2019年12月间在我院经螺旋CT肺动脉造影检出肺转移瘤合并肺栓塞患者54例(A组),男38例,女16例,年龄(63±12)岁;收集下肢静脉血栓合并肺栓塞的患者92例(B组),男55例,女37例,年龄(56±14)岁。A组患者中包括肾透明细胞癌24例,肺癌16例,直肠癌2例,乙状结肠癌1例,肝细胞癌7例,食管癌1例,胰腺癌1例,绒毛膜上皮细胞癌2例,肺内转移瘤均有病理学证实。B组患者的下肢静脉血栓均经下肢血管超声检查证实。
1.2 影像检查方法 患者按接受检查年限的不同,先后采用了我院GE Hispeed Dx/i(单排)、Lightspeed VCT(64排)和Discovery 750(64排宝石CT)进行扫描,扫描层厚0.625~3 mm,扫描范围自胸廓入口至膈肌。单排CT造影采用团注碘海醇(30 gI/mL)150 mL,64排和宝石CT采用团注碘海醇(35 gI/mL)80 mL,注药速度4 mL/s。
1.3 影像资料的分析 回顾性分析所有入组病例的栓塞分布的部位、形态、边界、造成局部肺动脉变化、肺内继发改变,并列表统计。影像资料由主任医师、副主任医师和主治医师各一名进行盲阅,结果须有两位以上医师达成一致方为有效。
1.4 统计学分析 运用SPSS26.0统计软件,按表1所列项目对比统计两组的发生率,然后进行卡方(χ2)检验,比较两组的差异性。P<0.05为差异有统计学意义。
2 结果
A组共检出肺动脉栓塞120处,B组检出300处。两组栓塞分布部位、形态、边界、局部肺动脉变化、肺内改变的具体内容见表1。
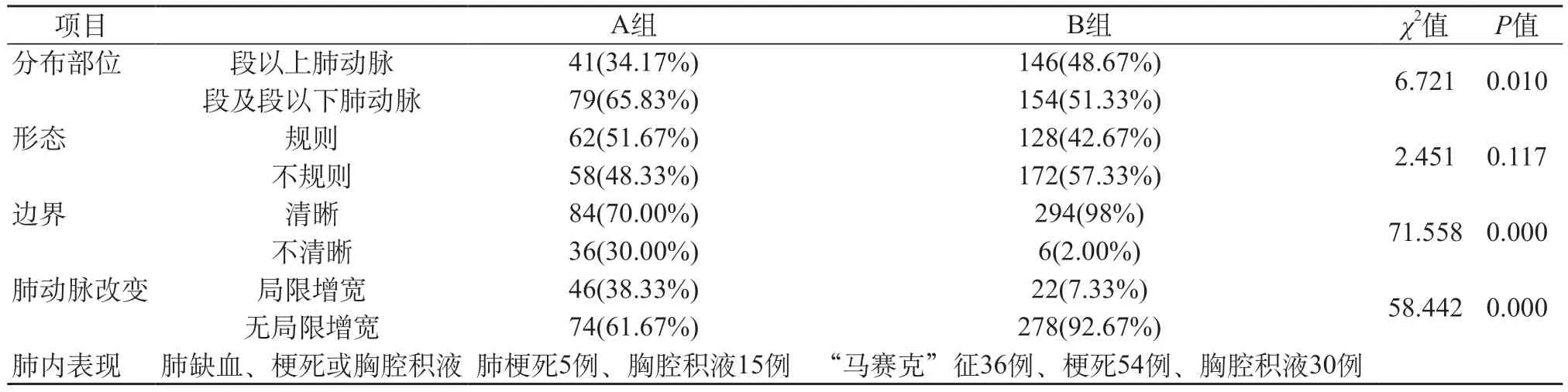
表1 肺转移瘤组(A组)和下肢深静脉血栓组(B组)的SCTPA表现比较
2.1 栓塞发生的部位 A组患者发生在段以上主干部位的肺动脉为41处,占34.17%,发生在段及段以下分支肺动脉为79处,占65.83%,而B组患者发生在段以上肺动脉主干为146处,占48.67%,发生在段及段以下分支肺动脉为154处,占51.33%,两组有统计学差异(P<0.05)。两组肺栓塞均易发生在段及段以下分支肺动脉内,但A组患者较B组患者更易发生。
2.2 栓塞的形态 栓塞处的造影剂充盈缺损形态可表现为规则性和不规则性,规则性栓塞按长/短径≤1.5,又有类圆形和非类圆形。A组的充盈缺损表现规则形的有62处,占51.67%,而B组的充盈缺损表现规则形的有128处,占42.67%,两组无显著统计学差异(P>0.05),因此,单从栓塞形态上很难分辨两组的栓塞。
2.3 栓塞的边界 A组栓塞处的充盈缺损与肺动脉壁边界清晰有84处,占70%,全部为中心型栓塞,边界不清晰的有36处,占30.00%,充盈缺损与肺动脉壁的分界表现不清晰,甚至有骑跨肺动脉壁的趋势(图1、2),B组栓塞处的充盈缺损与肺动脉壁边界清晰的有294处,占98%,表现为中心型栓塞或窄基底相接的栓塞(图3、4),边界不清晰的有6处,占2.00%,两组有统计学差异(P<0.001),A组栓塞更多表现为与肺动脉壁的边界不清晰。
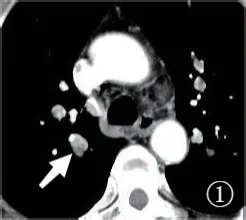
图1 肾癌肺转移合并肺栓塞患者,右上叶肺栓塞(白箭),栓子规则,与动脉壁分界不清晰,局部向外凸出,造成局部管腔扩张
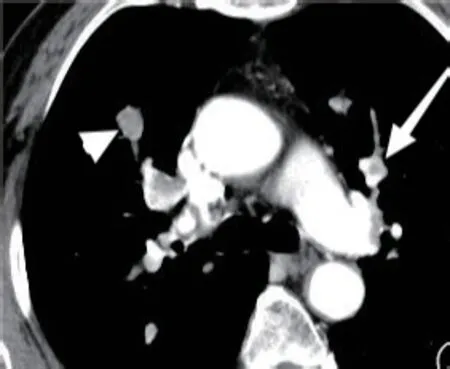
图2 肺癌肺内转移合并肺栓塞患者,右中叶肺栓塞(白箭),栓子外形不规则,与动脉壁分界不清,局部有“骑跨”管壁样管壁,造成局部管腔扩张
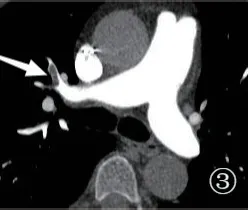
图3 下肢深静脉血栓合并肺栓塞患者,右中叶肺栓塞(白箭),栓子规则,与动脉管壁分界清晰,无局部肺动脉扩张
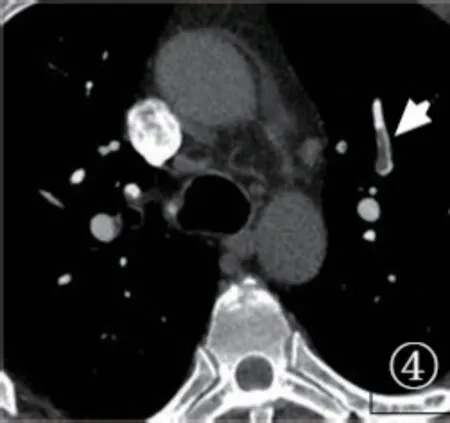
图4 下肢深静脉血栓合并肺栓塞患者,左上叶肺栓塞(白箭头),栓子规则,与动脉管壁分界清晰,无局部肺动脉扩张
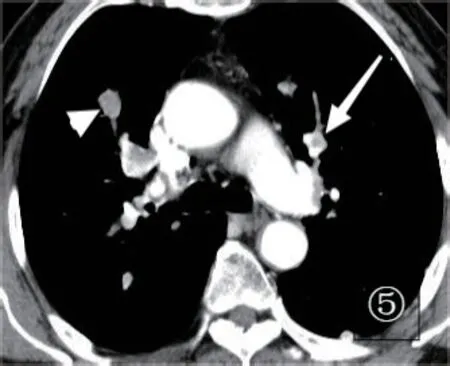
图5 肾癌肺转移合并肺栓塞患者,双上叶多发肺栓塞(白箭头和白箭),造成局部肺动脉扩张,呈现“串珠样”改变
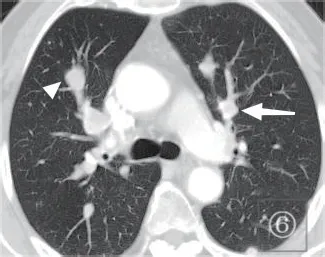
图6 肾癌肺转移合并肺栓塞患者,双上叶多发肺栓塞(白箭头和白箭),造成局部肺动脉扩张,呈现“串珠样”改变
2.4 局部肺动脉的改变 该项分析并不包括肺栓塞造成轻度、均匀的节段性肺动脉增宽的情况,而只针对栓塞位置上局部肺动脉增宽情况进行了分析。A组栓塞造成局部肺动脉增宽的有46处,占38.33%,有典型的局部肺动脉增宽呈现出“串珠样”改变(图5、6),B组造成局部肺动脉增宽的有22处,占7.33%,两组有统计学差异(P<0.001),A组更易造成局部的肺动脉增宽。
2.5 肺内表现 A组除肺内转移瘤外,发生肺梗死5例,胸腔积液15例,B组出现“马赛克”征36例,肺梗死18例,胸腔积液30例。
3 讨论
下肢深静脉血栓脱落是急性肺栓塞发生的常见原因之一,栓子脱落后经体静脉、右心房、右心室进入肺动脉内,进而造成急性肺动脉栓塞,临床出现胸闷、胸痛、呼吸困难甚至于危及生命,有文献报道,对于有症状的急性肺动脉栓塞患者,深静脉血栓的存在,是造成30~90天内高病死率的重要因素[3]。恶性肿瘤合并肺栓塞的研究在临床中也有报道,Cadaver scalpel的一组研究发现恶性肿瘤约50%的患者有肺栓塞形成,非小细胞肺癌患者VTE的发生率是小细胞肺癌患者发病风险的2倍[8],主要机制是包括肿瘤细胞产生凝血物质,造成血液处于高凝状态,同时,肿瘤手术联合化疗也会使血液处于高凝状态,当肿瘤侵犯破坏肺动脉壁,使管壁局部的抗血栓能力降低,以及肿瘤患者长期处于消耗状态造成恶液质和长期卧床等因素,均会造成肺动脉栓塞的发生。同时,在Maria Barca-Hernando等的一组多因素分析中,认为癌症的转移与肺栓塞全因病死率相关,并影响肿瘤患者的预后[3]。
SCTPA目前被证实是临床诊断肺栓塞的准确、可靠的检查方法[6]。本研究对比分析了肺转移瘤合并肺栓塞和下肢静脉深静脉血栓合并肺栓塞两组病例的SCTPA表现,结果发现两组发生在段以上肺动脉主干的比例均高于段及以下肺动脉,并且肺转移瘤组的栓塞发生在段以下部位的概率大于下肢深静脉组,有统计学意义,这可能与本组病例中的下肢静脉栓子脱落,并继发原位主干血栓形成慢性栓塞的因素有关。栓子的形态两组间未发现有统计学的差异,而肺转移瘤组栓塞与肺动脉壁边界不清并造成栓塞部位的肺动脉局限性增宽的概率明显大于下肢静脉组,有些病例显示出串珠征改变,栓子向壁外凸出,以往文献中也有过类似报道[7],形成机制还不十分明了,可能不单单与恶性肿瘤造成高凝状态进而血栓形成有关,也存在着与肺转移机制有关的可能性。肺转移组和下肢静脉血栓组均可见肺内缺血、梗死和胸水的表现,这主要跟栓塞发生的部位和急、慢性程度相关,两组均有部分病例发生了急性的、较大分支的栓塞,因此出现了肺内继发性改变。但转移组的胸腔积液并不能完全排除与肿瘤转移以及患者卧床、慢性消耗体质有关。
本研究由于为回顾性分析,长时间追踪使对患者诊断采用的CT扫描机型有着差异,从单排螺旋CT到64排VCT,再到宝石64排CT,因此,检查技术可能对分析结果的准确性产生一定的影响,这是本研究的重要不足之处。同时,本组没有区分出肺转移瘤合并肺栓塞患者中有无合并下肢静脉血栓患者,以及有多少患者合并下肢血栓作为一项干扰因素来分析,这可能造成肺转移瘤组的肺栓塞有一部分是下肢静脉血栓脱落造成肺栓塞的情况,即两组患者存在交叉的情况,因此,对结果的可靠性可能有一定的影响。希望在今后的研究中进一步完善。

