高危型人乳头瘤病毒E6/E7基因在未明确意义的非典型鳞状上皮细胞分流中的应用效果
黄梅秀 谢芳 林艳华 陈岚岚 李微微
(福建医科大学附属闽东医院妇科,福建 福安 355000)
近半个世纪以来,宫颈细胞学检测已广泛应用于宫颈癌筛查,其中意义不明的非典型磷状细胞(ASCUS)在细胞学异常中占50%以上,大部分的ASCUS和低级别病变可自发性消退[1]。细胞学ASC-US中最终被诊断高级别病变为5.10%~9.00%。目前,已经确定了100多种人类乳头瘤病毒,包括13种高危类型,它们会导致宫颈癌和其他肛门生殖器和口咽癌,人类乳头瘤病毒16型和18型约占所有宫颈癌的70%[2]。因此HPV检测成为管理女性ASCUS的主要方法,这种方法被ASCCP指南推荐。据报道,在出现ASCUS的女性中有15%~20%在随后的组织学诊断中被确定为宫颈上皮内瘤样病变(CIN)2级及以上(CIN2+)[3]。5年随访结果也表明,出现ASCUS的女性患宫颈上皮内瘤样病变3级及以上(CIN3+)的风险显著高于一般人群。然而,若将ASCUS的女性全部转诊阴道镜,则存在过度诊断的问题。ASCCP建议对宫颈细胞学结果为ASCUS的患者进行HPV检测。目前的管理指南不推荐患有ASCUS的女性进行HPV基因分型。本研究中,我们以宫颈癌筛查人群为研究对象,通过比较Aptima HPV(AHPV)和Aptima HPV16/18/45 Genotype(AHPV-GT)检测对细胞学诊断为ASCUS患者的分流效果,探讨二者用于 ASCUS人群分流的临床价值。
1 资料与方法
1.1 参与人群 本数据为回顾性分析本院2019年6月至2021年6月期间细胞学检测为ASCUS的女性,符合条件的女性为21岁或以上,并有ASCUS细胞学检查结果。如果孕妇、曾报告曾接种过HPV疫苗、有宫颈疾病(癌症或癌前病变)史或在过去12个月细胞学检查结果异常(ASCUS,低级别鳞状上皮内病变,或更糟),或有可能干扰研究或对参与者造成不可接受风险的病史者则排除在研究之外。本研究获得福建医科大学附属闽东医院伦理委员会的批准,编号为[2020]宁闽医伦理审字第(0820-02号)。参加宫颈癌筛查者中细胞学诊断为ASCUS共397例,其中有完整阴道镜召回信息及AHPV检测结果阳性的女性作为研究对象,共239例。
1.2 材料与方法 回顾性分析2019年6月至2021年6月在福建医科大学附属闽东医院妇科门诊就诊,细胞学结果为ASCUS的有性生活史女性。均自愿接受HPV Aptima HPV检测及(Aptima HPV-GT)。
1.3 方法
1.3.1 试验标本采集 医师用采样刷收集1份宫颈细胞标本,进行TCT+AHPV及AHPV-GT检测。具体如下:取宫颈刷于宫颈管内顺时针方向旋转3圈,置入专用细胞保存液内,送病理科进行AHPV及AHPV-GT和TCT检测。由工作人员给每个标本编号、送检。
1.3.2 试验检测
1.3.2.1 液基细胞学检测 将保存液中的部分标本经ThinPrep 2000系统程序化处理后,制成直径为2 cm的薄层细胞涂片,95%酒精固定,巴氏染色。采用TBS分级系统进行细胞学诊断,诊断结果包括无上皮内病变或恶性病变(NILM)、ASCUS、非典型鳞状细胞、不除外高级别鳞状上皮内病变、不典型腺细胞、低度鳞状上皮内病变、高度鳞状上皮内病变、鳞癌、原位腺癌和腺癌。液基细胞学检测结果为NILM时定义为正常。
1.3.2.2 HPV E6/E7 mRNA检测 采用Gen-Probe Technologyand PANTHER System进行检测。该系统主要基于多重核酸扩增体系,可检测包括HPV16,18,31,33,35,39,45,51,52,56,58,59,66和68型在内的共14种高危型。主要包括mRNA的提取、扩增和扩增产物检测。提取出的mRNA通过转录介导扩增技术(TMA)法进行扩增,TMA法是利用小鼠白血病病毒(MMLV)反转录酶和T7核糖核酸聚合酶而进行的以反转录为基础的核酸扩增方法。MMLV反转录酶可催化含有T7核糖核酸聚合酶启动子序列的mRNA反转录为cDNA,进而在T7核糖核酸聚合酶作用下,以反转录的cDNA为模板进一步合成DNA完成mRNA的扩增。扩增后的产物通过人类血小板抗原法进行检测,该方法利用荧光探针特异性与扩增产物杂交,选择剂淬灭未杂交探针上的荧光以区分杂交和未杂交探针,光度计测量杂交混合物上的荧光光量子,通过分析物的信号与截点比值来进行结果判定。
1.3.2.3 Aptima HPV-GT检测 对Aptima HPV检测阳性的标本,进一步采用Aptima HPV-GT检测试剂盒对HPV 16型和HPV 18/45型进行分型检测,具体步骤按照其说明书进行操作,由仪器自动检测4 h后查看检测结果。Aptima HPV检测阴性的标本视为Aptima HPV-GT检测阴性。
1.3.2.4 阴道镜检查及活检 宫颈充分显露后,使用4%醋酸溶液涂抹整个宫颈,全面观察后用碘液涂抹,再经充分观察,对白色病变、点状血管、碘不着色等可疑病变部位行多点取样及宫颈搔刮术。采集的活检组织使用甲醛固定处理,送至病理科进行活检:标本经脱水、组织包埋、切片、染色、封片后,由2位专业的病理诊断医师进行阅片诊断,诊断结果描述采用世界卫生组织三级分类法,分为无病变或炎症(NILM);低度鳞状上皮内瘤变(LSIL)包含CIN1和(或)宫颈湿疣;高度鳞状上皮内瘤变(HSIL)包含CIN2和(或)CIN3;癌(Ca)4组。
1.3.3 质量控制 对工作人员进行统一培训,妇科检查和阴道镜检查医师均有丰富的临床工作经验。细胞学诊断和病理学诊断均由福建医科大学附属闽东医院具有多年工作经验的医师完成。在研究开始前,召开阴道镜培训会和组织病理阅片会,统一病理判读标准。
1.4 统计学分析 采用SPSS 26.0软件进行统计学分析;计数资料以率表示,采用χ2检验比较Aptima HPV检测和TCT检查对组织学诊断≥HSIL的筛查价值。以P<0.05为差异有统计学意义。
2 结果
2.1 HPV感染与年龄关系 本研究参与者的平均年龄(47.51±12.39)岁(26~84岁)。该人群HPV16阳性率为13.56%(32/236),HPV18/45阳性率8.47%(20/236),HPV16、18/45阳性率1.27%(3/236)。不同年龄段的HPV阳性率79.55%(20~30岁),56.70%(31~40岁),55.70%(41~50岁),53.97%(51~60岁),70.73%(≥61岁)(图1)。HPV感染率呈双峰型趋势,30岁以下达高峰,61岁之后再次升高。不同年龄组的HPV感染率差异有统计学意义(χ2=25.30,P<0.0001)。
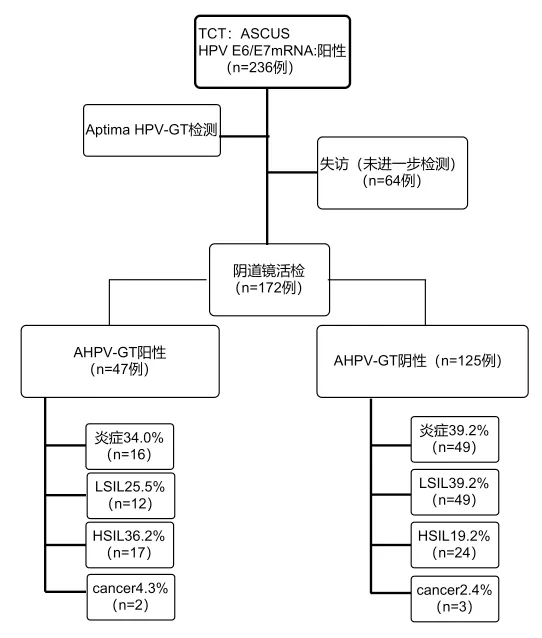
图1 HrHPV阳性ASCUS病例流程图
2.2 HPV检测流程 本研究中TCT为ASCUS,AHPV阳性者共236例,其中失访人员(未进行阴道镜检查)为64例,占27.12%。进行阴道镜活检患者为172例。在AHPV-GT阳性者中HSIL占36.17%(17/47),宫颈癌占4.26%(2/47)。而AHPV-GT阴性者中HSIL占19.20%(24/125),宫颈癌占2.40%(3/125),二者差异具有统计学意义(χ2=5.906;P=0.0151)。AHPV-GT阳性患者中,HPV16、18/45均阳性患者3例,其中2例行阴道镜活检,病理结果皆为CIN2+,比例为1.16%(2/172)、100.00%,HPV16 阳性为6.40%(11/172),HPV 18/45阳性为3.49%(6/172)。见表1。
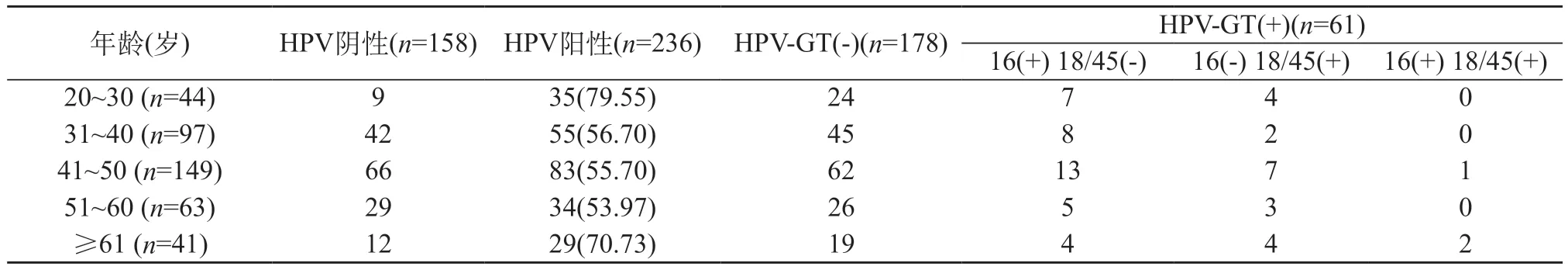
表1 ASCUS患者HPV感染与年龄的关系
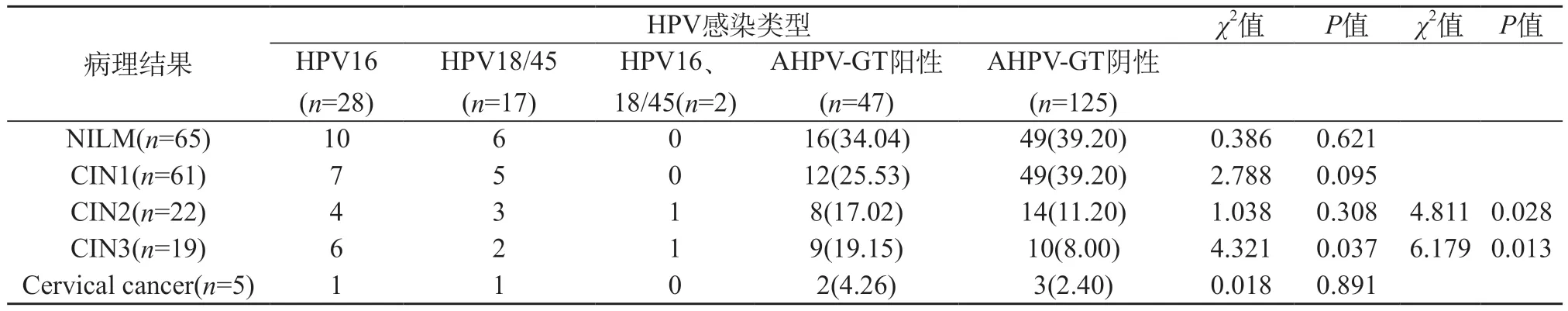
表1 阴道镜检查ASCUS/HPV阳性女性细胞学结果
2.3 ASCUS/AHPV-GT阳性对比ASCUS/AHPV-GT阴性 病理结果为NILM(χ2=0.386,P=0.621)、CIN1(χ2=2.788,P=0.095)、CIN2(χ2=1.038,P=0.308)的发病率上无显著差异。其中ASCUS/AHPV-GT阳性时CIN2+、CIN3+、宫颈癌发病率分别为40.5%、23.5%、4.3%,而ASCUS/AHPV-GT阴性患者该发病率相应为21.6%、10.4%、2.4%。CIN2+(χ2=4.811,P=0.028)、CIN3+(χ2=6.179,P=0.013)发病率差异具有统计学意义。
3 讨论
3.1 宫颈癌是一种众所周知的、可预防的恶性肿瘤。ASCUS是一个模糊的术语,是一种排除性诊断,提示有疾病风险,而不是异常病变的明确诊断。对于有ASCUS的女性,如果诊断不明确或不及时,会延误最佳治疗;另外,过度的诊治不仅会给妇女带来身体和心理上的负担,还会造成不良的妊娠结局[4]。对于ASCUS的细胞学处理的目的是发现可能出现高级别病变甚至潜在宫颈癌的患者[5]。然而,对于这些情况,没有一种全球可接受的战略。对于ASCUS的处理包括重复细胞学检查、阴道镜检查和(或)HPV检测。ASCCP建议对宫颈细胞学结果为ASCUS的患者进行HPV检测,如果HPV检测结果呈阳性,则建议进行阴道镜检测[6]。如果HPV检测结果为阴性,则建议在3年随访时进行重复检测。如果无法进行HPV检测,则可在1年后再次进行细胞学评估,如果重复细胞学检查再次发现ASCUS,建议进行阴道镜检查[7]。
3.2 在本研究中,如果ASCUS/HPV阳性,则对所有转至本研究诊所的患者进行阴道镜检查。本研究表明,细胞学为ASCUS女性中,HPV感染率与年龄呈双峰型趋势,HPV感染高峰出现在30岁以下,随年龄增长逐渐下降,到中年处于平台期,61岁后开始逐渐升高。而从全球数据来看,HPV感染高峰出现在25岁以下,随年龄增长逐渐下降,到中年处于平台期,65岁后略有上升。我们数据与全球数据趋势相似。我们发现的两个峰值模式可能部分归因于HPV感染的自然史[8]。
3.3 目前的管理指南不推荐患有ASCUS的女性进行HPV基因分型[9]。然而,由于HPV 16相关的宫颈疾病风险非常高,即使在阴道镜检查时没有发现病变,HPV 16阳性的女性在未来发展为宫颈疾病的风险更高。本研究中ASCUS/HPV阳性患者中,HPV16阳性率为13.56%(32/236),且CIN2+检出率39.29%(11/28)。HPV18/45阳性率8.47%(20/236),CIN2+检出率35.29%(6/17)。HPV16、18/45阳性率1.27%(3/236),CIN2+检出率100.00%(2/2),失访1例,ASC-US/AHPV-GT阳性CIN2+及CIN3+检出率明显高于ASCUS/AHPV-GT阴性,具有统计学意义(χ2CIN2+=4.811,P=0.028;χ2CIN3+=6.179,P=0.013)。ASCUS患者进行HPV16、18/45分型是有意义的。
3.4 在中国,近一半被诊断为侵入性宫颈癌的女性从未接受过筛查,另外一部分癌症病例发生在过去5年未被追踪的女性中[10]。本研究失访率达27%,可能与该研究为福建一少数民族占多数的欠发达地区,民众对相关知识的匮乏、经济文化水平等相关。对细胞学为ASCUS,HPV16、18/45均阳性患者可考虑进行快速治疗。对AHPV-GT积极治疗,特别是欠发达的农村地区,减少宫颈高级别以上病变的失访[11]。随着基因分型分析的出现,可以识别出更多的个体高危型HPV基因型,基于风险的管理指南可能会更新[12-15]。
3.5 作为一项回顾性观察分析,我们对数据的解释存在一定的局限性,如对实际有细胞学和hrHPV结果以及随访活检结果的女性数据的选择偏倚。因此,我们的研究更有可能反映现实世界的实践。未来的研究将集中在使用更新的HPV检测方法的相对优势上,这些方法可以提高宫颈高级别病变检测的特异性,从而为女性提供最有效的宫颈癌筛查策略。
综上所述,HPV E6/E7 mRNA可用于 ASCUS人群分流。基于本次研究和其他国内外研究结果,建议采用HPV E6/E7 mRNA检测对ASCUS人群分流同时进行AHPV-GT检测,如HPV E6/E7 mRNA检测阳性,患者可直接转诊阴道镜检查,且密切随访;若HPV16、18/45均阳性患者可考虑进行快速治疗,如HPV E6/E7 mRNA检测阴性,临床医师观察宫颈处无异常,可以按照筛查指南,再次纳入常规的宫颈癌筛查人群进行随访。

