新生大鼠原始卵泡凋亡与PI3K/Akt/Foxo3a信号通路的相关性
赵粉琴 丁晓南 安明霞 张小花 贾学玲
1.甘肃中医药大学(兰州,73000);2.兰州大学第一医院
卵巢的内分泌和生殖功能主要与卵巢内原始卵泡贮备量有关,原始卵泡发育异常或者卵泡发育信号通路异常都会导致卵泡发育障碍,出现卵巢功能早衰(POF)或者早发性卵巢功能不足(POI)[1]。原始卵泡储量与个体的生育年限成正比[2],自然绝经[3]或者医源性因素[4]POF是耗竭或者原始卵泡闭锁的结果。磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)/叉头盒框(Foxo3a)(PI3K/Akt/Foxo3a)通路对细胞的增殖、周期和衰老起中心调控作用[5],也参与卵巢老化、卵泡发育和卵母细胞成熟的调控[6-7],但是对原始卵泡“静息”维持、发育启动研究较少。基于此,本研究采用7日龄大鼠卵巢组织体外培养,采用PI3K激动剂和抑制剂分别刺激,观察原始卵泡发育以及细胞周期蛋白表达,进一步明确PI3K/AKT信号通路在原始卵泡激活的作用机制。
1 材料和方法
1.1 实验动物及试剂
1.1.1实验动物50只SPF 级 SD 雌性大鼠,7日龄,体重6.5~10.5g,由甘肃中医药大学实验动物中心提供[许可证号:SYXK(甘)2015-0005]。
1.1.2主要试剂RPMI1640培养液(Gibco公司),胎牛血清(Gibco公司),IGF-1(R&D system)、LY294002(sigma)、Akt(SantaCruz)、磷酸化Akt(SantaCruz)、Foxo3a(Abcam)磷酸化Foxo3a(Abcam)蛋白单克隆抗体。蛋白电泳仪(Bio-rad)、核酸定量测定仪(Thermo,Nanodrop 2000)。
1.2 实验方法及检测指标
1.2.1卵巢的培养及分组取7日龄SPF级雌性大鼠,处死后取出卵巢,PBS漂洗2次。将卵巢转入细胞培养皿,培养基为MEM,100μg/ml青霉素、100μg/ml 链霉素。将培养的卵巢随机分为3组,对照组(n=10):MEM培养基;PI3K激活剂组(n=10):MEM培养基上加IGF-1 100ng/ml;PI3K抑制剂组(n=10):MEM培养基上加 20μmol/L LY294002。培养基置370℃,5% CO2孵化箱中,每36h更换1次培养液,总共培养7d。
1.2.2HE染色观察卵泡形态学取卵巢组织经石蜡包埋,连续做4 μm切片,HE染色,酒精脱色,二甲苯固定,中性树胶封片,静置 12 h。镜下观察各级卵泡。
1.2.3TUNEL法观察颗粒细胞凋亡按说明书操作,(520±20)nm 的荧光显微镜下观察绿色颗粒;在460 nm DAPI染色液观察蓝色颗粒,荧光显微镜照片以Merdg对调亡细胞叠加显色。经Image-Pro Plus 图像分析软件处理。光学显微镜下观察,阳性细胞(凋亡细胞)胞核为不均匀棕黄色,位于颗粒细胞和卵母细胞上。每个标本随机选取3张切片,每张切片在高倍视野下(×200)取5 个视野,计算5 个视野内颗粒细胞凋亡及总细胞数量,调亡指数(AI)=阳性细胞/总细胞数量×(%)。
1.2.4蛋白免疫印迹(WesternBlot)法检测卵巢组织p-AKT、p-FOXO3a、CDK2、P27、BCL-2及TAP63的表达取培养5d大鼠卵巢组织,提取总RNA,蛋白变性,转到PVDF 膜上,加入一抗(p-AKT、p-FOXO3a、CDK2、P27、BCL-2及TAP63,均为1∶1000 稀释)孵育,40℃封闭过夜。二抗(1:2000 稀释)孵育2 h,免疫荧光增强法显色,与GAPDH 的灰度比值表示。
1.2.5免疫组化法检测卵巢组织内p-AKT、p-FOXO3a、CDK2、P27、BCL-2及TAP63蛋白的在卵巢表达情况取固定好卵巢组织,切片,脱水。正常山羊血清封闭液室温作用30 min。倒掉封闭液后,滴加一抗工作液(1:100),40℃孵育过夜。分别滴加生物素化二抗(SP试剂盒)、三抗,分别室温作用30 min,再滴加DAB显色液(1:20)室温避光作用5 min,苏木素复染,酒精脱水,中性树胶封片。
1.2.6qRT-PCR检测PI3K、Akt、Foxo3a、Bcl-2、p27、Cdk2和Tap63mRNA表达量收集3组培养3,5,7d后的大鼠卵巢组织各3个样本,以RNA抽提试剂盒提取RNA。按照试剂盒要求进行qRT-PCR,以Gapdh为内参照。引物序列见表1。Real-time PCR用SDS2.1软件进行,选择相对定量模式,每个标本均作3个复孔,分析各孔Ct值,计算出标化后的-ΔCt值,目的基因的相对表达量2-ΔCt表示,含义是每个样本的基因的表达相对于内参Gapdh基因表达的倍数。再以通过公式2-ΔCt计算出得样本基因相对表达量,最后使用计算得到的相应基因的值。

表1 PCR引物序列
1.3 统计方法
2 结果
2.1 卵巢组织病理学
对照组可见的初级卵泡有卵母细胞,内见圆形的细胞核,包绕的颗粒细胞排列规则。激动剂组可见初级卵泡有卵母细胞,颗粒细胞1层和2层,细胞排列整齐;抑制剂组可见初级卵泡,卵母细胞凋亡细胞核消失。见图1(1458页)。
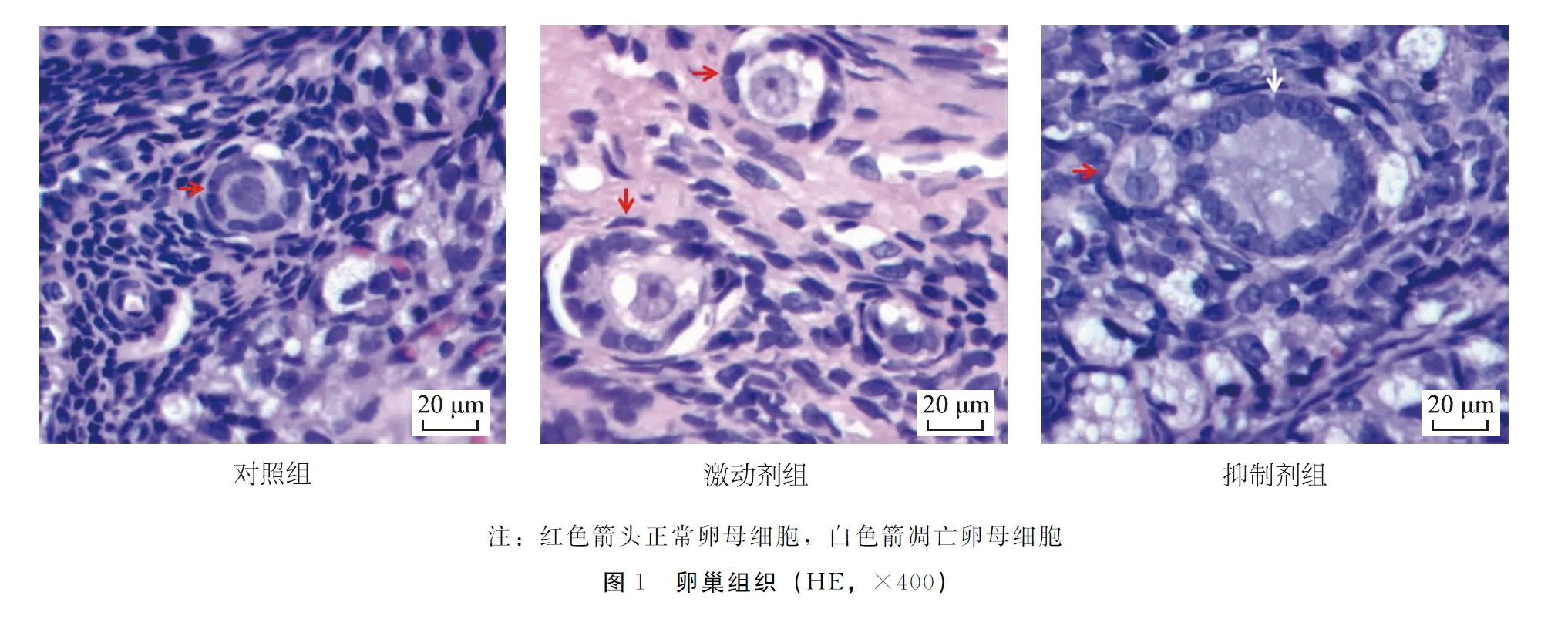
2.2 卵巢凋亡率
凋亡细胞是卵泡的卵母细胞及颗粒细胞,荧光显示凋亡细胞为绿色颗粒。与对照组比较,激动剂组和抑制组荧光增强,区域增大,卵巢凋亡率分别为(8.78±3.67)%、(12.33±5.29)%,较对照组(4.11±2.15)%均明显升高(P<0.05);与抑制剂组比较,激动剂组荧光减弱,区域缩小,卵巢组织凋亡率降低(P<0.05)。见图2(1458页)。

2.3 培养5d大鼠卵巢组织内蛋白表达
2.3.1p-AKT、p-FOXO3A和CDK2蛋白含量比较激动剂组大鼠卵巢组织p-AKT、p-FOXO3A和CDK2蛋白表达增加(P<0.01,0.05),而抑制剂组大鼠卵巢蛋白表达减少(P<0.01,0.05)。见表2、图3,4(1459页)。

表2 各组卵巢组织p-AKT、p-FOXO3A和CDK2蛋白表达的比较


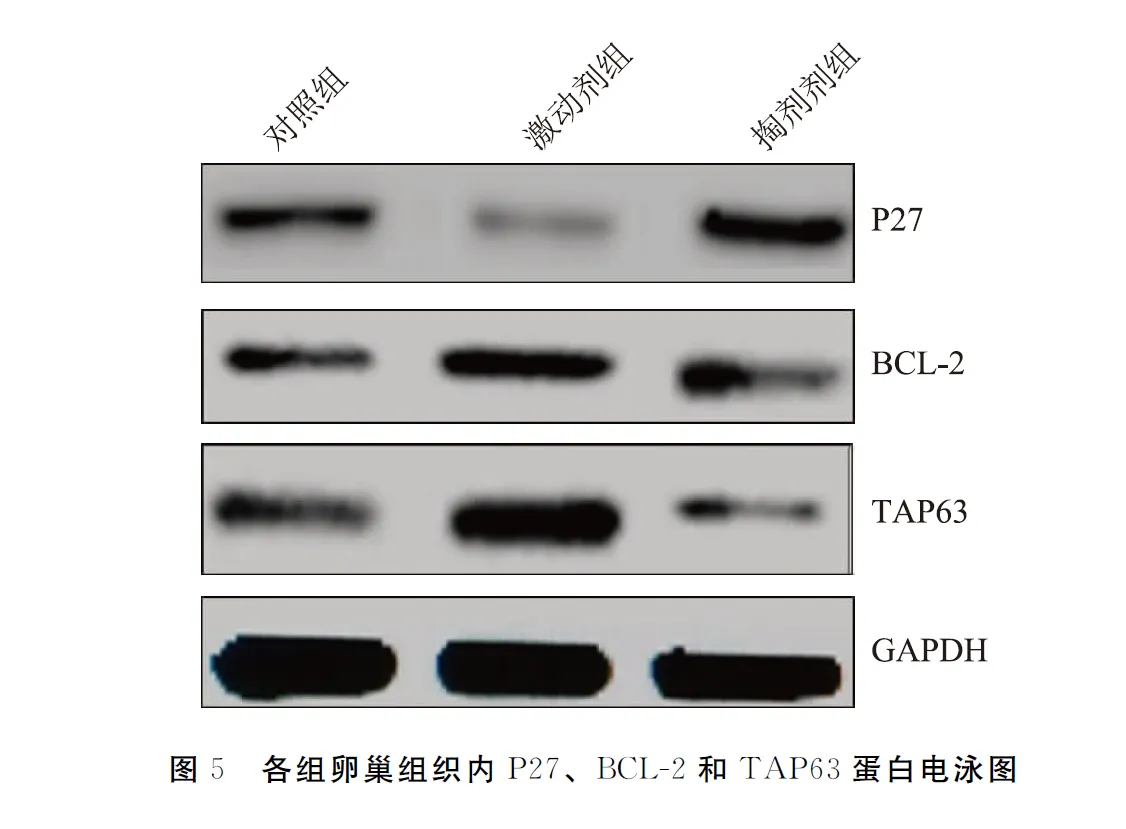
2.3.2各组卵巢组织内P27、BCL-2和TAP63蛋白含量比较见表3、图5,6(1460页)。结果显示IGF-1对大鼠卵巢组织BCL-2和TAP63蛋白表达有促进作用,对P27有抑制作用(P<0.05),而LY294002对BCL-2和TAP63蛋白表达有抑制作用、对P27有促进作用(P<0.05)。

表3 各组卵巢组织P27、BCL-2和TAP63蛋白表达的比较
2.4 卵巢组织不同时间段PI3K、Akt、Foxo3a、Bcl-2、p27、Cdk2和Tap63 mRNA相对表达量
激动剂组大鼠卵巢组织PI3K、Akt、Foxo3a、Bcl-2、p27、Cdk2和Tap63mRNA相对表达增加,优于对照组和抑制剂组(P<0.05),且以第5天最显著(P<0.05),之后逐渐下降,第7天达到最低(P<0.05)。见表4。

组别 只Cdk23d 5d 7d Tap633d 5d 7d 对照组 31.47±0.640.91±0.322.23±1.601.14±0.130.50±0.020.20±0.03激动剂组 311.40±4.35*4.83±1.28*12.18±4.91*3.12±0.70*5.79±2.48*10.24±1.51*抑制剂组 30.58±0.08#0.29±0.11#0.16±0.07#0.21±0.04#0.67±0.02#0.07±0.06#
3 讨论
卵巢的颗粒细胞是卵母细胞的营养细胞,与卵母细胞相互作用共同调节卵泡成熟、排卵和受精过程[8]。原始卵泡则是卵泡发育的起点,原始卵泡激活调控异常就会出现卵泡闭锁,影响原始卵泡储备量,导致卵巢早衰[9]。在卵母细胞发育过程中,激活PI3K会使Akt磷酸化,向卵母细胞核内转移使叉头框蛋白(FOX)家族成员之一的Foxo3a过度磷酸化,一方面解除对原始卵母细胞抑制作用,原始卵泡被激活,而过度过早发育,原始卵泡储备量减少,导致POF发生[10-12],另一方面激活PI3K/Akt/Foxo3a信号通路,可以使休眠的原始卵泡被激活,进入生长阶段,发育成有能力的卵母细胞[13]。
卵巢整体性的环境变化显然对于卵泡的生长发育有着明显的影响,然而相关研究目前较为欠缺[14]。为了证实PI3K/Akt信号通路对原始卵泡发育的影响作用,本研究采用7日龄大鼠卵巢组织体外培养,研究方法仍然借鉴[15-18]培养方法,使用PI3K/Akt信号通路激活剂和抑制剂进行干预,研究发现PI3K通路激活剂(IGF-1)促进原始卵泡生长,同时卵巢组织p-AKT、p-Foxo3a、CDK2、TAP63和Bcl-2蛋白高表达,尤其是在培养第5天卵巢组织PI3K、Akt和Foxo3a达到高峰,第7天卵巢组织CDK2、TAP63和Bcl-2蛋白表达达到高峰,之后逐渐下降。而卵巢内p27蛋白低表达,在培养第7天达到最低。说明PI3K/Akt/Foxo3a通路激活剂(IGF-1)促进卵泡发育存在时间节点性,PI3K激活剂(IGF-1)促进卵泡发育在培养第5天作用最强,之后降低,而细胞周期蛋白CDK2和TAp63主要与促进细胞周期凋亡[19-20]有关,所以其表达较PI3K/Akt/Foxo3a信号通路有滞后现象。原始卵泡中FOXO3a磷酸化启动p27Kip1,促进原始卵泡发育,所以p27Kip1对保持原始卵泡的休眠状态至关重要[21],POF卵巢组织出现p27低表达[22]。本研究结果与Wang等[23]研究在p27缺陷(p27(-/-)小鼠中,卵巢中过度激活的卵泡池大部分被耗尽,导致卵巢早衰。p27负向调控细胞周期依赖性蛋白激酶抑制因子(CDKI),抑制原始卵泡发育启动以及闭锁,保持原始卵泡储量[24-25]。同时预测卵泡的发育以及成熟应该与卵母细胞内cAMP的水平有关[26],有待于以后的研究。
综上所述,卵巢功能的下降是导致现代女性不孕的重要病因之一[27]。探讨促进卵泡发育,抑制其闭锁的分子机制就显得尤为重要。PI3K/AKT信号通路在卵母细胞生长、生存和卵母细胞质量方面有着重要作用。他们共同协调着卵泡的生长、发育、成熟过程。本实验也发现可能由于卵泡发育环境改变,卵巢体外培养,组织缺氧坏死,卵母细胞凋亡,个别卵巢组织破碎,影响实验结果。有待于以后实验中采用卵母细胞培养,进一步观察PI3K/Akt 信号通路激动剂对大鼠原始卵泡发育的影响。

