足月单胎初产妇因产时发热行中转剖宫产危险因素分析
刘 芳 侯 磊 王 欣
首都医科大学附属北京妇产医院/北京妇幼保健院(100026)
产时发热与不良妊娠结局相关,包括需要进行剖宫产或器械分娩、低新生儿评分(Apgar评分)、需辅助通气、高新生儿重症监护病房(NICU)入院率等[1-3]。根据本院2019年的数据,产时发热是位居第三的中转剖宫产手术指征,仅次于胎儿窘迫和相对头盆不称。据以往国内外研究,中转剖宫产的主要风险因素为产妇年龄、体质指数(BMI)、孕龄、引产及胎膜早破等[4-5],本研究拟通过分析本院以产时发热为主要手术指征的中转剖宫产病例,讨论产时发热中转剖宫产的危险因素,探讨如何降低产时发热发生率。
1 资料与方法
1.1 研究对象
本研究采用回顾性病例对照研究,纳入2019年1月1日—2019年12月31日本院全部足月单胎头位初产妇阴道试产中转剖宫产病例1073例,因产时发热为剖宫产指征的172例作为观察组,因其他指征剖宫产者901例作为对照组。
1.2 研究方法
1.2.1病例资料收集产妇一般资料、孕期情况、催引产情况及产程干预措施,收集新生儿资料及分娩结局。
1.2.2标准和定义①临产:规律宫缩伴随子宫颈管消失和胎头下降。②将产程中体温≥37.5℃记为产时发热。③产程处理时限:参照2014新产程标准及处理的专家共识[6],同时存在2项以上剖宫产指征时记录首要剖宫产指征。

2 结果
2019年1月1日—12月31日SG 院总分娩数为15 314例, 其中足月单胎头位初产进行阴道试产并中转剖宫产1073例(7.0%),以产时发热为主要剖宫产指征172例,占全部中转剖宫产的16.0%。
2.1 一般资料
观察组产妇年龄、身高、孕前BMI、分娩前BMI、孕期增重、孕次、孕龄与对照组相比无统计学差异(P>0.05);观察组新生儿体重[3647.50(3343.75,3850.00)]g显著大于对照组[3495.00(3250.00,3782.50)]g,修正后OR=1.00(95%CI 1.000~1.001),P=0.014。见表1,表2。观察组产后出血量510(400,550)ml,对照组产后出血量520(400~550)ml,两组差异无统计学意义(P>0.05);观察组产褥病率发生率2.9%(5/172),与对照组的 4.4%(40/901)比较,差异无统计学意义(P>0.05);观察组新生儿窒息发生率1.2%(2/172),对照组1.1%(10/901),两组差异无统计学意义(P>0.05)。通过比较两组分娩前末次感染相关化验得出,观察组白细胞计数12.06(8.86,15.30)×109/L显著高于对照组10.72(8.32,14.11)×109/L,差异有统计学意义(P=0.012);两组中性粒细胞绝对值、C反应蛋白、降钙素原均无统计学差异(P>0.05)。

表1 两组一般情况比较[M(P25,P75)]

表2 中转剖宫产的logistic多因素分析

项目OR95%CI修正后OR95%CI分娩孕周小1.2531.044~1.504新生儿体重高1.0011.000~1.0011.0011.000~1.001妊娠期高血压疾病0.4400.209~0.9230.4510.212~0.959
2.2 产妇妊娠合并发症
观察组中患妊娠期高血压疾病低于对照组,去除混杂因素后OR=0.45(95%CI 0.212~0.959);其余妊娠合并症及并发症两组均无差异。见表2,表3。

表3 两组产妇妊娠合并症及并发症发生情况比较[例(%)]
2.3 促宫颈成熟、引产及产时情况
两组水囊促宫颈成熟、前列腺素类药物促宫颈成熟、缩宫素引产等使用率均无统计学差异(P>0.05)。观察组分娩镇痛使用率高于对照组(OR=2.41,95%CI 1.34~4.34)。观察组分娩镇痛时长8.59(6.32,11.20)h,对照组分娩镇痛时长9.38(5.87,12.80)h,差异无统计学意义(P>0.05)。其余产时干预包括人工破膜、缩宫素加强宫缩、应用分娩球等,两组均无明显差异。见表2,表4。
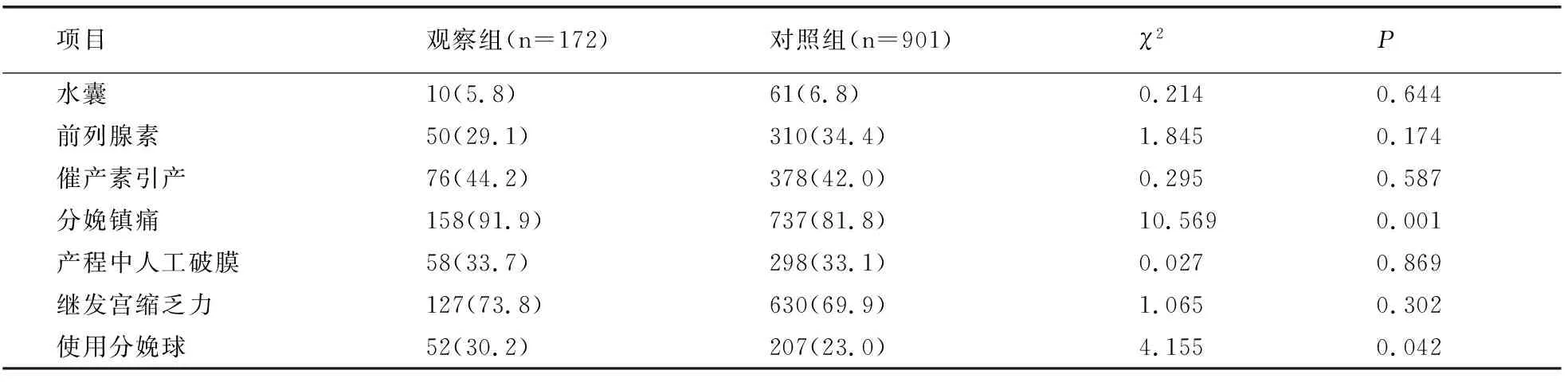
表4 两组引产及产程干预比较[例(%)]
3 讨论
产时发热是产程中转剖宫产的主要指征之一,但发热原因十分复杂:产程中产妇平滑肌、骨骼肌收缩作功致产热增多;宫缩疼痛致入量受限,可能存在不同程度的脱水;椎管内镇痛,药物性发热等;生殖道定植的B族链球菌以及其他条件致病菌导致的生殖道感染、宫腔感染等都可能造成体温上升。其中宫腔感染最为棘手,宫腔感染常常继发于胎膜早破,临床表现发热、母体心率过快,胎心监护基线上升、短变异消失,子宫压痛或羊水有异味等,如果不及时终止妊娠可能造成产妇和新生儿严重感染。因此临床医生在产程处理中一旦发现产妇发热,为避免发生不良结局,常积极施行剖宫产终止妊娠,造成一些非感染性发热的产妇接受了剖宫产。
一项分析产时发热程度及其因素的研究显示,产时发热的两大主要原因是分娩镇痛和绒毛膜羊膜炎[7],绒毛膜羊膜炎引起的发热为感染性发热,可以分为临床型绒毛膜羊膜炎(CCA)和组织型绒毛膜羊膜炎(HCA),HCA需要羊水或胎盘病理确定,具有滞后性、隐匿性,其发生率占全部绒毛膜羊膜炎的10%~57%,与新生儿不良结局(肺炎、脑膜炎、败血症等)相关,若临床识别不及时可能会延误病情[8-11]。分娩镇痛引起的产时发热称为硬膜外相关产时发热(ERMF),为非感染性炎症,多数体温<38℃,产妇未出现心率加快等不适症状或体征,白细胞、中性粒细胞比值无显著升高,胎心率基线较前相差不大,通过增加饮水、适量补液体温可在短时间内恢复正常。研究也显示产时体温37.5℃~38℃与分娩镇痛的相关性大于产时体温≥38℃的患者[7];产时体温≥38℃与不良新生儿结局相关,包括低Apgar评分,NICU入住率、酸中毒及需要机械通气等,产时发热持续时间与母体不良结局有关,尤其是需要中转剖宫产者[12]。本研究中产时体温≥38℃产妇占比52.3%(90/172),显然部分发热产妇的症状体征并没有达到CCA的诊断标准,但在产程中合并母体心率加快、胎心率过快、白细胞计数显著增加或胎粪污染羊水等,也被认为可疑绒毛膜羊膜炎,均被较为积极地选择中转剖宫产结束分娩。
本研究分析了产时发热中转剖宫产的危险因素,结果表明分娩镇痛是产时发热的独立危险因素,产时行分娩镇痛的产妇发生产时发热行中转剖宫产的风险是未行分娩镇痛产妇的2.4倍。国内外大量研究也表明分娩镇痛导致了产时发热发生率上升[13],分娩镇痛是产时发热的独立危险因素[14],这一现象的机制尚且不明确,较为公认的理论是非感染性炎性因子的释放改变了体温调节的机制。Goetzl等[15]的研究显示,与行硬膜外镇痛后未发热的产妇相比,行硬膜外镇痛后产时发热者母体中白细胞介素(IL-6)水平升高,脐带血中白细胞介素水平也增加,这一发现解释了硬膜外镇痛引起的产时发热是非感染性炎症。
虽然分娩镇痛可能引起产时体温上升,但分娩镇痛很大程度上缓解了宫缩疼痛,减轻了产妇对于分娩的恐惧以及产程中的不舒适,目前也有许多学者致力于研究对母婴影响更小的分娩镇痛方式,比如有研究显示与0.1%罗哌卡因注射联合0.5mg/ml舒芬太尼注射液的给药方式相比,0.075%罗哌卡因注射联合0.5mg/ml舒芬太尼注射液的给药方式可以缩短第二产程持续时间,降低产时发热发生率[16]。也有研究显示间歇硬膜外推注联合患者自控硬膜外镇痛的给药方式下,与以5ml脉冲剂量间隔30min后给药30min的方式相比,以10ml脉冲剂量间隔60min,给药60min的方式减少了产时发热的发生,并且起到了更好的镇痛效果[17]。也有研究提出可以通过用系统性炎症参数淋巴细胞比率(LYM)、 中性粒细胞计数(NEUT)、 血小板淋巴细胞比值比(PLR)、 中性粒细胞淋巴细胞比值比(NLR)等联合检测对ERMF和HCA进行早期识别[18],避免过度干预或延误病情。
以往研究发现产妇年龄、身高、BMI、孕期增重、分娩孕周、胎儿大小均为中转剖宫产的影响因素[4,19-20],引产及产时干预(人工破膜、缩宫素加强宫缩等)增加中转剖宫产风险[21],这些影响因素主要与产程停滞和产程中发现的头盆不称有关,与产时发热并无直接关系。本研究中观察组新生儿体重显著大于对照组,可能由于胎儿偏大,存在头盆不称,产程进展缓慢且产程时限较长,这部分患者可能接受了更多的阴道操作和检查,羊膜腔内部持续暴露更长,大大增加了产时发热或感染的风险。本研究还发现观察组合并妊娠期高血压疾病的比率显著低于对照组,可见妊娠期高血压疾病是产时发热中转剖宫产的保护因素,这可能与妊娠期高血压疾病患者均在产时使用了硫酸镁预防子痫有关,有研究发现镁离子是产时发热的保护因素,接受镁离子治疗的产妇产时发热发生率更低[22]。
最后,本研究比较了产妇及新生儿结局,两组产后出血、产褥病率无显著性差异,两组新生儿窒息率也无显著性差异,可见本研究中产时发热并不增加中转剖宫产患者出现母婴发病风险。此外笔者也收集了所有产时发热患者的胎盘病理结果,对比了体温<38℃和≥38℃的胎盘病理,几乎所有胎盘病理提示炎症细胞浸润绒毛膜板以及羊膜,少数累及胎膜,对比结果无明显差异,因此临床上产时发热确实与宫内感染难以鉴别。对于分娩镇痛以后出现产时体温升高,尤其是体温<38℃,胎儿宫内情况良好的患者,可以积极给予补液降温、预防感染的同时,继续期待治疗,可能会在一定程度上减少产时发热中转剖宫产。分娩镇痛是产时发热的独立危险因素,妊娠期高血压疾病是产时发热中转剖宫产的保护因素,产程中发热时应该综合评估母婴情况,避免过度干预、也避免延误诊治。

