体外诱导猪颗粒细胞黄体化方法的比较研究
吕嘉顺,程佳瑞,张瑞门,邹超霞,安 强,李鹏举,韦 瑶,邓彦飞,韦英明
(1.广西大学动物科学技术学院,亚热带生物资源保护利用国家重点实验室,广西南宁 530004;2.广西大学农牧产业发展研究院,广西南宁 530004)
母猪黄体发育不全作为母猪繁殖障碍的关键障碍之一,是亟待解决的重要繁殖障碍。目前,母猪黄体发育不全的病因尚不清楚,可能与黄体发育过程中的颗粒细胞黄体化有关[1-3]。因此需要进一步研究颗粒细胞黄体化的机制,为解决母猪黄体发育不全提供理论基础。
在体外成功构建一种猪颗粒细胞黄体化模型对研究猪的颗粒细胞黄体化尤为重要。Li 等[4]使用含10%胎牛血清(FBS)的培养基正常培养牛颗粒细胞48 h,牛颗粒细胞发生黄体化,未对其进行验证;Zhang 等[5]也使用同样的方法培养山羊颗粒细胞48 h 使其黄体化,并使用了油红O 和ELISA-P4进行验证;Bruce[6]提出P450scc和STAR是黄体化的重要标志性基因;Richards等[7]提出颗粒细胞黄体化是一个很快速的过程,在LH峰作用下4 h 内颗粒细胞就发生黄体化;Sugino[8]给小鼠注射人绒毛膜促性腺激素(HCG)来使小鼠排卵和产生黄体,发现颗粒细胞黄体化后,STAR和CYP19A1表达显著降低,推测其与DNA 甲基化有关;谭淇蔓[9]、李南燕等[10]在体外使用1.0 IU/mL HCG 诱导24 h 可成功使小鼠颗粒细胞黄体化;Fadhillah 等[11]发现使用2 μg/mL 胰岛素(Insulin)诱导24 h 可使牛颗粒细胞黄体化。武秀峰等[12]也发现胰岛素可增加人颗粒细胞上LHR 的表达,使颗粒细胞黄体化。
综上,体外诱导颗粒细胞黄体化的方法有3 种,分别是用10% FBS 培养基培养颗粒细胞的自然培养法、HCG 法和胰岛素法,但哪种方法可成功使猪颗粒细胞黄体化未见定论。本研究选择这3 种方法对猪颗粒细胞进行诱导,并从孕酮(P4)含量、细胞活力和黄体化相关基因表达差异等方面进行比较,为后续开展颗粒细胞黄体化的机理的研究提供细胞模型。
1 材料与方法
1.1 卵泡颗粒细胞的培养 猪卵巢取自鲁班路肉联厂180 日龄左右的健康商品母猪。收集卵泡发育好的卵巢,置于37℃盛有含 2%青链霉素的生理盐水的保温杯中,于2 h 内带回实验室。用37℃无菌生理盐水冲洗卵巢3~4 次后,用灭菌纱布拭干卵巢表面水分,选取直径为3~6 mm 的卵泡,用10 mL 注射器配10 号针头抽取卵泡液(注意避开血管),用提前烧好的捡卵针将上述操作获得的卵泡液中的卵母细胞挑出,收集已挑出卵母细胞的卵泡液,用细胞筛(40 μm)过滤掉多余杂质,收集液体,低速离心(1 200 r/min)3 min,弃上清,用PBS 重悬清洗2~3 遍,用含10% FBS、2%青链霉素的DMEM 重悬细胞,置于37℃,5% CO2环境下培养。
1.2 主要试剂 Trizol 试剂购自Invitrogen 公司,HCG购自宁波第二激素厂,DMEM 高糖基础液体培养基(GIBCO)、胎牛血清(FBS,GIBCO)、胰酶等均购自Life 公司,1%青霉素/链霉素,胰岛素均购自北京索莱宝公司,FSHR 抗体购自万类生物科技公司,猪孕酮ELISA 试剂盒购自武汉华美生物工程有限公司,CCK-8 试剂购自诺唯赞生物科技有限公司。BD pharmingen FITC Annexin V Apoptosis Detection Kit1购自BD 生物科技公司。
1.3 引物设计 应用Oligo 7.0 软件设计引物,用于荧光定量PCR 实验,具体信息如表1 所示。引物由上海生工生物工程有限公司合成。
1.4 黄体化处理
1.4.1 自然培养方法 将收集到的颗粒细胞按上述方法在37℃,5%CO2细胞培养箱中培养0~3 d。
1.4.2 HCG法分别添加3、5、10 IU/mL 和20 IU/mL HCG 于猪颗粒细胞培养液中,培养1 d 后,用猪孕酮ELISA 试剂盒检测孕酮含量,选择P4含量最高的那一组作为最佳浓度,继续培养2 d,并检测每天的孕酮含量,选择P4含量最高的培养天数作为最佳培养时间。依据最佳浓度和最佳培养时间确定最终处理方法。用QRTPCR 检测黄体化相关基因CYP11A1、STAR、HSD3B1的表达。
1.4.3 Insulin 法分别添加1、2、4 μg/mL 和8 μg/mL的Insulin 于猪颗粒细胞中,培养1 d 后,用猪孕酮ELISA 试剂盒检测P4含量,选择P4含量最高的那一组作为最佳浓度,分别培养1、2、3 d 并检测每天的P4含量,选择P4含量最高的培养天数作为最佳培养时间。依据最佳浓度和最佳培养时间确定最终处理方法。用QRTPCR 检测黄体化相关基因CYP11A1、STAR、HSD3B1的表达。
1.5 细胞形态观察 采用3 种不同的方法处理细胞后,去除DMEM/F12 培养基,用磷酸缓冲盐溶液(PBS)洗去未贴壁细胞后在倒置显微镜下观察细胞状态差异并拍照记录。
1.6 细胞活力测定 将细胞接种至96 孔板中,按3 种方法处理后,按说明书向每孔中加入10 μL CCK-8,继续培养2 h 后用酶标仪在450 nm 波长下测吸光度,后根据说明书计算其细胞活力。
1.7 流式细胞术检测细胞凋亡 胰酶消化细胞后,室温离心(1 200 r/min)3 min,弃上清,1×PBS 洗涤。每组收集大约1×106个细胞,加入500 μL binding buffer,反复吹打均匀,分别添加5 μL PI 和AnnexinV-FITC,混匀后避光静置5 min,流式细胞仪检测细胞凋亡。
1.8 实时荧光定量PCR(QRT-PCR)检测黄体化相关基因STAR、CYP11A1和HSD3B1的表达,采用3 种不同的方法处理细胞后,弃去上清,用Trizol 法提取细胞RNA 后,进一步用反转录试剂盒制备cDNA。根据所得cDNA 进行 QRT-PCR,反应体系20 μL:SYBR qPCR MasterMix 10 μL,上下游引物各0.4 μL,cDNA模板1 μL,灭菌双蒸水8.2 μL。反应条件:预变性:60 ℃ 2 min,95 ℃ 3 min;变 性:95 ℃,15 s,退 火、延伸:60℃,1 min,循环36 个。根据获得的CT 值用GraphPad Prism 8 软件进行作图。所用引物序列见表1。

表1 荧光定量PCR 基因引物合成序列
1.9 免疫荧光法检测FSHR 的表达 细胞在培养24 h 后,弃掉培养基,用PBS 彻底清洗后,加入4%多聚甲醛,在4 ℃冰箱中固定30 min,用PBS 清洗3 遍(每次10 min)后,加入0.1%Triton-X-100 透化20 min,PBS清洗3 遍(每次10 min),用5%牛血清蛋白(BSA)室温封闭1 h,用抗FSHR 的抗体4℃孵育过夜。一抗孵育结束后,用PBS 清洗3 遍(每次10 min),室温孵育羊抗兔二抗1 h,用PBS 清洗3 遍(每次10 min),滴加DAPI 避光孵育5 min,用PBS 洗一遍后,在荧光显微镜下观察染色结果并拍照记录。
1.10 统计分析 每个实验重复3 次,统计分析采用SPSS17.0 软件,所有数值均以平均值± 标准误表示。两组间的统计学差异采用T 检验,超过两组的采用方差分析(ANOVA)。P<0.05 时记为差异显著。
2 结果与分析
2.1 颗粒细胞的鉴定 为验证收集的细胞是猪颗粒细胞,采用颗粒细胞的特异性抗原FSHR 作免疫荧光来验证,结果如图1 所示,FSHR 染色为阳性,表明所收集的细胞是颗粒细胞。

图1 FSHR 免疫荧光
2.2 黄体化处理结果 自然培养法:在体外环境下,连续培养猪颗粒细胞3 d,每天检测细胞培养液中P4含量,发现细胞培养液中P4含量持续下降(图2),说明细胞并未发生黄体化。HCG 法:在体外培养猪颗粒细胞中添加不同浓度的HCG,处理1 d 后检测细胞培养液中P4含量,结果显示5 IU/mL HCG 处理的颗粒细胞中分泌的P4含量最高;接着分别使用5 IU/mL HCG 培养颗粒细胞1、2、3 d,结果显示,处理2 d 组颗粒细胞中分泌的P4含量最高,因此,选择5 IU/mL HCG 处理2d 的猪颗粒细胞作为黄体化细胞模型用于后续实验(图3)。胰岛素法:在培养猪颗粒细胞过程中添加不同浓度的Insulin,处理1 d 后检测细胞培养液P4含量,结果显示2 μg/mL 胰岛素处理的颗粒细胞中分泌的P4含量最高;接着分别使用2 μg/mL 胰岛素培养颗粒细胞1、2、3 d,结果显示,随着天数增加,颗粒细胞中分泌的P4含量逐渐升高(图4)。因此,选择2 μg/mL 胰岛素处理3 d 的猪颗粒细胞作为黄体化细胞模型用于后续实验。
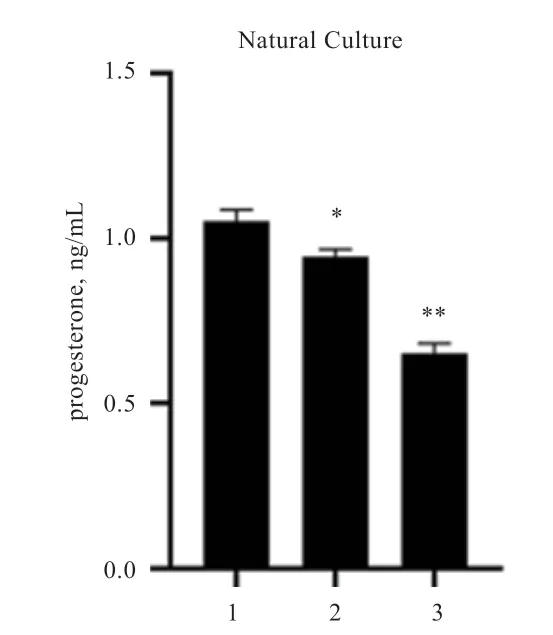
图2 自然培养法诱导颗粒细胞黄体化后P4 浓度

图3 HCG 处理颗粒细胞后P4 浓度
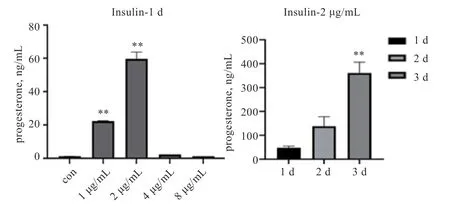
图4 胰岛素处理猪颗粒细胞后P4 浓度
2.3 不同方法所获细胞形态分析 采用自然培养法、HCG 法、胰岛素法3 种方法对颗粒细胞进行处理之后,细胞形态饱满,呈星状,放射状,与正常颗粒细胞形态无明显差异(图5)。

图5 3 种方法处理后的颗粒细胞
2.4 细胞活力检测 如图6 显示,培养2 d 后,以正常细胞为对照组进行比较发现,HCG 组的细胞活力降低(P<0.05),胰岛素组没有显著差异。
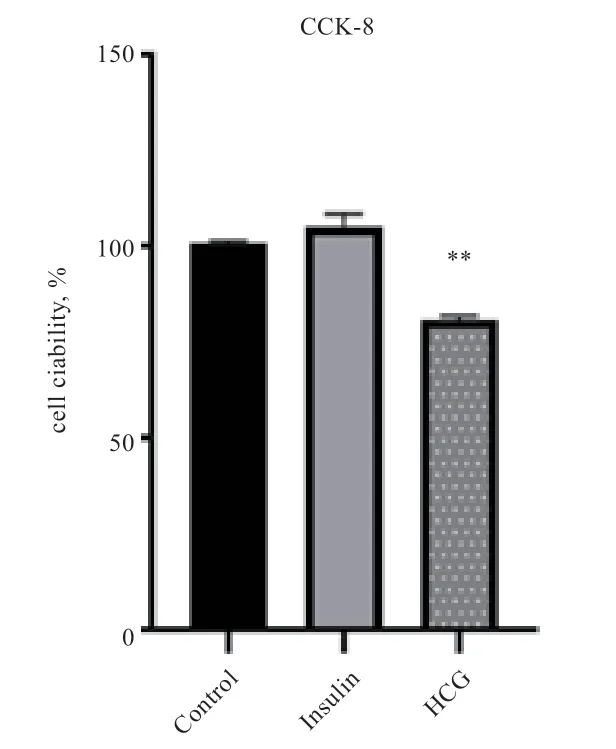
图6 Insulin 法与HCG 法对颗粒细胞活力的影响
2.5 黄体化相关基因的表达检测 如图7 所示,与对照组相比,HCG 组颗粒细胞中STAR显著上升(P<0.05),3β-HSD下降(P<0.05),CYP11A1没有显著差异;胰岛素诱导3 d 后的猪颗粒细胞中,3β-HSD和STAR下降(P<0.05),CYP11A1上升(P<0.05)。
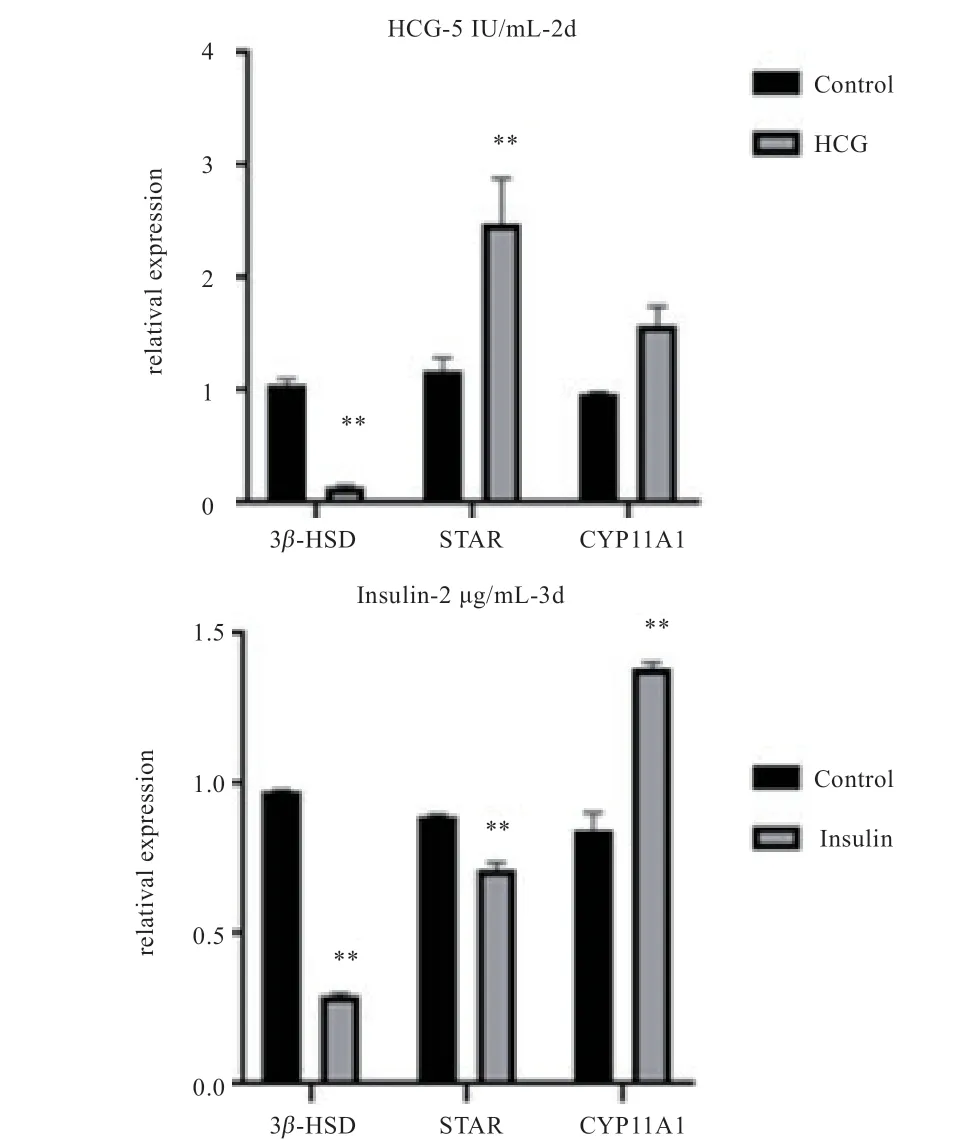
图7 QRT-PCR 技术检测2 种方法处理颗粒细胞后的黄体化基因的相对表达量
2.6 流式凋亡检测 如图8 所示,与对照组相比,5 IU/mL HCG 组凋亡率增加(P<0.05),2 μg/mL Insulin 组凋亡率降低(P<0.05)。

图8 流式细胞检测颗粒细胞凋亡率
3 讨 论
McRae 等[13]率先提出颗粒细胞黄体化的机制可能与颗粒细胞与卵母细胞之间的物质交换和信息交流有关,指出颗粒细胞分泌孕激素能力的增强和分泌雌激素能力的下降可被视为黄体化的标志,并将STAR、CYP11A1和3β-HSD视为黄体化的标志基因。Sugino[8]进一步研究发现颗粒细胞中STAR表达量显著上升和CYP19A1表达量显著下降也可作为黄体化的标志之一,并通过RNA-seq 技术预测了表观修饰在颗粒细胞黄体化过程中也具有重要作用。本实验使用含有10% FBS的培养基培养猪颗粒细胞3 d,发现其分泌的P4含量持续下降,认为猪颗粒细胞并未发生黄体化。而Zhang等[5]实验结果表明采取10% FBS 的培养基培养山羊颗粒细胞可使其分泌孕激素的能力显著增强,这与本实验结果相悖,可能是由于物种特异性等原因。本实验中,使用5 IU/mL HCG 诱导2 d 也可使猪颗粒细胞分泌大量P4,P4含量可达50~60 ng/mL,并且黄体化相关基因STAR、CYP11A1显著升高,3β-HSD显著降低,认为颗粒细胞也发生黄体化。与使用2 μg/mL 胰岛素诱导3 d后的猪颗粒细胞而言,后者的P4含量达到了300 ng/mL,胰岛素法处理后的猪颗粒细胞其细胞活力更高,凋亡率更低,更适合作为合适的细胞模型开展后续实验。本实验中,2 种方法处理后的猪颗粒细胞的STAR基因相对表达量变化趋势不一致,这与Fadhillah 等[11]使用胰岛素诱导牛颗粒细胞黄体化结果有些许差异,可能是由于物种特异性所致。查阅NCBI 上的猪的STAR基因的表达图谱可知,STAR在猪颗粒细胞上的表达本身就很低,不宜用作猪颗粒细胞黄体化的参考标志之一[14]。具体原因还有待后续实验的进一步研究。
本实验仅比较了3 种体外诱导颗粒细胞黄体化的方法,对于其他体外诱导颗粒细胞黄体化方法未进行比较,得到的结论具有一定的局限性。同时,对于颗粒细胞黄体化的验证标准还略显单薄,今后的研究可以利用转录组学等新兴技术筛选出更多颗粒细胞黄体化标志物,进一步丰富颗粒细胞黄体化的验证方法,深入研究颗粒细胞黄体化的机制,为解决母猪黄体发育不全提供理论基础[15]。
4 结 论
本次实验成功构建了体外诱导猪颗粒细胞黄体化的模型,弥补了体外诱导猪颗粒细胞黄体化的空白,利用ELISA、QRT-PCR 进行了黄体化验证,符合目前对于颗粒细胞黄体化的验证标准。实验利用CCK-8 和流式细胞术检测了细胞活力和细胞凋亡,最终确定了使用2 μg/mL 胰岛素诱导3 d 作为体外诱导猪颗粒细胞黄体化的最适方法。

