铜箔集流体表面聚苯胺复合改性研究
付红霞,肖仁贵,张云燕,廖 霞,杜 鑫
(贵州大学 化学与化工学院,贵州 贵阳 550000)
锂离子电池(LIB)由于循环稳定、能量密度高[1],被广泛应用于消费电子、动力电池及储能等领域[2],同时由于电动汽车的快速发展对锂离子电池的安全性、稳定性和能量密度提出了更高的要求[3]。LIB 主要由正极、隔膜、负极、集流体四个部分组成[4]。集流体是LIBs 的主要组件之一,用来维持电极和外部电路之间的电力传输,其几何形状和表面化学分子结构将影响电子转移速率[5],从而影响电池的电化学性能。
铜箔通常用于锂离子电池的负极集流体,作为电极材料、粘合剂和导电材料的载体[6]。但是由于铜箔表面比较光滑平整,接触面积不够大,且铜箔为金属材料,而电池一般为非金属材料,使得两种物质接触相容性差,界面接触电阻较大,导致电池充放电性能有所降低。所以,铜箔集流体的改性成为提高锂离子电池性能的有效方法之一[7-11]。Wang 等在铜箔集流体上制备了亲锂3D ZnO 纳米棒阵列,降低了局部电流密度,抑制了锂树枝晶的生长,在电流密度为5 mA·cm-2下循环200 次后,锂电池容量保持率可达到93%[12]。Jiang 等在铜箔表面采用LPCVD 技术制备了石墨烯薄膜[7],石墨烯表面改性可增加铜箔与电极材料的附着力,提高电池的循环稳定性。Wang 等使用简单的滴涂法在锂表面形成超分子PEO-UPY 共聚物锂阳极保护层,该共聚物作为一种稳定的人工固态电解质界面,可进一步减少铜箔集流体与锂的反应,形成致密的保护层,从而弱化锂枝晶的形成,提高锂金属阳极的循环稳定性[13]。Li 等设计了一种带有聚合物接枝的表面改性铜箔集流体,此集流体可以显著改善由平面锂金属镀层导致的锂电化学沉积[14]。这些研究工作主要从电池的安全性与循环稳定性方面做了进一步改善,但鲜有通过铜箔集流体改性既能提高电池循环性能,又能有效提高电池容量的报道。
聚苯胺最早在1834 年被发现[15],但它的导电特性直到1960 年才得以研究[16]。苯胺聚合通常采用电化学方法: 恒定电流法[17]、恒定电压法、循环伏安法[18]。在恒定电流下聚合得到的聚苯胺的粘附力较弱[19]。恒压法能得到均匀的聚合物膜,膜的粘附能力强[20-21],通过电压及电解质类型等实验条件,可控制其导电性[22]。苯胺的阳极氧化通常是在金、石墨、玻璃碳和不锈钢等不活泼的电极材料上进行[16],当活泼金属材料如铁、铜等用作聚苯胺聚合阳极材料时,金属在苯胺电化学聚合过程中会发生阳极溶解,金属电极的阳极溶解对聚苯胺的形貌、结构及性能产生重要影响[23]。因此,进一步研究在铜箔表面电化学制备聚苯胺工艺,探讨聚苯胺形貌结构与电化学聚合工艺参数之间的关系,以及聚苯胺形貌结构与铜箔集流体电化学性能之间的关系显得非常重要。
本文在前期恒流法制备复合铜箔集流体的基础上[17],通过恒压法在铜箔表面电化学制备聚苯胺改性集流体,探讨电压对聚苯胺形貌与结构的影响规律,以及改性铜箔集流体对电池容量及循环性能的影响。
1 实验
1.1 实验材料
高纯电解铜箔(纯度≥99.5%,8 μm);苯胺(阿拉丁);H2SO4(98.3%,重庆创东化工(集团)有限公司);商用Li4Ti5O12活性材料(深圳科景星科技有限公司);锂片(深圳碧源电子科技有限公司);隔膜(Celgard 2400)。
1.2 样品表征
采用Nicolet-iS5 型(Thermo Fisher Scientific)傅里叶变换红外光谱仪对电化学聚合产物进行官能团测试;采用UV-2700i 紫外光谱(Shimadzu)进行分子结构分析;采用Zeiss Sigma 扫描电镜表征复合材料表面形貌;循环伏安曲线(CV)和电化学阻抗谱(EIS)由VersaSTAT 3 电化学工作站(Princeton Applied Research)获得。
1.3 制备材料
1.3.1 聚苯胺的电化学聚合
聚苯胺的电化学聚合过程示意图见图1。在1 L 烧杯中配置0.05 mol/L 的H2SO4溶液和0.2 mol/L 的苯胺混合溶液构成电解液,用氮气驱氧15 min。铜箔为阳极,石墨板为负极,进行恒压法电化学聚合。电化学聚合后,用去离子水清洗铜箔表面,烘干备用。

图1 恒电压聚合法制备复合铜箔集流体示意图Fig.1 Fluid collection diagram of composite copper foil prepared by constant voltage polymerization
1.3.2 电池组装
分别用LiTi5O12(LTO)为活性材料,乙炔黑为导电剂,聚偏氟乙烯(PVDF)为粘结剂,N-甲基吡咯烷酮(NMP)为溶剂,将LTO、乙炔黑及PVDF 按照质量比8 ∶1 ∶1 均匀混合,制成一定黏度的浆料,并均匀涂覆在PANI/Cu 与Bare/Cu 集流体表面,在120 ℃下挥发NMP 溶剂得到LTO 电极。分别用空白铜箔(Bare/Cu)与复合铜箔(PANI/Cu)作集流体,LTO 为负极,LiPF6(溶剂体积比EC ∶DMC ∶DEC=1 ∶1 ∶1)作电解液,组装CR2032 纽扣电池,并使用蓝电系统(CT2001A,武汉)进行恒流充放电测试(1.0~2.5 V Li+/Li)。
2 结果与讨论
2.1 电压对聚苯胺膜层形貌结构的影响
在0.2 mol/L 苯胺单体和0.05 mol/L 硫酸溶液组成的电解质溶液中,常温恒压聚合10 min,在不同电压下聚合获得的铜箔表面聚苯胺膜层微观形貌见图2。

图2 不同电压下聚合聚苯胺表面扫描电镜图。(a)Bare/Cu;(b)1.1 V;(c)1.2 V;(d)1.3 V;(e)1.4 V;(f)1.5 VFig.2 SEM images of polyaniline surface at different voltages.(a)Bare/Cu;(b)1.1 V;(c)1.2 V;(d)1.3 V;(e)1.4 V;(f)1.5 V
由图2(a)可知,Bare/Cu 表面因为受到电解铜箔生产工艺的影响,导致其表面出现不规整的条纹状。由图2(b)所示,电压为1.1 V 时聚苯胺颗粒分布不均匀,铜箔的部分表面并未形成均匀的聚苯胺颗粒层,这是因为电压小,导致电流密度小,电聚合反应速度慢,聚苯胺颗粒在铜箔表面覆盖不完整。电压为1.2 V 与1.3 V 时,如图2(c)与图2(d)所示,铜箔表面均有孔洞。而当电压为1.4 V 时,从图2(e)中可观察到均匀致密的聚苯胺颗粒层。随着电压增大至1.5 V 时,电聚合反应的速度增快,出现了聚苯胺颗粒不断地堆叠聚集,出现了聚苯胺膜层堆积不均匀的状况,结果如图2(f)所示。因此后续表征及应用以电压为1.4 V条件下制备的复合铜箔集流体为样本。
2.2 电压对聚苯胺膜层厚度的影响
采用万分尺测厚仪测得不同电压情况下所制备的聚苯胺膜层的厚度,测定结果如图3 所示。通过图3可知,随着电压的增大,聚苯胺生长的厚度也随之变厚,但是当电压达到1.3 V 以后,聚苯胺生长的厚度达到一个较为稳定的值,聚苯胺膜层的极限厚度可能与恒压下的极限电流有关系,随着电流达到一定值,聚苯胺的颗粒生长达到极限,而且聚苯胺难以在聚苯胺的表面继续生长,所以会出现聚苯胺膜层厚度不再随着电压增加而增加的现象。
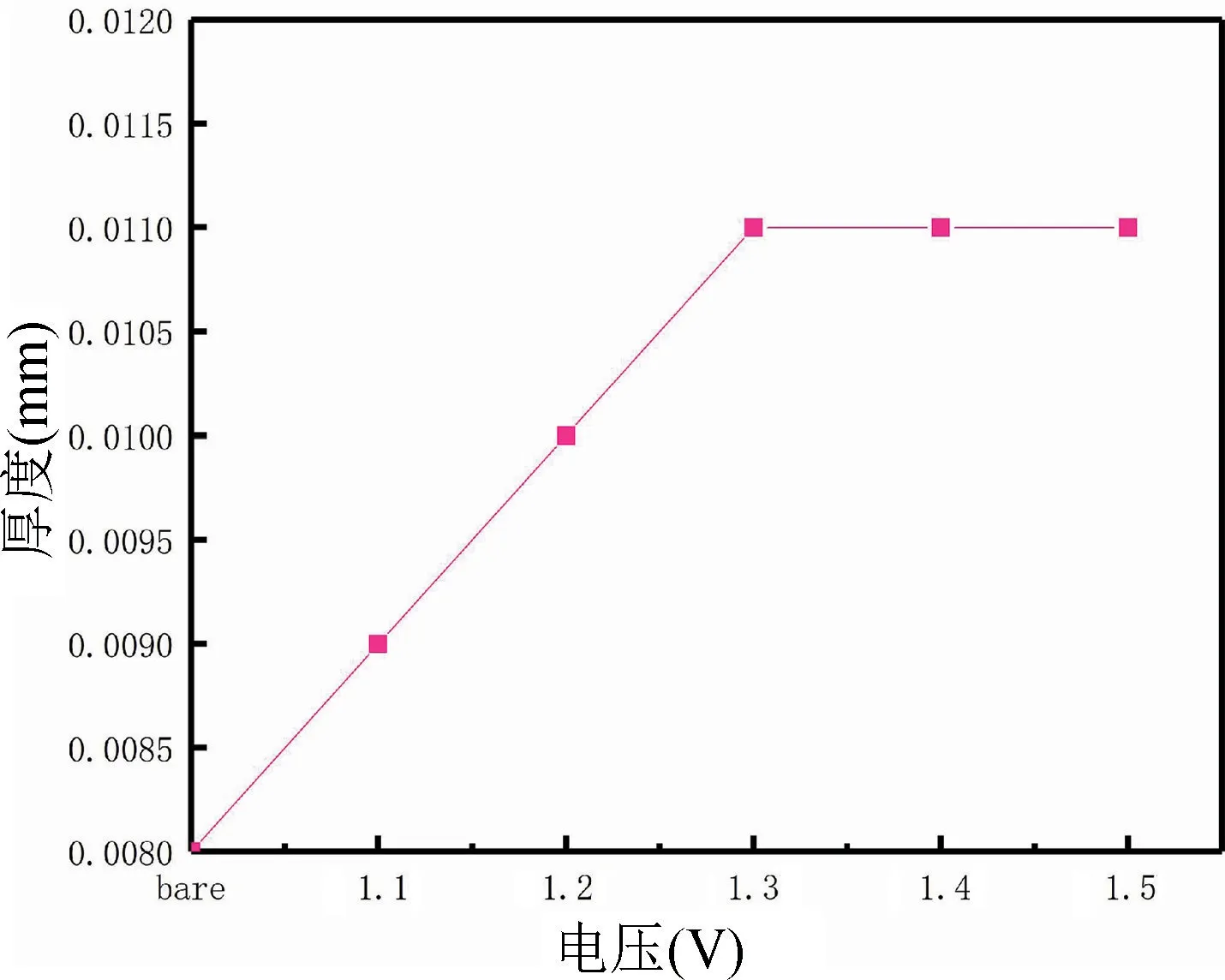
图3 聚苯胺生长厚度随着电压的变化Fig.3 Variation of polyaniline growth thickness with voltage
2.3 时间对聚苯胺膜层均匀性的影响
在1.4 V 电压下,由0.2 mol/L 苯胺与0.05 mol/L 的硫酸配成的混合电解质中,常温条件下,分别电聚合1,5,10 和15 min,图4 为聚合不同时间下聚苯胺膜层的表面形貌结构。
由图4(a)可知,恒电压聚合1 min 后聚苯胺膜层由粒状结构构成,因为电聚合的时间较短,导致聚苯胺颗粒没有完全覆盖铜箔表面,得到厚度不均匀的聚苯胺膜层。由图4(b)所示,恒电压聚合5 min 后,聚苯胺颗粒分布相对于1 min 更均匀,但是还是有一些空隙。由图4(c)所示,恒电压聚合10 min 后,得到均匀堆积的PANI 颗粒,形成均匀致密并且平坦整齐的聚苯胺膜层。再继续聚合到15 min 后,如图4(d),聚苯胺在10 min 的基础上继续生长,可能是由于聚苯胺晶粒的生长导致聚苯胺相互挤压并且产生裂痕。因此,在1.4 V 电压下生长10 min 聚苯胺的表面形貌较为理想。
2.4 聚苯胺膜层的红外光谱表征图
图5 为电化学聚合生成聚苯胺膜层的红外光谱图。图5 表明,醌环(Q)和苯环(B)的特征吸收峰在1561 cm-1和1492 cm-1处,分别为氧化还原态聚苯胺的特征峰[24],该结构为导电态聚苯胺。由于特征吸收峰相对强度IQ/IB=I1561/I1492越接近1,聚苯胺电导率就越好。特征吸收峰出现在1117 cm-1是聚苯胺盐结构,与—N=Q=N—伸缩振动相对应,而这个强宽带与聚苯胺的高度电子离域和高电导率有关[25]。除此之外,苯环中C-H 的特征吸收峰在751 cm-1处[26]。通过以上分析可知,电化学聚合生成的聚苯胺以导电态形式存在于铜箔表面。
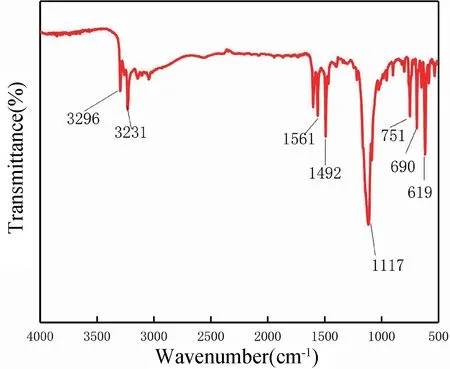
图5 PANI 层的FT-IR 谱图Fig.5 FT-IR spectra of PANI layer
2.5 聚苯胺层紫外光谱表征
将PANI/Cu 集流体与Bare/Cu 集流体做了固体紫外吸收光谱对比实验,测试结果如图6 所示。

图6 PANI 层的紫外光谱图Fig.6 UV spectra of PANI layer
由图6 可知,在紫外-可见光谱中观察到了特征吸收波长区域分别在300~400,400~500,500~600 nm区域内,表明导电态形式的聚苯胺颗粒层存在。苯式结构的π-π*跃迁一般在300~400 nm 波长范围。极化子π-π*跃迁在400~500 nm 的波长范围,意味着中间态(氧化还原态)聚苯胺的形成是极化子的跃迁。而在500~600 nm 是第三个波长范围极化子的π-跃迁[27-31]。综上所述,在铜箔表面通过恒定电压电化学聚合得到的聚苯胺颗粒层可导电,可以实现电子转移。
2.6 电化学性能分析
2.6.1 首次充放电平台
图7 为聚苯胺复合铜箔集流体改性前后构成钛酸锂电池首次充放电结果。通过比较PANI/Cu 电池与Bare/Cu 电池在1C 倍率下的首次充放电平台曲线可知,PANI/Cu 电池充放电比容量更高,PANI/Cu 电池首次放电比容量是185 mAh/g(LTO 的理论比容量为175 mAh/g)。这是由于PANI/Cu 首次放电时存在第二放电平台(约1.16 V),PANI 参与嵌锂反应并提供额外的容量,使得PANI/Cu 电池的首次放电比容量超过理论比容量。在图7 中,Bare/Cu 电池的电压滞后小于PANI/Cu 电池的电压滞后,Bare/Cu 电池的放电平台与充电平台之间的电压差小于PANI/Cu 电池的,原因是在LTO 上PANI 层的电化学反应出现在高电压和低电压[32],使得PANI/Cu 的电压滞后增大。

图7 电池首次充放电平台Fig.7 Charging and discharging platform for the first cycle of battery
2.6.2 电池在不同充放电循环次数下的充放电平台分析
聚苯胺复合铜箔集流体改性前后构成钛酸锂电池在1C 倍率充放电不同循环次数下的平台结果见图8。图8 结果显示,PANI/Cu 电池在首次放电时有两个放电平台,该平台的产生主要是由于PANI 层对锂离子的电化学活性而产生的。
从图8 可看出,PANI/Cu 电池在首次充放电平台中出现的第二放电平台消失,第2 圈放电比容量为174.1 mAh/g,在后续的循环过程中没有出现超理论容量现象,表明嵌锂初始反应过程中一部分锂结合紧密无法脱嵌,但其后续嵌入/脱嵌反应可逆性优异。对比图8 中(a)与(b)的充放电平台可知,在第1,2,3,100,300,500 圈中,PANI/Cu 电池的充放电平台相对于Bare/Cu 电池变化更具有规律性。

图8 1C 倍率下不同循环数的充放电曲线。(a)Bare/Cu 电池;(b) PANI/Cu 电池Fig.8 Charge-discharge curves at different cycles under 1C rate.(a)Bare/Cu battery;(b) PANI/Cu battery
在1~500 圈循环中,PANI/Cu 电池的充放电曲线变化比Bare/Cu 电池更小,这表明PANI/Cu 电池在循环充放电过程中电极可逆性、稳定性都较好。最后,对比图8(a)与(b)可看出,在相同的循环圈数下,PANI/Cu 电池的电压滞后皆比Bare/Cu 电池大,但并不影响PANI/Cu 电池比Bare/Cu 电池的充放电平台更稳定。
2.6.3 CV 首次扫描
聚苯胺复合铜箔集流体改性前后构成电池在0.5 mV/s 扫速下的首次CV 结果如图9 所示。

图9 首次循环伏安性能Fig.9 First cyclic voltammetry performance
由图9 可知,在1.7 V 与1.4 V 附近能观察到Bare/Cu 电池与PANI/Cu 电池的氧化还原峰峰形相似,但PANI/Cu 电池在首次还原扫描时,于1.16 V处多了一个还原峰,验证了图7 中首次充放电平台中的第二放电平台。对比氧化峰与还原峰之间的电压差,可以看出PANI/Cu 电池峰值差更大,验证了图7 中出现的电压滞后现象。
2.6.4 不同CV 扫描圈数结果分析
在聚苯胺复合铜箔集流体改性前后构成电池在1C倍率情况下,不同圈数的CV 循环扫描结果见图10。由图10(a)与(b)可知,随着第1 圈到第5 圈扫描次数的增加,PANI/Cu 电池的CV 曲线重合度比Bare/Cu电池更高,这表明PANI/Cu 电池的电极反应可逆性比Bare/Cu 电池的更好。再次,PANI/Cu 电池还原扫描中1.16 V 附近的还原峰在第2 圈循环时消失,正好与图7(b)的放电平台的消失相对应。

图10 不同圈数的循环伏安性能。(a)PANI/Cu 电池;(b)Bare/Cu 电池Fig.10 Cyclic voltammetry performance at different cycles.(a) PANI/Cu battery;(b) Bare/Cu battery
2.6.5 循环性能
在聚苯胺复合铜箔集流体改性前后构成电池在1C与10C 倍率情况下的循环性能对比见图11。

图11 循环性能对比。(a) 1C 倍率下循环500 圈;(b) 10C 倍率下循环1000 圈Fig.11 Cycle performance comparison.(a) 500 cycles at 1C;(b) 1000 cycles at 10C
图11(a)为PANI/Cu 电池与Bare/Cu 电池1C 倍率下分别循环500 圈的循环性能对比,图11(b)为10C 倍率下循环1000 圈后的循环性能比对。由于锂在反应过程中没有不可逆的锂消耗,因此,库伦效率在整个过程中保持100%。数据结果表明,PANI/Cu 可以使得电池循环稳定性增强。由图11(a)知,PANI/Cu 电池的放电比容量在1C 倍率下循环500 圈后为164.6 mAh·g-1,在相同的循环条件下,Bare/Cu 电池1C 倍率下循环500 圈后的放电比容量降到了155.6 mAh·g-1。数据结果表明PANI/Cu 电池循环稳定性比Bare/Cu 更好。在重复充放电过程中,钛酸锂产生无序化和结构松弛,以及越来越多Ti3+和Li+脱嵌在LTO中破坏材料结构,造成离子和电子电导率下降和极化扩大,导致容量衰减。因此,在1C 倍率500 圈循环后,两种电池容量都发生了衰减,但是PANI/Cu 电池的放电比容量比Bare/Cu 电池的高。
如图11(b)为在大倍率10C 下循环1000 圈测试两种电池的循环性能。显然,1000 圈循环后PANI/Cu 电池的容量保持率是80%,远高于Bare/Cu 电池的60%。因此,集流体表面PANI 层的存在有效提高了LTO 电池的循环稳定性。
2.6.6 倍率性能
聚苯胺复合铜箔集流体改性前后构成电池在0.5C~10C 之间倍率性能对比见图12。由图12 可知,在相同倍率下,PANI/Cu 电池体系的放电比容量皆高于Bare/Cu 电池体系的放电比容量。此外,在大倍率10C 循环后突然降到0.5C 放电,Bare/Cu 和PANI/Cu电池都能瞬间恢复到最开始的放电比容量。这说明了容量更高的PANI/Cu 电池与Bare/Cu 电池具有同样的循环稳定性与可逆性。

图12 倍率放电性能Fig.12 Rate discharge performance
2.6.7 交流阻抗(EIS)
在PANI 改性前后,用LTO 电池做负极,锂片做正极装成电池后,交流阻抗测试对比见图13。
图13 为聚苯胺复合铜箔集流体改性前后构成电池的交流阻抗图。结果表明,与Bare/Cu 组别相比,PANI/Cu 组别的电荷转移阻抗更小。锂离子电池阻抗的降低,是因为聚苯胺纳米颗粒具有良好的导电性,提高了铜箔集流体与钛酸锂电池材料的兼容性,从而有效降低了电极界面阻抗,达到提高锂离子电池的电化学性能的目的。
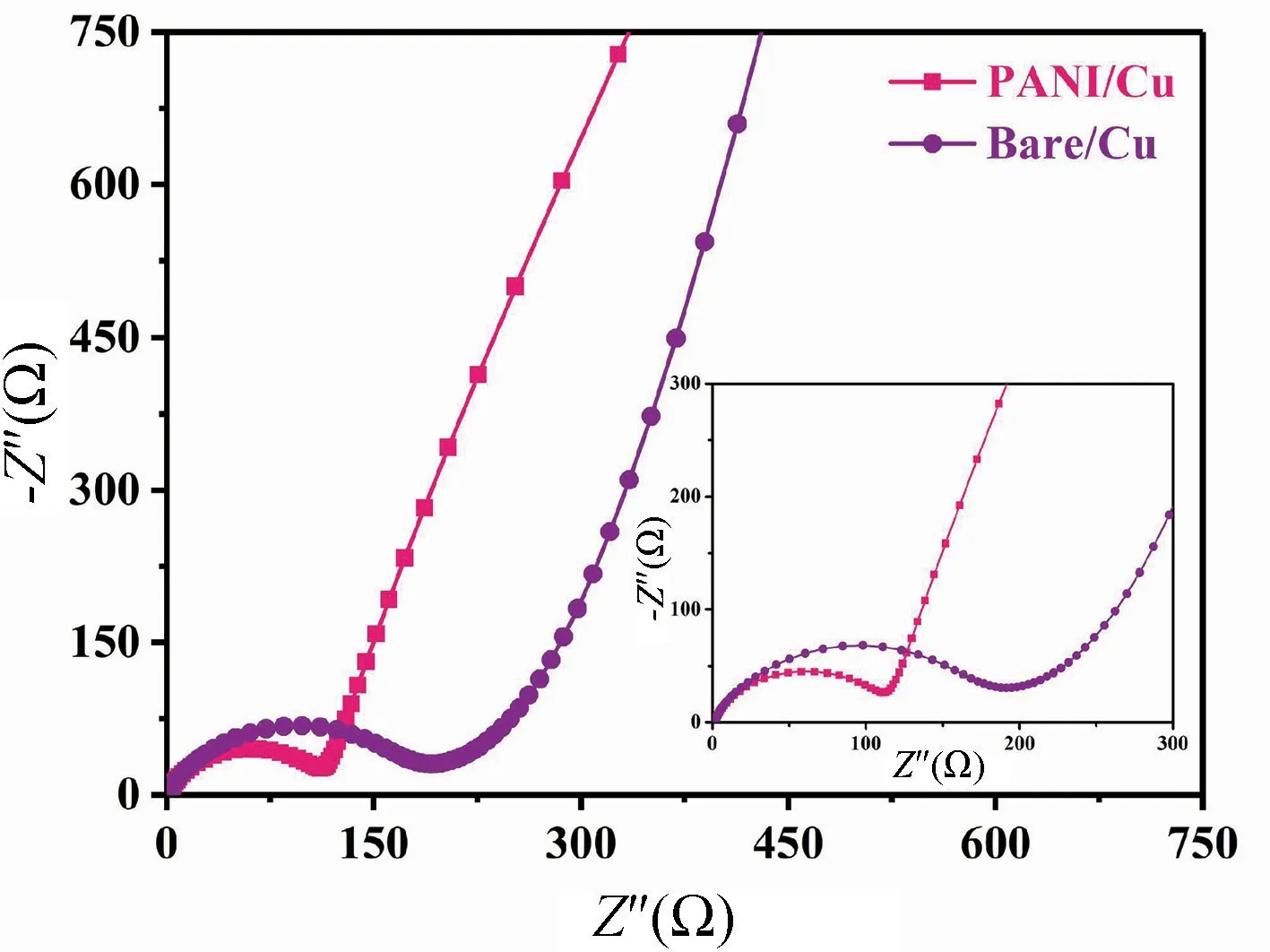
图13 交流阻抗测试Fig.13 AC impedance measurement
3 结论
综上所述,通过恒压法在铜箔集流体上电化学聚合制备得到了聚苯胺薄膜,组装成LTO 电池后通过各种性能测试,形成以下结论:
(1)在聚合的过程中,电压对聚苯胺的形貌特征产生重要的影响,当工作电压为1.4 V,电解质为0.05 mol/L H2SO4和0.2 mol/L 苯胺构成的混合电解质条件下,聚合10 min 后能得到均匀致密的聚苯胺复合层;
(2)FT-IR、UV-Vis 测试皆表明PANI 以导电形式存在;
(3)集流体复合改性之后,钛酸锂电池的循环性能及容量有所提高。在1C 倍率下充放电平台显示,PANI/Cu 电池首次放电比容量为185 mAh·g-1,高于纯LTO 电池的理论比容量(175 mAh·g-1),而Bare/Cu 电池的放电比容量只有160 mAh·g-1左右,说明聚苯胺能够起到嵌锂的功能,提高了电池容量。
(4)聚苯胺对铜箔集流体的改性提高了钛酸锂电池在高倍率情况下的循环性能。在1C 倍率下充放电500 圈以后,PANI/Cu 电池的放电比容量为164.6 mAh·g-1,Bare/Cu 电池在相同的循环条件下,比容量却降到了155.6 mAh·g-1,在10C 大倍率下充放电1000 圈以后,PANI/Cu 电池的容量保持率为80%,超过Bare/Cu 电池的60%,铜箔集流体表面聚苯胺改性提高了电池循环性能。

