酰胺质子转移序列联合动态对比增强MRI术前评估子宫内膜癌风险的价值
卢绪论,刘爱连*,李烨,田士峰,王家正,林良杰,沈智威,张祎
1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.飞利浦(中国)投资有限公司,北京 100000;3.浙江大学生物医学工程与仪器科学学院,浙江 杭州 310000;*通信作者 刘爱连 cjr.liuailian@vip.163.com
子宫内膜癌(endometrial carcinoma,EC)是仅次于乳腺癌的第二大女性恶性肿瘤[1]。目前EC的主要治疗方法是全子宫切除术和双侧输卵管卵巢切除术,同时放化疗也可以起到治疗作用[2]。高、低风险组EC手术方案的差别主要体现在是否进行系统性淋巴结清扫,而既往EC的风险评估通常在术后进行[3]。2020年12月18日欧洲妇科肿瘤学会、欧洲放射肿瘤学会、欧洲病理学会联合对EC管理指南进行更新,强调了EC的风险等级评估对于高危和高级别患者的辅助治疗和推测预后具有指导意义[4]。因此如何术前无创且准确地评估EC风险对临床治疗方案的选择非常重要。
酰胺质子转移(amide proton transfer,APT)序列可以通过水信号间接地测量蛋白质和肽中的酰胺质子信号,能够反映肿瘤代谢[5]。动态对比增强磁共振成像(dynamic contrast enhanced MR imaging,DCEMRI)定量评估对比剂在细胞及血管内外的移动速度,从而得到肿瘤的渗透信息,进而反映肿瘤微环境的改变。本研究拟使用APT和DCE-MRI定量参数对EC的风险度进行评估。
1 资料与方法
1.1 研究对象 回顾性收集2019年4月—2021年7月疑诊EC于大连医科大学附属第一医院行3.0T MR盆腔扫描的患者。纳入标准:①经手术病理证实为EC,且临床资料完整;②术前2周内在本院行MR检查,检查序列包括APT和DCE-MRI。排除标准:①术前行放化疗及其他处置(如活检、刮宫);②图像质量差,有影响病变观察及数据测量的伪影;③病灶直径<1.0 cm。最终纳入EC患者35例,年龄33~73岁,平均(54.9±8.3)岁。本研究经本院伦理委员会批准(PJKS-XJS-2022-67),免除受试者知情同意。
手术病理按照2018国际妇科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期[6]:I期,为肿瘤局限于子宫体,IA期无肌层浸润或浸润<1/2肌层,IB期浸润≥1/2肌层;II期,肿瘤侵犯宫颈间质,但未延伸到子宫外;III期,局部伴或不伴区域扩散;IV期,肿瘤侵犯膀胱/直肠黏膜,伴或不伴有远处转移。IA期EC26例,IB期2例;II期1例,III期5例,IV期1例。病理类型子宫内膜样腺癌共34例(其中G1级13例、G2级12例、G3级9例),肉瘤样癌1例。浸润深度<1/2肌层26例,≥1/2肌层9例;发现淋巴结转移3例。对EC按照手术FIGO分期(2018年版)标准及2015年欧洲肿瘤学会、欧洲放射肿瘤学会、欧洲妇科肿瘤学会的EC诊治专家共识及既往研究[6-8]进行分组,高风险组需满足以下条件:①子宫内膜样癌IB期及以上;②G3期的I型癌;③非子宫内膜样癌亚型。低风险组需为IA期(G1和G2期)的子宫内膜样癌。本研究中高风险组14例,年龄47~73岁,平均(57.9±7.0)岁;低风险组21例,年龄33~67岁,平均(52.9±8.7)岁。患者主要临床症状为不规则阴道流血(32例)、接触性出血(3例)。
1.2 仪器与方法 使用Philips Ingenia CX 3.0T MR行子宫MR扫描,使用16通道腹部扫描线圈。扫描前患者禁食水4~6 h减轻肠道蠕动,并于检查前1 h饮水约500 ml,使膀胱处于半充盈状态,行轴位T1WI及矢状位T2WI、矢状位APT及矢状位DCE-MRI序列扫描,扫描参数见表1。DCE-MRI序列在扫描前先进行5°和15°翻转角的T1 mapping序列扫描,在扫描1期后采用高压注射器经右肘正中静脉团注对比剂钆喷替酸葡甲胺(速度2.5 ml/s,剂量0.2 ml/kg),然后连续采集39期,每期6.6 s。

表1 磁共振扫描序列及参数
1.3 图像分析及数据测量 由2位观察者共同对病变的部位(宫体、宫底、宫颈、宫体和宫颈)、病灶形态(弥漫、局限)及病灶(T1WI、T2WI)信号进行观察,同时记录患者的血浆肿瘤标志物:肿瘤相关糖类抗原125(cancer antigen 125,CA125)、肿瘤相关糖类抗原199(cancer antigen 199,CA199)、人附睾蛋白4(human epididymis protein 4,HE4)。当观察者意见不统一时,最终协商解决。其中病灶信号以子宫深肌层为参考,高信号为信号高于子宫肌层,等信号为信号接近子宫肌层,低信号为信号低于子宫肌层。
定量数据测量由2位放射科主治医师(分别有子宫MR诊断经验10年和12年)独立完成。自动重建APT及DCE-MRI图像,利用飞利浦后处理工作站(IntelliSpace Portal,ISP)10.0进行数据测量。APT序列与T2WI图像融合,用于确定病变部位及范围。由2位放射科医师分别在APT-T2WI融合图像及DCEMRI增强图像中选择病灶最大层面测量病灶APT序列的APT值、DCE-MRI的容积转移分数(volume transfer constant,Ktrans)、速率常数(exchange rate between EES and blood plasma,Kep)、血管外细胞外间隙容积比(extravascular volume fraction,Ve)以及血浆容积分数(capillary plasma volume,Vp)放置1个感兴趣区(ROI)。ROI为最大层面全域测量,勾画时避开明确出血、坏死、囊变区域,沿病变边缘勾画病灶,并与病灶边缘保持适当距离,避免部分容积效应的影响。APT序列和DCE-MRI测量时ROI大小和位置尽可能保持一致。
1.4 统计学方法 应用SPSS 26.0软件和MedCalc 15.0软件,使用组内相关系数(ICC)检验2位观察者测量数据的一致性,当ICC≥0.75为一致性好。使用均值进行后续计算。采用Kolmogorov-Smirov检验数据正态性,若数据符合正态分布,以±s表示,用独立样本t检验比较;若数据不符合正态分布,以M(Q1,Q3)表示,用Mann-whitneyU检验比较。采用受试者工作特征(ROC)曲线评估差异数据的诊断效能,获得相应参数的曲线下面积(AUC)、阈值、敏感度和特异度。用Logistic回归计算有差异数据的联合诊断效能,用Delong检验进行单一参数与联合参数诊断效能比较。用Pearson相关检测APT值和有差异DCE-MRI参数间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 高、低风险组EC病灶临床资料比较 高风险组、低风险组EC病灶部位、信号、分布差异无统计学意义(χ2=3.727、2.321、0.338,P均>0.05)。两组患者的肿瘤标志物CA125、CA199、HE4差异无统计学意义(Z=-0.505、-1.347、-1.216,P均>0.05)。
2.2 观察者间测量定量数据的一致性检验 2名观察者对APT、Ktrans、Kep、Ve及Vp的测量一致性良好(ICC=0.948、0.966、0.976、0.950、0.914)。
2.3 两组病灶APT、Ktrans、Kep、Ve及Vp值比较 高风险组APT值及Ktrans值明显高于低风险组(P=0.002、0.028)。高风险组与低风险组间Kep、Ve及Vp值差异均无统计学意义(P均>0.05),见表2及图1、2。
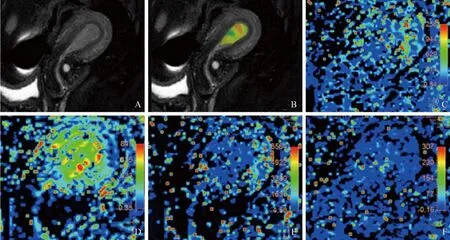
图1 女,54岁,高风险子宫内膜癌(IA期,高中分化子宫内膜样腺癌伴低分化黏液腺瘤)。A为T2WI图像,子宫腔内可见T2WI稍高信号;B为APT与T2WI融合图像,APT值为2.9%;C为Ktrans图,病灶Ktrans值为380.4×10-3/min;D为Kep图,病灶Kep值为864.4×10-3/min;E为Ve图,病灶Ve值为440.06×10-3;F为Vp图,病灶Vp值为90.30×10-3

表2 EC高风险组、低风险组间APT、Ktrans、Kep、Ve及Vp值比较
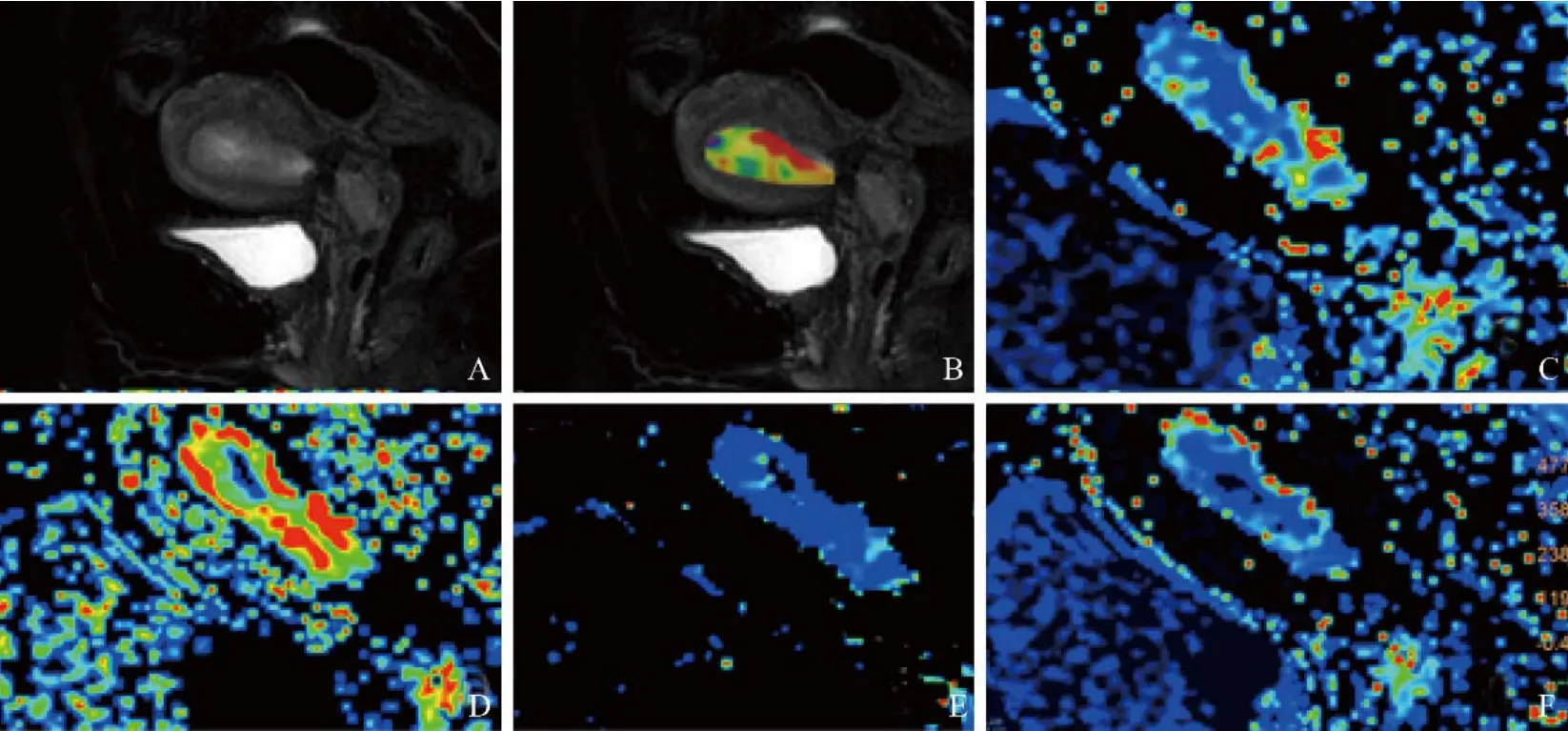
图2 女,52岁,低风险子宫内膜癌(IA期,高中分化子宫内膜样腺癌)。A为T2WI图像,子宫腔内可见T2WI稍高信号;B为APT与T2WI融合图像,APT值为1.8%;C为Ktrans图,病灶Ktrans值为373.5×10-3/min;D为Kep图,病灶Kep值为407.8×10-3/min;E为Ve图,病灶Ve值为915.96×10-3;F为Vp图,病灶Vp值为7.76×10-3
2.4 APT、Ktrans对高风险EC评估效能及AUC差异评估 APT及Ktrans对高风险EC的AUC分别为0.801、0.711。APT联合Ktrans对高风险EC的AUC为0.840(表3,图3)。

图3 APT、Ktrans值两者联合预测高风险EC的ROC曲线
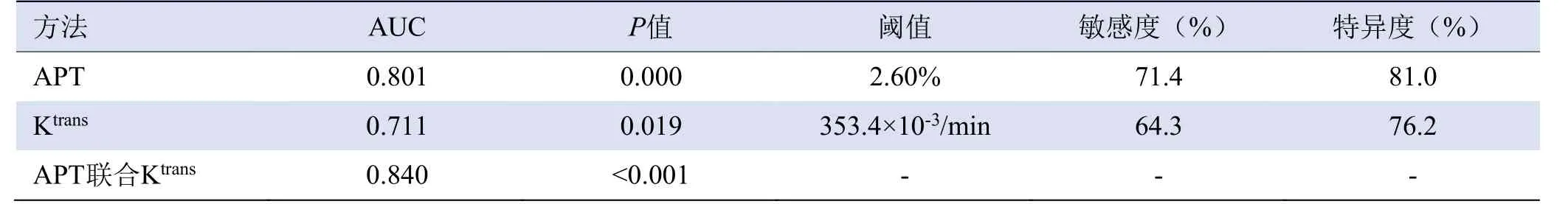
表3 APT、Ktrans对高风险EC的诊断效能
APT和Ktrans值对高风险EC的诊断效能差异无统计学意义(Z=0.774,P=0.439)。联合后AUC与单独使用APT及Ktrans值AUC差异无统计学意义(Z=0.874、1.315,P=0.382、0.188)。
2.5 EC的APT值与Ktrans的相关性 APT值和Ktrans值无相关性(r=0.151,P=0.388)。
3 讨论
绝经前后子宫的异常流血是EC的主要临床症状。全世界每年约有142 000名女性患EC,且患病率逐年增高[9-10]。
3.1 患者临床资料分析 临床往往根据EC的分化程度、病理类型、肌层浸润深度、是否伴有淋巴结转移等对其进行风险评估[11]。手术是EC的主要治疗方法,而风险评估是术中是否进行淋巴结清扫的依据。过度淋巴结清扫会增大下肢淋巴结水肿的风险[12],因此术前EC风险评估对于临床治疗方案的确定尤为重要。临床上仅通过患者的肿瘤标志物(CA125、CA199及HE4)对EC进行术前风险评估存在困难。本研究中高低风险组间肿瘤标志物(CA125、CA199及HE4)均无显著差异。
3.2 MRI检查的优势 MRI具有高对比度、多序列、多方位成像的优势,广泛应用于妇科肿瘤的诊断、分型、分期、预后评估等,对EC病灶范围、盆腔淋巴结及其他器官累及情况的判断优于超声检查。增强MR是诊断EC的首选影像学方法[13]。但本研究中高、低风险组间病灶部位、信号、分布均无差异。田士峰等[14]应用体素内不相干运动序列对子宫内膜癌的风险进行评估,证明高风险子宫内膜癌细胞密度高,细胞间质少,水分子扩散受限。APT成像序列通过检测病变内酰胺质子浓度能更直接地反映病灶的代谢情况[15]。DCE-MRI可以反映肿瘤微循环灌注存在的差异[14],因此本研究尝试应用APT和DCE-MRI序列对EC的风险程度进行评估。
3.3 APT序列分析 APT成像是化学饱和位移的分支之一,是一种依赖酰胺(-NH)和大量水进行成像的方法[15]。APT对组织内酰胺质子浓度、pH值改变很敏感。孟醒等[16]研究证明EC内组织增殖活跃,同时易伴出血、坏死,EC的APT值高于子宫内膜息肉的APT值。高风险EC与高Ki-67表达相关,高Ki-67表达导致肿瘤内血管内皮因子增加,细胞增殖活跃,蛋白质合成增多[17]。此外,高风险EC较低风险EC代谢增快,组织乏氧增加,病灶内坏死成分较多,细胞外的游离蛋白和多肽较多。以上原因导致高风险EC的APT值较高,与既往研究[18]使用APT对脑胶质瘤进行分级的结果一致。
3.4 DCE-MRI序列分析 DCE-MRI利用Tofts药代动力学双室模型研究对比剂在血管内、外间隙的渗透情况。Ktrans值反映对比剂由血管转移到血管外细胞外间隙的速度。高风险EC细胞增殖快,肿瘤需氧量大,肿瘤的微血管生成增多,新生血管阻力增大;肿瘤血管通常管壁不完整、走向扭曲,导致肿瘤血管壁通透性增加,对比剂渗漏增加,高风险组较低风险组EC的Ktrans值增高。Kep为Ktrans与Ve的比值,反映对比剂由血管外细胞外间隙进入血管内的转移速度,可准确反映毛细血管通透性[19]。Kep受Ve的影响,当Ve较大时,对比剂往往会在血管外间隙内积聚,使对比剂的转运延迟、速度减低[20]。Ve为血管外细胞体积分数,受细胞大小、数量和堆积密度等因素影响。Vp代表血浆占单位体积的分数,反映局部毛细血管的密度。本研究中Kep、Ve、Vp值在高、低风险EC间无差异。既往研究证明Ve可能因肿瘤类型和侵袭性有差异,但是对胃癌的研究中Ve在低分化和高中分化管状腺癌中无差异[21],本研究结果显示高、低风险EC间Ve值无显著差异。Mills等[22]报道细胞密度的组织学测量通常是对单位面积的细胞核数量进行计数,而不是对细胞占据体积进行量化。如果细胞较小,组织学细胞密度增加不一定会导致血管外细胞外间隙减少。这可能是本组病例高风险组Ve值呈高于低风险组Ve值倾向的原因,但由于本组病例较少,结果差异无统计学意义。Vp反映对比剂在血液中占的比例与肿瘤血管生成密度和血管壁通透性密切相关[23]。本研究中高风险的Vp值有低于低风险组的倾向。对比剂由血管外向血管内的转运可能受到血管外间隙内对比剂积聚的影响,虽然高风险组Kep值有高于低风险组的倾向,但差异无统计学意义。
3.5 APT和DCE-MRI序列间关系 APT值反映了肿瘤的代谢信息,Ktrans值反映了肿瘤的灌注信息,本研究证明APT值和Ktrans值无相关性。通过2种参数的相互补充,联合后对于EC的高低风险评估效能有所增加。
3.6 本研究局限性 首先,本研究纳入病例数较少,未包含所有病理类型的子宫内膜癌,尚需增加样本进一步研究。其次,测量时选择病灶最大层面,并避开出血、坏死,未对肿瘤进行全域勾画,可能会遗漏部分异质性信息;同时由于APT序列和DCE-MRI序列扫描层厚不同,无法保证2个序列ROI的勾画完全一致。
综上所述,APT值、Ktrans值通过反映EC的代谢和灌注特点能够对高、低风险EC进行鉴别。联合使用APT值和Ktrans值时具有很高的诊断效能,为临床医师制订EC治疗方案提供了有效的信息。

