基于MRI影像组学构建新辅助放化疗后局部进展期直肠癌的预测模型
周彦汝,张岚*,韩鼎盛,庞志峰
1.河南中医药大学第一附属医院MRI科,河南中医药大学中医药信息智能分析与利用郑州市重点实验室,河南 郑州 450000;2.河南中医药大学影像医学与核医学系,河南 郑州 450046;3.河南大学数学与统计学院,河南 开封 475004;*通信作者 张岚 13837187787@163.com
结直肠癌目前是世界上最常见癌症的第3位,最致命恶性肿瘤的第2位[1-2]。2020年全球癌症统计结果显示,结直肠癌患者中直肠癌占30%~50%,约半数患者在发现时已处于局部进展期[3-4]。目前新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)后采取全直肠系膜切除术(total mesenteric resection,TME)是局部进展期直肠癌(locally advanced rectal cancer,LARC)的标准治疗方式[5]。在临床实践中,LARC患者接受nCRT治疗后的病理反应表现出明显的异质性。MRI目前广泛应用于直肠癌的分期、疗效评价及随访复查[6-7]。近年来影像组学在评估LARC患者对nCRT的疗效反应方面具有较大的潜力[8-9]。但是单纯依靠影像组学模型对nCRT进行疗效预测和预后评判的价值仍然有限。因此,本研究回顾性收集nCRT联合TME根治性手术的LARC患者的临床和影像学资料,构建影像组学模型、临床模型及影像组学与临床特征相结合的综合模型,比较3种模型对nCRT疗效反应的预测效能,为临床治疗提供客观依据。
1 资料与方法
1.1 研究对象 回顾性收集2017年1月—2021年12月在河南中医药大学第一附属医院肛肠科治疗并获取病理结果的140例LARC患者,男90例,女50例,年龄(52.5±7.2)岁;记录患者年龄、性别、T分期、N分期、癌胚抗原、糖类抗原199(CA199)。纳入标准:①接受nCRT后行TME治疗,且病理证实为直肠腺癌;②临床分期为局部进展期直肠癌(cT3/T4N0-2M0);③肿瘤下缘距肛缘12 cm以内;④术前直肠MRI检查序列完整,包括高分辨T2WI、T1WI、扩散加权成像(DWI)、动态对比增强MRI(dynamic contrastenhanced MRI,DCE-MRI);⑤能够耐受nCRT,无手术禁忌证。排除标准:①肿瘤病灶实性成分少,囊变坏死成分多[结合MRI平扫及增强信号表现,根据可勾画感兴趣区(ROI)的区域范围大致判断];②临床和影像资料不齐全;③接受过其他抗肿瘤或试验性治疗;④合并其他系统肿瘤或患有严重心脑血管疾病。本研究经本院伦理委员会批准(2022HL-166),患者均签署知情同意书。
1.2 MRI检查 采用Philips Ingenia 3.0T MR扫描仪和32通道体部线圈,患者取仰卧位。轴位T1WI:TR 571 ms,TE 8 ms,矩阵376×296,FOV 300 mm×300 mm,层厚4 mm,层间距0.4 mm;轴位T2WI:TR 3 597 ms,TE 100 ms,矩阵288×187,FOV 200 mm×200 mm,层厚4 mm,层间距0.4 mm;矢状位T2WI:TR 4 026 ms,TE 90 ms,矩阵308×248,FOV 200 mm×200 mm,层厚4 mm,层间距0.4 mm;DWI:TR 2 206 ms,TE 65 ms,矩阵124×106,FOV 375 mm×315 ms,层厚4 mm,层间距0.4 mm;b=0、1 000 s/mm2。DCE-MRI:采用三维容积快速扫描序列,注射对比剂前先进行蒙片扫描,TR 3.6 ms,TE 1.33 ms,翻转角10°,矩阵132×134,FOV 200 mm×200 mm,层厚3 mm,层间距-1.5 mm,带宽1.82 kHz;以2.5 ml/s将钆特酸葡胺注射液(江苏恒瑞)由高压注射器注入肘静脉,随后用20 ml生理盐水以相同速度冲管,注射对比剂同时行增强扫描。
1.3 治疗方案 TME术前同步nCRT:术前全盆腔放疗剂量为45~50 Gy/25次,治疗时间35 d。进行放疗的同时接受化疗,化疗方案为:奥沙利铂+卡培他滨联合治疗(Xelox方案)。放化疗后6~8周行TME标准手术。
1.4 病理分级 术后标本由高年资病理科医师取材、核片。根据肿瘤退缩分级(tumor regression grading,TRG)进行评分[10]:TRG 0为无退缩发生;TRG 1为肿瘤组织基本未发生形态学改变;TRG 2为中度退缩;TRG 3为明显退缩;TRG 4为完全退缩。根据TRG将nCRT后的LARC患者分为病理完全缓解(pathologic complete response,pCR)组(TRG 4,108例)和无病理完全缓解(no pathologic complete response,npCR)组(TRG 0~3,32例)。
1.5 影像组学分析
1.5.1 图像分割和纹理特征提取 参考Nie等[11]在DCE-MRI增强序列对图像的选取分割,选择静脉期(注射对比剂后60 s)的轴位图像,将DICOM格式的图像导入ITK-SNAP图像分割软件(version 3.8.0)由2名分别具有8年和15年MRI诊断经验的副主任医师在遵循单盲原则下沿肿瘤边缘手动逐层勾勒,对肿瘤病灶进行ROI勾画,尽量避免囊变、出血、坏死、水肿及肠腔内容物。通过图像灌注处理软件得出ROI的血管通透性参数(vascular permeability parameters,VPP),包括容积转移常数(volume transfer constant,Ktrans)、组织间隙血浆速率常数(interstitium-to-plasma rate constant,Kep)和血管外细胞外间隙容积分数(extravascular extracellular space volume fraction,Ve)。采用Pyradiomics软件进行影像组学特征提取,提取的纹理特征包括一阶统计特征、形状特征、纹理特征及小波特征4类,共计1 132个影像组学特征。
1.5.2 影像组学特征筛选 采用组内相关系数(ICC)对提取的影像组学特征进行一致性检验,分别计算观察者组内和观察者组间的ICC,选用2次同时ICC>0.75的特征。140例LARC患者按照7∶3随机分为训练组(99例,pCR患者76例、npCR患者23例)和验证组(41例,pCR患者32例、npCR患者9例)。在训练组中使用最大相关最小冗余(max-relevance and minredundancy,mRMR)对初始特征选择,并采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)对影像组学特征降维处理和筛选,通过10倍交叉验证选择显著可区分的特征。最后根据影像组学特征及对应的权重,构建影像组学标签,并计算出影像组学标签评分(Rad-score)。
1.5.3 影像组学模型与综合模型的构建 在临床信息中依次采用单因素和向后逐步选择多因素逻辑回归法选择独立预测因子,筛选出有意义的临床特征构建临床模型,进一步将影像组学标签评分与筛选后的临床特征相结合构建多元逻辑回归模型。采用受试者工作特征(ROC)曲线获取曲线下面积(AUC),在训练组评估影像组学、临床和综合模型的诊断效能,并在验证组中对模型进行验证和测试。使用校准曲线评价模型的校准能力和拟合优度,采用决策曲线分析法(decision curve analysis,DCA)评价不同风险阈值下3种模型的临床获益情况,并根据多元逻辑回归模型中各影响因素对终点事件的影响构建个体化疗效预测的诺模图。
1.6 统计学方法 采用SPSS 22.0和R 1.1.456软件进行分析。计量资料以±s表示,两组比较采用独立样本t检验;计数资料以例数(%)表示,组间比较采用χ2检验;采用MedCalc 22.0软件通过DeLong检验比较3种模型AUC的差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较 训练组和验证组患者年龄、性别、T分期、N分期、癌胚抗原、CA199和VPP参数差异均无统计学意义(均P>0.05),见表1。

表1 140例LARC患者训练组和验证组的临床资料比较
在训练组中,pCR和npCR患者在年龄、性别、T分期、N分期、癌胚抗原、CA199和Ktrans、Ve差异均无统计学意义(均P>0.05),而Kep差异有统计学意义(P<0.000 1)。在验证组中,pCR和npCR患者在年龄、性别、T分期、N分期、癌胚抗原、CA199和Kep差异均无统计学意义(均P>0.05),而Ktrans(P=0.037)和Ve(P=0.015)差异有统计学意义,见表2。

表2 140例LARC患者训练组和验证组中pCR和npCR患者的临床资料比较
2.2 影像组学特征提取 对静脉期病灶的1 132个影像组学特征通过降维处理,共筛选出10个影像组学特征用于构建影像组学模型(图1A、B),分别为:original_shape_Surface Volume Ratio、wavelet-HLL_firstorder_Mean、wavelet-HLH_glcm_Cluster Prominence、wavelet-HHL_gldm_Large Dependence High Gray Level Emphasis、original_shape_Least AxisLength、wavelet-HHL_gldm_Small Dependence Low Gray Level Emphasis、original_glrlm_Long Run Emphasis、logsigma-3-0-mm-3D_glszm_Large Area High Gray Level Emphasis、wavelet-HHL_firstorder_Median、wavelet-HHH_firstorder_Mean。
根据这10个影像组学特征以及对应的权重,构建影像组学标签,并计算出影像组学标签评分(图1C)。此外,临床特征中保留CA199和Kep两个独立预测因子用于构建临床模型,并与影像组学标签评分联合构建综合模型,综合模型评分公式为:综合模型评分=-3.14 639 799 931 503+CA199×0.83 838 166 086 8442+Kep×2.317 379 795 639 27+Rad-score×1.62 543 123 217 694。

图1 基于最小惩罚系数λ的影像组学特征降维和影像组学标签构建图。A.Y轴为二项式方差,X的上下轴为特征系数和惩罚系数λ的对数转换值;B.随着对数λ的变化,构建影像组学特征的数量也随之变化;C.根据最小惩罚系数λ构建影像组学特征时各特征的权重系数
2.3 3种预测模型比较 在训练组中,综合模型预测效能最佳(AUC=0.922),敏感度为93.4%,特异度为86.9%;在验证组中,综合模型的预测效能稍低于影像组学模型(AUC=0.840),敏感度为93.3%,特异度为63.6%(表3、图2)。

图2 影像组学、临床及综合模型的ROC曲线和箱形图
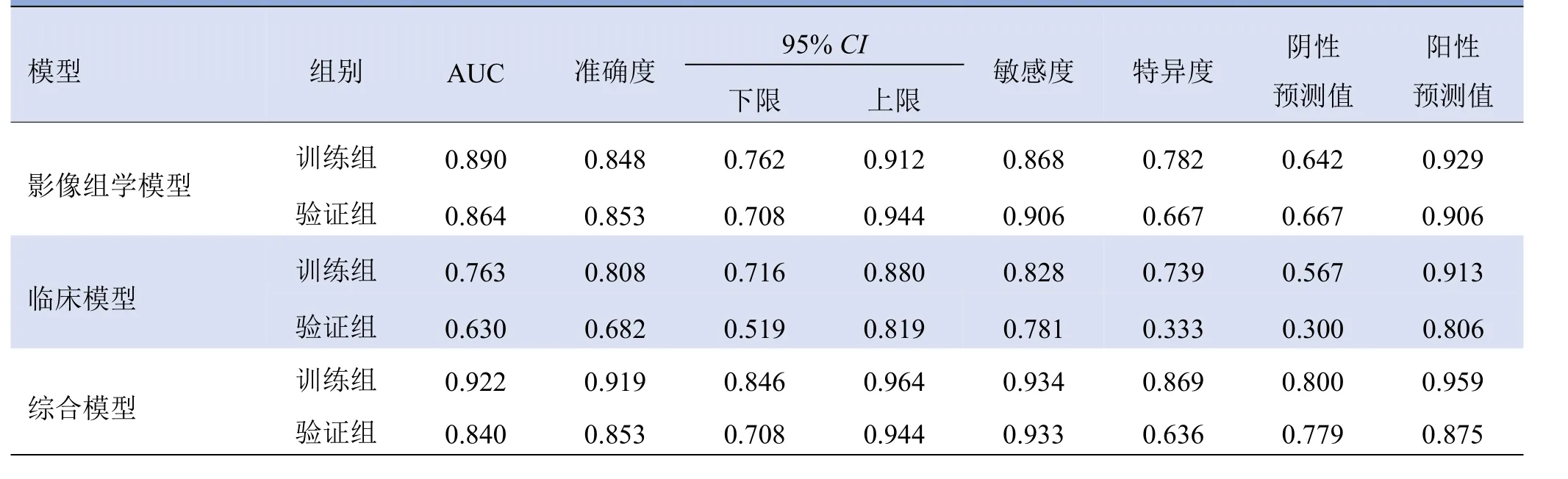
表3 影像组学、临床及综合模型的诊断性能
2.4 综合模型的预测效果 评价综合模型预测nCRT后LARC患者为pCR或npCR与病理结果的差异见图3。
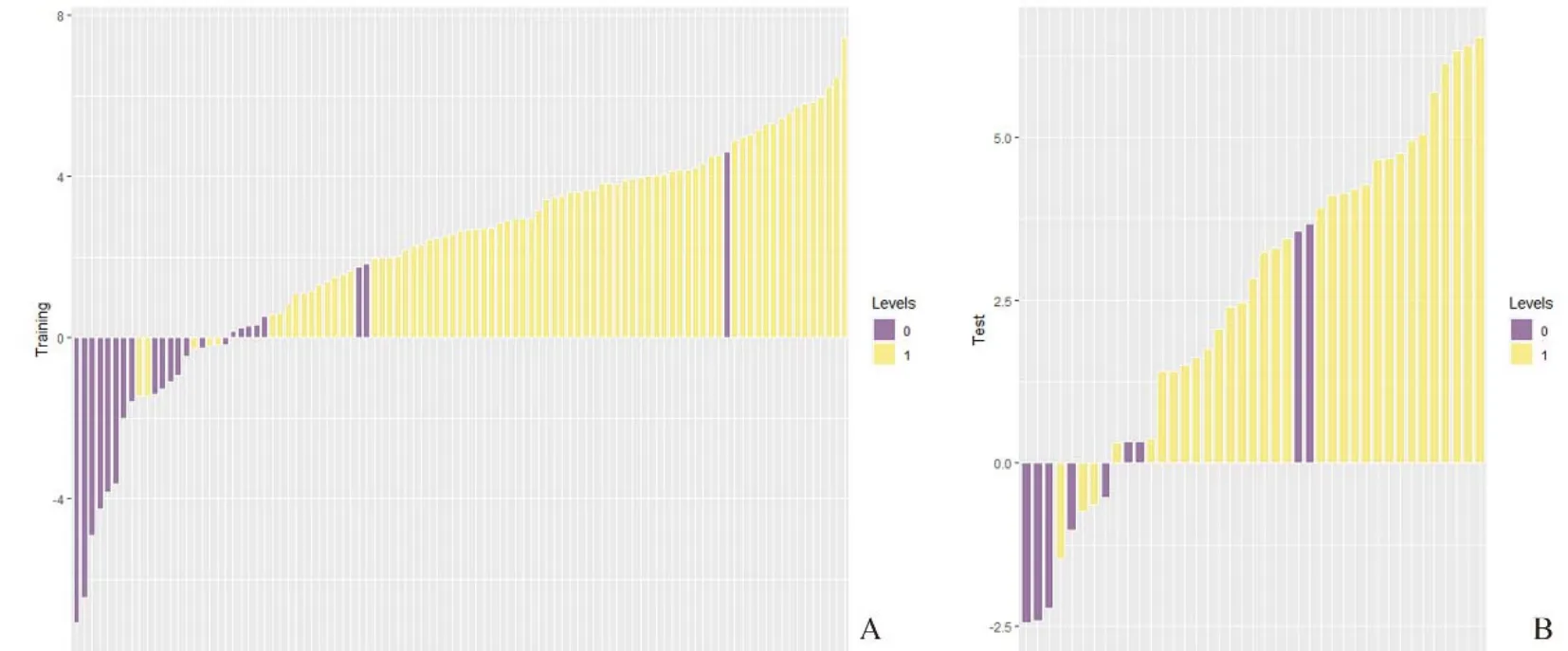
图3 综合模型预测nCRT后LARC患者pCR或npCR与病理结果的差异。A.训练组;B.测试组;紫色:npCR组;黄色:pCR组;当柱状图>0时,综合模型判断为pCR;当柱状图<0时,综合模型判断为npCR;如果紫色出现在黄色柱状区,表明患者被误判为pCR,但实际为npCR;当黄色出现在紫色柱状区,表明患者被误判为npCR,但实际为pCR
2.5 综合模型的校准性评估及DCA曲线 综合模型在训练组和验证组中具有较好的校准能力(校准曲线与45°理想拟合曲线贴近),见图4A、B;当风险阈值为2%~96%时,采用综合预测模型的临床获益高于影像组学模型或临床模型(图4C)。
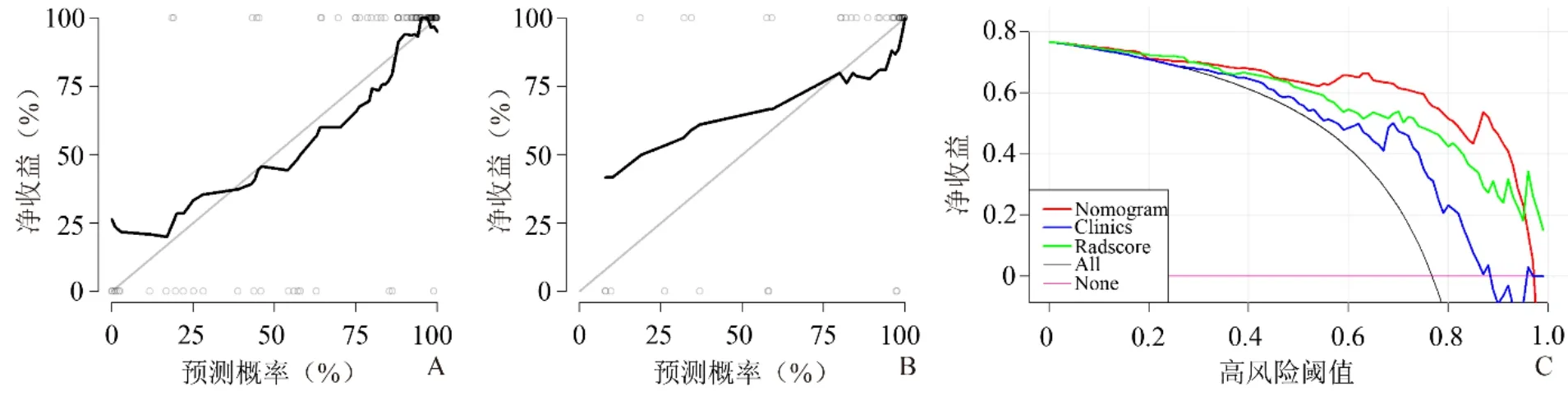
图4 训练组(A)、验证组(B)中综合模型的校准曲线及综合模型的DCA曲线(C)
2.6 构建诺模图 通过构建诺模图直观地呈现综合模型中的变量对LARC患者nCRT的预测价值,单个变量预测价值由评分表示。所有变量所得评分之和作为总评分评价患者pCR的概率(图5)。

图5 综合模型的诺模图
3 讨论
LARC患者接受nCRT后,70%~80%的患者肿瘤缩小或下移,部分患者甚至会出现完全退缩。据文献报道,约20%的患者在nCRT和手术后无残留活性肿瘤细胞[12-13]。这些病理学完全缓解的直肠癌患者长期预后良好,具有较好的局部控制率和较长的无病生存期,但仍有7%~37%的LARC患者治疗后未达到pCR[14]。因此,治疗前的预测能够极大地帮助临床医师评估nCRT的治疗效果,同时,对影响治疗反应和预后的危险因素进行研究有助于指导临床医师调整治疗策略,从而改善患者的预后。
本研究构建并验证了基于MRI影像组学的综合模型,个体化预测LARC患者nCRT疗效反应,该模型在评价nCRT治疗效果方面具有较好的特异度和准确度。相关研究显示从MRI动态增强序列提取的信号和特征在肿瘤疗效评价中具有巨大的潜力[15-16]。本研究选取动态增强注射对比剂后60 s的静脉期图像提取影像组学特征,与平扫序列相比,增强扫描采用三维容积快速扫描序列,层厚和层间距相对较小,肿瘤与周围组织的对比更明显,对ROI的勾画和图像分割更加精准,且增强序列包含了更多肿瘤内部的异质性信息。
本研究通过mRMR、LASSO算法及10倍交叉验证获得10个与疗效反应相关的影像组学特征。其中灰度空间区域矩阵(GLSZM)通过计算链接体素的组数分析具有相似灰度水平的体素组之间的距离;灰度依赖矩阵(GLDM)描述了在给定的方向和距离上,具有设定的灰度绝对差异像素的成对排列,用于突出局部异质性信息;GLSZM和GLDM是区域性纹理特征,在各种恶性肿瘤中已发现其区分不同预后的能力,表明肿瘤内的异质性是预测nCRT疗效反应和预后的重要标志物[17-18]。本研究构建了3种不同的预测模型,结果显示综合模型的预测效能最佳。综合模型预测LARC患者接受nCRT后pCR或npCR与病理结果的差异,在训练组的准确度为91.9%,AUC为92.2%;而在验证组的准确度为85.3%,AUC为84.0%。ROC曲线显示综合模型的预测效能优于影像组学和临床模型;DCA曲线显示,当风险阈值介于2%~96%时,采用综合模型预测LARC患者nCRT后pCR治疗策略优于将所有患者都看作pCR的策略,也优于将所有患者看作非pCR的策略,即该综合模型可用于协助临床筛选可能获益的pCR患者。同时采用诺模图作为nCRT疗效的评分系统,有助于个体化预测LARC患者的预后,帮助临床医师确定治疗策略。
本研究构建的综合模型预测效能优于单一的影像组学模型和临床模型,可能由于综合模型整合了影像组学和肿瘤异质性特征,并且融合了肿瘤的宏观结构和微观结构特征[19-20]。临床上通过该模型预测达到pCR的患者,需要进一步强化nCRT,即完成新辅助治疗,以期最大限度地提高pCR的可能性。尤其对于低位直肠癌患者,规律的nCRT后选择等待时机并保留括约肌功能与患者的远期生活质量直接相关。对于预测病理完全应答的患者,可采取保留器官和功能的治疗方案,加强随访。随访过程中采用直肠指诊、内镜超声和细针抽吸等方法明确诊断,如果检测到残留肿瘤细胞,应考虑巩固nCRT或行TME根治术。相比之下,对于综合模型预测不能达到pCR的患者,nCRT应选择毒性和副作用较小的改良方案,因为这一类患者不太可能从nCRT中获得较好的治疗效果。
本研究的局限性:①本研究是回顾性单中心研究,不同中心的放化疗方案不完全相同,可能导致疗效反应不尽相同;②本次单中心队列研究样本量相对较小,为验证模型的鲁棒性和可重复性,前瞻性多中心研究应为今后的研究方向;③本研究未能进行外部验证。
本研究基于MRI影像组学构建的综合模型对LARC患者的nCRT疗效反应具有较高的预测效能,且优于影像组学模型和临床模型,可辅助临床为LARC患者制订个体化治疗策略提供客观量化的指导。

