基于MRI的影像组学特征联合临床危险因素术前预测直肠癌淋巴结转移
杨燕,付芳芳,吴亚平,吉祥,王梅云*
1.郑州大学人民医院医学影像科,河南 郑州 450003;2.河南省人民医院 河南省神经疾病影像诊断与研究重点实验室,河南郑州 450003;3.郑州大学信息工程学院,河南 郑州 450001;*通信作者 王梅云 mywang@ha.edu.cn
结直肠癌的发病率和死亡率呈逐年上升趋势,目前发病率为10%,居恶性肿瘤第3位;死亡率为9.4%,居癌症致死率第2位[1-2]。结直肠癌中直肠癌占50%以上,晚期预后极差。术前确定直肠癌患者是否发生淋巴结转移对临床医师选择术式和预测预后至关重要,若淋巴结阳性的直肠癌患者未进行淋巴结清扫,会大幅度提高局部复发率[3-5],而对淋巴结转移不明确的患者采用淋巴结清扫术则会增加患者的创伤。目前,术前依据影像学特征(大小、形态等)诊断直肠癌淋巴结转移仍然具有挑战性[6],基于MRI的影像组学对淋巴结转移可能具有更好的诊断性能[7-9]。既往大部分关于直肠癌淋巴结转移的研究为基于CT图像的影像组学分析,而MRI具有更高的软组织分辨率,是目前评价直肠癌分期及淋巴结转移的首选影像学检查[10]。既往研究多采用T2WI、扩散加权成像(DWI)等序列,本研究基于多序列MRI[脂肪抑制T2加权成像(fat suppression-T2 weighted imaging,FS-T2WI)、T1加权增强(T1 weighted contrast-enhanced,T1CE)]并联合临床危险因素构建组学模型,术前个体化预测直肠癌患者的淋巴结转移状态,以期更好地辅助临床决策。
1 资料与方法
1.1 研究对象 回顾性纳入2016年12月—2020年12月河南省人民医院收治的直肠癌患者的MRI图像。纳入标准:①术后病理确诊为直肠癌;②术后病理证实有或无淋巴结转移;③术前有完整的MRI扫描图像。排除标准:①术前行新辅助治疗(放疗、化疗或靶向治疗);②合并其他恶性肿瘤;③MRI序列不全或图像扫描质量差无法评估。最终纳入350例直肠癌患者,男210例,女140例,年龄19~87岁,平均(61±12)岁。本研究通过本院医学伦理委员会批准[审批号:〔2019〕伦审第(68)号],并免除患者知情同意。
1.2 临床信息采集与分析 采集患者的年龄、性别、术前癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)199水平、肿瘤最大直径及有无远处转移等临床资料。将性别(男=1,女=2)及远处转移(有=1,无=0)分别定义。
1.3 MRI检查 采用西门子3.0T MR成像仪,采用盆腔阵列相控线圈。所有患者行常规术前MRI扫描。FST2WI扫描参数:视野300 mm×300 mm,矩阵272×320,TR 4 000 ms,TE 87 ms,层厚4 mm。DWI扫描参数:视野230mm×230mm,矩阵256×256,TR 2 400ms,TE 54 ms,层厚6 mm。T1CE扫描参数:视野380 mm×380 mm,矩阵288×320,TR 5 ms,TE 7 ms,层厚2.5 mm,对比剂采用钆喷酸葡胺,剂量0.1 mmol/kg,行轴位增强扫描。
1.4 MRI影像组学分析
1.4.1 MRI图像感兴趣区(ROI)勾画 从图像存档和通信系统获取MRI图像,基于轴位FS-T2WI、T1CE序列进行图像后处理,应用ITK-SNAP 3.8.0软件(http://www.itksnap.org/)在直肠癌病变区域勾画三维ROI。由1位具有5年工作经验的放射科主治医师进行手工勾画,另一位具有10年工作经验的放射科副主任医师检验,共同确定最终的ROI。最后,将每个序列的ROI保存为掩码文件(图1)。
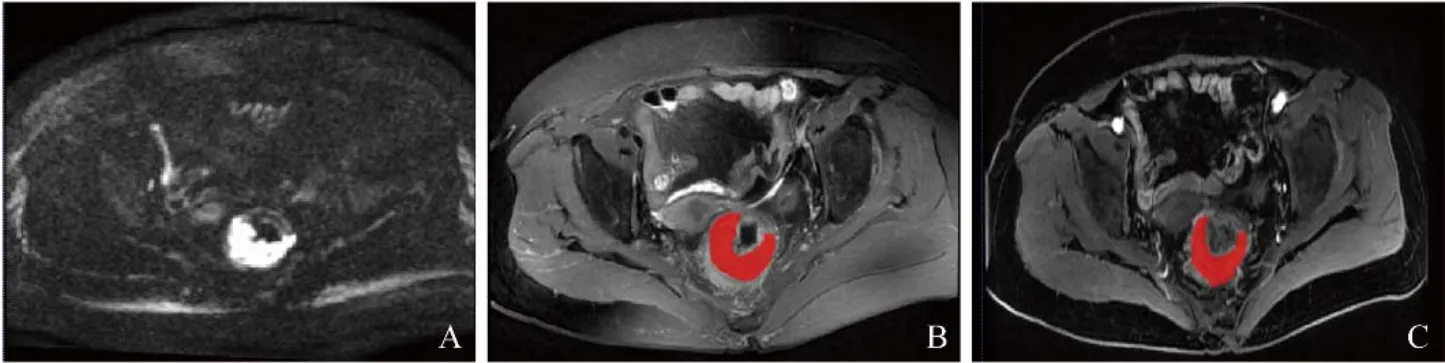
图1 直肠癌病变区ROI勾画单层图。A.轴位图像DWI;B.轴位图像FS-T2WI;C.轴位图像压脂T1CE
1.4.2 ROI影像组学特征提取 针对本研究中不同的影像序列,分别计算影像组学特征并进行组合,创建多序列组学特征。本研究计算的影像组学特征包括FS-T2WI、T1CE以及两者联合。
应用开源软件PyRadiomics 3.0.1(http: //github.com/Radiomics/pyradiomics)进行特征提取及分析。为了减少成像参数引起的图像差异,首先进行图像归一化、图像重采样预处理,应用12个滤波器(Original、BoxMean、AdditiveGaussianNoise、BinomiaIBIurlmage、CurvatureFlow、Boxsigmalmage、LoG、wavelet、Normalize、Laplacian Sharpening、DiscreteGaussian、ShotNoise)进一步进行特征提取,从每个序列的ROI中生成一阶统计特征(Firstorder)、形状特征(Shape)、直方图灰度共生矩阵(GLCM)、灰度游程长度矩阵(GLRLM)、灰度区域大小矩阵(GLSZM)、灰度共生矩阵(GLDM)、邻域灰度差矩阵(NGTDM)的图像特征,共提取2 600个特征。
1.4.3 影像组学特征筛选及建立模型 对于计算的影像组学特征,首先对提取的特征采用Z分数归一化,将数据转换为标准化强度范围,减小特征的量纲差异。对预处理的数据首先进行特征选择,采用方差阈值法删除低方差特征(<0.1),然后基于K最佳方法(Fvalue法,P<0.05)去除与分类标签相关性低的特征,最后应用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)去除不相关或冗余的特征(图2),并计算影像组学分数(Radscore),见图3。由于特征选择后特征数量仍然较大,本研究进一步应用独立成分分析、线性判别分析、非负矩阵分解或主成分分析进行特征降维,得到最终的特征。最后基于4种分类器(支持向量机、极致梯度提升、Logistic回归、Bagging决策树)训练得出不同的分类模型。图4所示的混淆矩阵显示了训练集和测试集模型的预测性能。
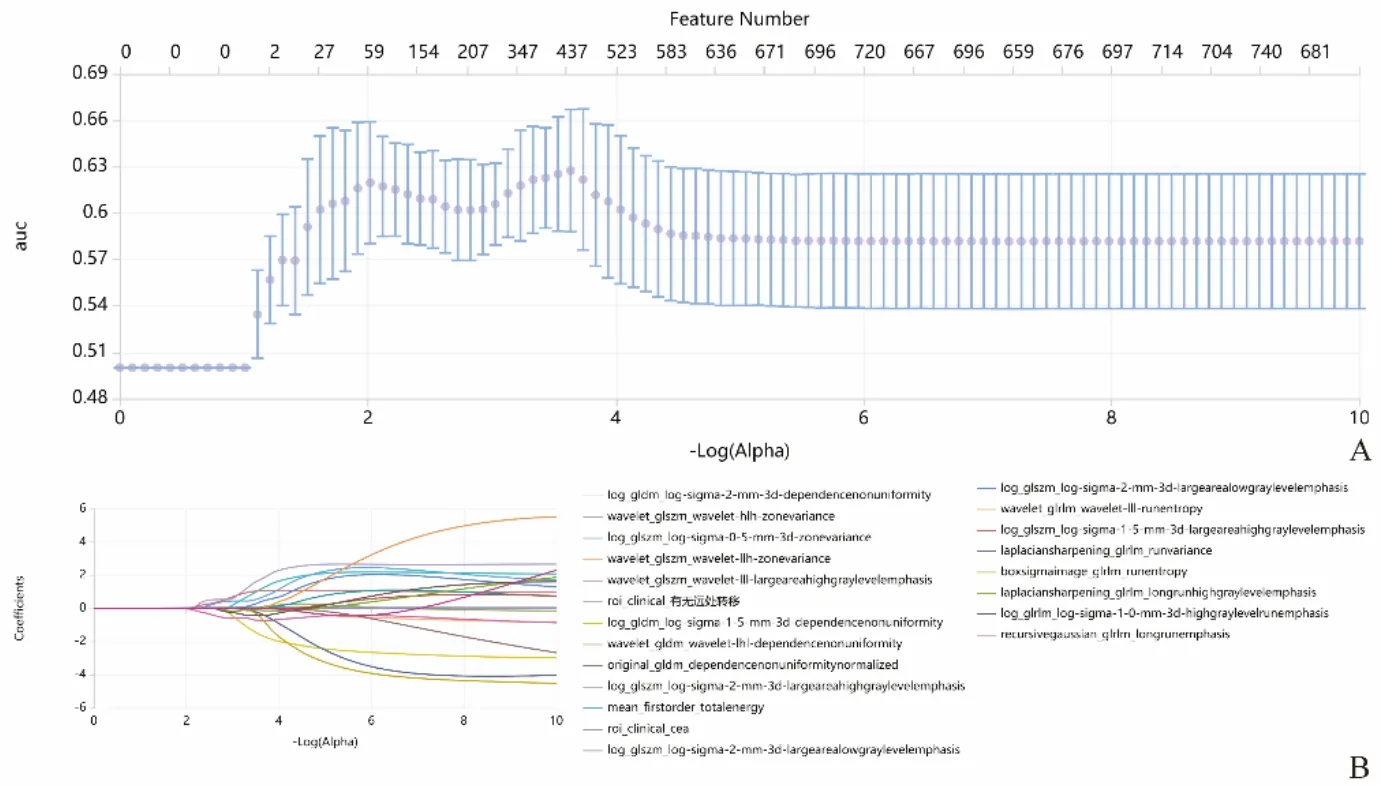
图2 LASSO降维特征筛选。A为LASSO模型中调节参数(λ)的选择;B为特征筛选过程中的LASSO路径
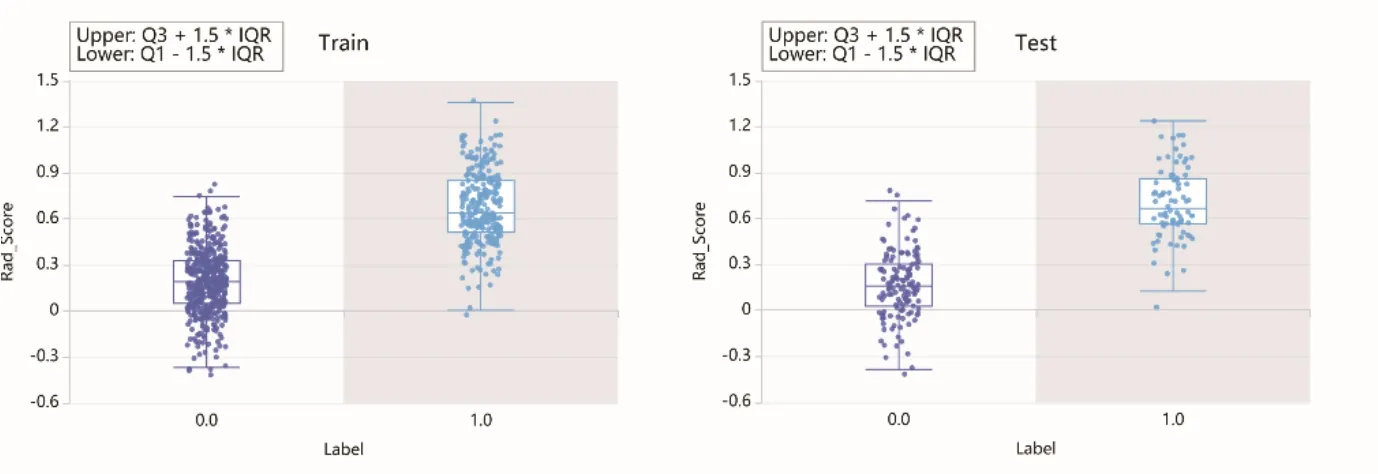
图3 训练集与测试集的Rad-score箱式图。轴坐标0代表预测标签为无淋巴结转移,1代表预测标签为有淋巴结转移
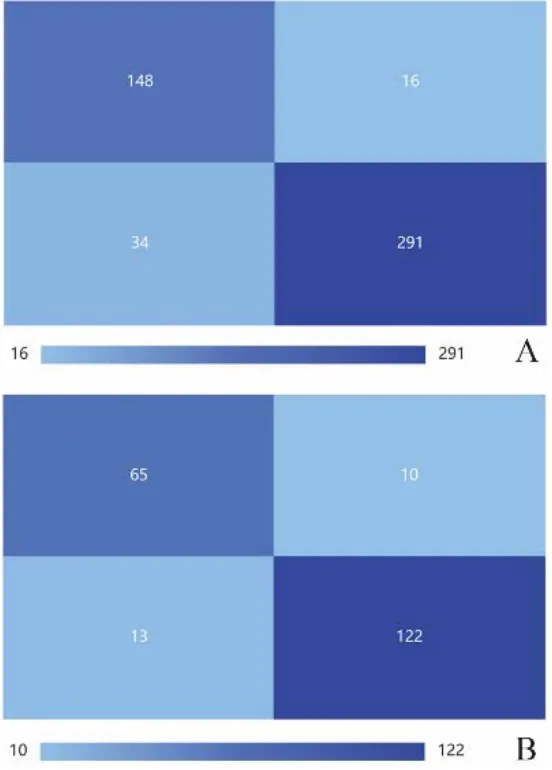
图4 训练集(A)和测试集(B)模型的混淆矩阵。左上角与右下角分别代表真阳性与真阴性,右上角与左下角代表假阳性与假阴性;真阳性与真阴性值越大,代表模型性能越好
针对FS-T2WI、T1CE和两者联合的影像组学特征,以及加入或不加入临床特征构建6个数据集,训练了6个预测模型,分别命名为FS-T2WI、T1CE、FS-T2WI+T1CE、FS-T2WI联合临床因素、T1CE联合临床因素及FS-T2WI+T1CE联合临床因素。以7∶3将患者随机分为训练集(245例)和测试集(105例),在训练集评估6个模型的诊断效能,并在验证集中对模型进行验证和测试。根据不同模型相对应的曲线下面积(AUC)及模型的敏感度、特异度、F1-score分数等筛选出最优模型。
1.5 统计学方法 采用SPSS 26.0软件,计量资料采用±s表示,两组间比较采用独立样本t检验;计数资料以例数或百分比表示,组间比较采用χ2检验;采用Logistic回归方法对直肠癌患者临床相关因素进行分析,筛选出淋巴结转移的危险因素,P<0.05为差异有统计学意义。使用验证集受试者工作特征AUC、敏感度、特异度等评估不同组合模型的诊断性能,并用Delong检验进行模型间AUC比较。
2 结果
2.1 临床资料 淋巴结转移组131例,无淋巴结转移组219例。两组患者CEA水平和有无远处转移差异有统计学意义(均P<0.05),其他临床特征组间差异均无统计学意义(均P>0.05),见表1。

表1 淋巴结转移组与无淋巴结转移组患者临床资料比较
2.2 直肠癌术前淋巴结转移的危险因素分析Logistic回归显示患者年龄、性别、CA199水平及肿瘤最大径与淋巴结转移无关(P>0.05),肿瘤CEA水平以及有无远处转移是淋巴结转移的危险因素(OR=1.026,95%CI1.010~1.042;OR=3.476,95%CI1.770~6.872,P均<0.005)。
2.3 影像组学特征筛选及模型建立 以FS-T2WI+T1CE联合临床特征的影像-临床联合模型为例介绍其模型建立过程:对提取的2 600个特征,经过方差阈值、K最佳及LASSO筛选出437个特征并构建Rad-score,然后应用线性判别分析将LASSO降维后的437个特征降到30个,再使用不同分类器建立预测模型。
2.4 直肠癌术前淋巴结转移模型与效能评估 本研究得出6个预测模型(表2)。测试集中,FS-T2WI、T1CE及FS-T2WI+T1CE联合临床特征模型的AUC分别显著大于单纯FS-T2WI、T1CE及两者联合序列模型的AUC(0.854比0.718,Z=2.951;0.925比0.888,Z=5.556;0.942比0.907,Z=2.779;P均<0.005),FS-T2WI+T1CE与临床联合模型的AUC大于FS-T2WI与临床联合模型的AUC(0.942比0.854,Z=4.061,P<0.001),T1CE与临床联合模型的AUC大于FS-T2WI与临床联合模型的AUC(0.925比0.854,Z=3.733,P=0.0002),FST2WI+T1CE与临床联合模型的AUC较T1CE与临床联合模型的AUC差异无统计学意义(0.942比0.925,Z=0.113,P=0.9103)。结合其他评价指标,测试集中FS-T2WI+T1CE与临床特征组合模型AUC最大,敏感度、特异度及F1-sore值均高于T1CE与临床联合的模型,因此被确定为最佳预测模型,见图5。

图5 6种预测模型在验证集中的受试者工作特征曲线
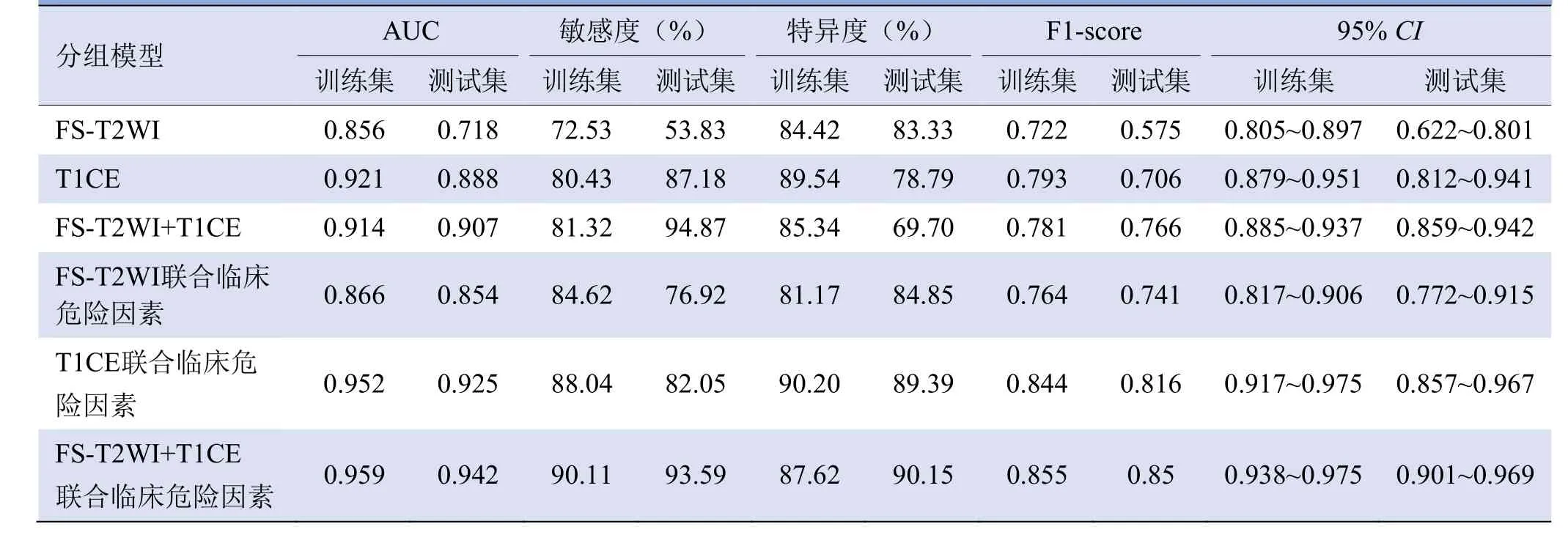
表2 MRI组学模型及联合模型对淋巴结转移的诊断效能
3 讨论
本研究探讨了基于多模态MRI影像组学特征及临床危险因素对直肠癌患者术前淋巴结转移的预测模型。既往影像组学分析通常在肿瘤最大病变层面上勾画单层图像ROI。本研究采用手动逐层勾画三维ROI,三维比二维ROI包含了更多重要的空间信息[11],同时手动勾画ROI会使结果更准确。既往预测直肠癌术前淋巴结状态的研究主要有基于CT纹理特征、基于高分辨率T2WI、DWI等序列提取的影像特征以及单序列联合临床特征构建的模型[12-13],本研究应用FS-T2WI、T1CE、两序列联合,并将两序列与联合序列分别与临床危险因素联合,对直肠癌患者是否发生淋巴结转移进行评价。FS-T2WI较T2WI能够抑制背景及肿瘤内脂肪组织信号,增加病灶与周围组织的对比度。由于肿瘤细胞生长依靠丰富的血供,随着微血管密度增加,转移淋巴结的形态也随之改变[14],T1CE序列可以反映病灶的血供情况,能够从淋巴结丰富的微循环和血管表面积中提取更重要的特征,增加模型的预测性能。
本研究建立的6个预测模型中,FS-T2WI+T1CE影像学特征联合临床特征构成的影像-临床组学模型最优,可能是因为其联合了FS-T2WI与T1CE的优点,更能反映病灶的异质性,机器从中能提取更多有价值的影像组学特征;且提取的影像特征进一步与临床危险因素联合,进而提高了模型效能。本研究发现结合临床危险因素能提高模型性能,与既往研究结果一致[7,9,15-17]。近年关于评估直肠癌患者淋巴结转移的放射组学研究逐渐增多,研究者基于CT和MRI的放射性组学模型的AUC约为0.77~0.87[18-19],低于本研究获得的最高AUC。Li等[17]在T2WI基础上直接对淋巴结本身提取影像特征,结合放射科医师的分析,AUC可高达0.94,但此方法对淋巴结本身的定位并不容易,仅纳入较大的或肉眼可见的淋巴结。
除影像组学特征标签外,本研究中临床因子CEA水平为淋巴结转移的独立危险因素,与既往研究结果一致[7,20],可能是因为CEA在细胞的黏附和增殖中起基础作用,参与直肠癌的转移和复发,CEA水平越高,提示肿瘤细胞的增殖能力越强,浸润性、转移性越强[17,20]。此外,本研究发现有无远处转移与淋巴结是否转移具有相关性,表明发生远处转移的直肠癌在微观上很可能已经侵犯了肠周淋巴结,对直肠癌的术式应该扩大范围。在CA199、年龄、性别及肿瘤最大直径等因素上,不同研究得出的结论不一。本研究中,上述因素均与淋巴结是否转移无关,与Zhou等[8]和Liu等[9]的研究结论一致,而与Glynne-Jones等[3]和Li等[21]的研究不同,可能与样本量大小不同或纳入及排除标准不同有关,需要增加样本量进一步研究。此外,本研究为单中心研究,缺乏独立的外部验证,计划在将来的研究中纳入多中心样本解决以上问题。
总之,基于MRI影像组学联合临床危险因素构建的影像-临床组学模型可以更好地预测淋巴结转移状态,能够作为评估直肠癌患者术前淋巴结转移的个体化决策支持工具,更好地辅助临床医师对患者进行术前决策、术后评价、预后评估,制订个体化临床治疗方案。
利益冲突 所有作者均声明不存在利益冲突

