光谱CT量化的细胞外容积评估结直肠癌神经、血管及淋巴管浸润
郑文霞,王莉莉,陈杏彪,郑小霞,崔雅琼,马颖,魏照坤,梁小芹,黄刚*
1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000;2.甘肃省人民医院放射科,甘肃 兰州 730000;3.甘肃省人民医院病理科,甘肃 兰州 730000;4.飞利浦医疗临床科研部,上海 200070;*通信作者 黄刚 keen0999@163.com
近年来,随着生活习惯及饮食结构的变化,结直肠癌的发病率居高不下,且发病年龄逐渐年轻化[1]。结直肠癌的早期精准诊断有助于使患者得到早期临床干预,能够最大程度地降低疾病带来的生理损伤。双层探测器光谱CT是新型的基于探测器的能谱CT,一次扫描即可获得高低能量数据,能够比常规CT提供更多的参数和图像信息[2],同时还可以发现和诊断肿瘤早期隐匿病灶[3],为结直肠癌的影像诊断提供了新的思路和方法。相关研究表明基于光谱CT 40 keV的单能级图像可以提高直肠癌术前T分期的准确度[4],有利于个体化治疗的决策评估。
细胞外基质是肿瘤微环境的重要组成部分[5],细胞外容积(extracellular volume,ECV)是细胞外基质的量化因子。目前ECV的临床应用多集中于心脏方面,如评估心肌纤维化[6]、预测心肌梗死[7]、心肌淀粉样变的诊断及预后[8]等,也可用于评估肝纤维化分级[9]。随着研究者对肿瘤微环境关注度上升,ECV在肿瘤中的应用也在逐渐增加。Song等[10]在III期结直肠癌患者预后的研究中,发现血管、淋巴管内癌栓的形成与免疫异质性肿瘤微环境密切相关。而目前临床上通常需要通过病理组织活检获取神经、血管、淋巴管浸润状态。本研究通过使用基于双层探测器光谱CT增强扫描测定的ECV值评估结直肠癌组织是否存在神经、血管及淋巴管浸润带来的肿瘤细胞微环境改变,以期获得一种术前评估的方法。
1 资料与方法
1.1 研究对象 收集2020年7月—2021年2月在甘肃省人民医院就诊的95例结直肠癌患者,年龄32~84岁,平均(60.5±10.7)岁;结肠癌22例,直肠癌73例。纳入标准:①首次诊断结直肠癌,无化疗及手术病史;②术前行光谱CT检查,术后病理诊断为结直肠癌。排除标准:①病理资料不全,或为腺瘤及其他良性肿瘤;②图像有伪影不满足测量要求。本研究经本院医学伦理委员会批准(2021-196),所有患者检查前均签署知情同意书。患者一般资料见表1。
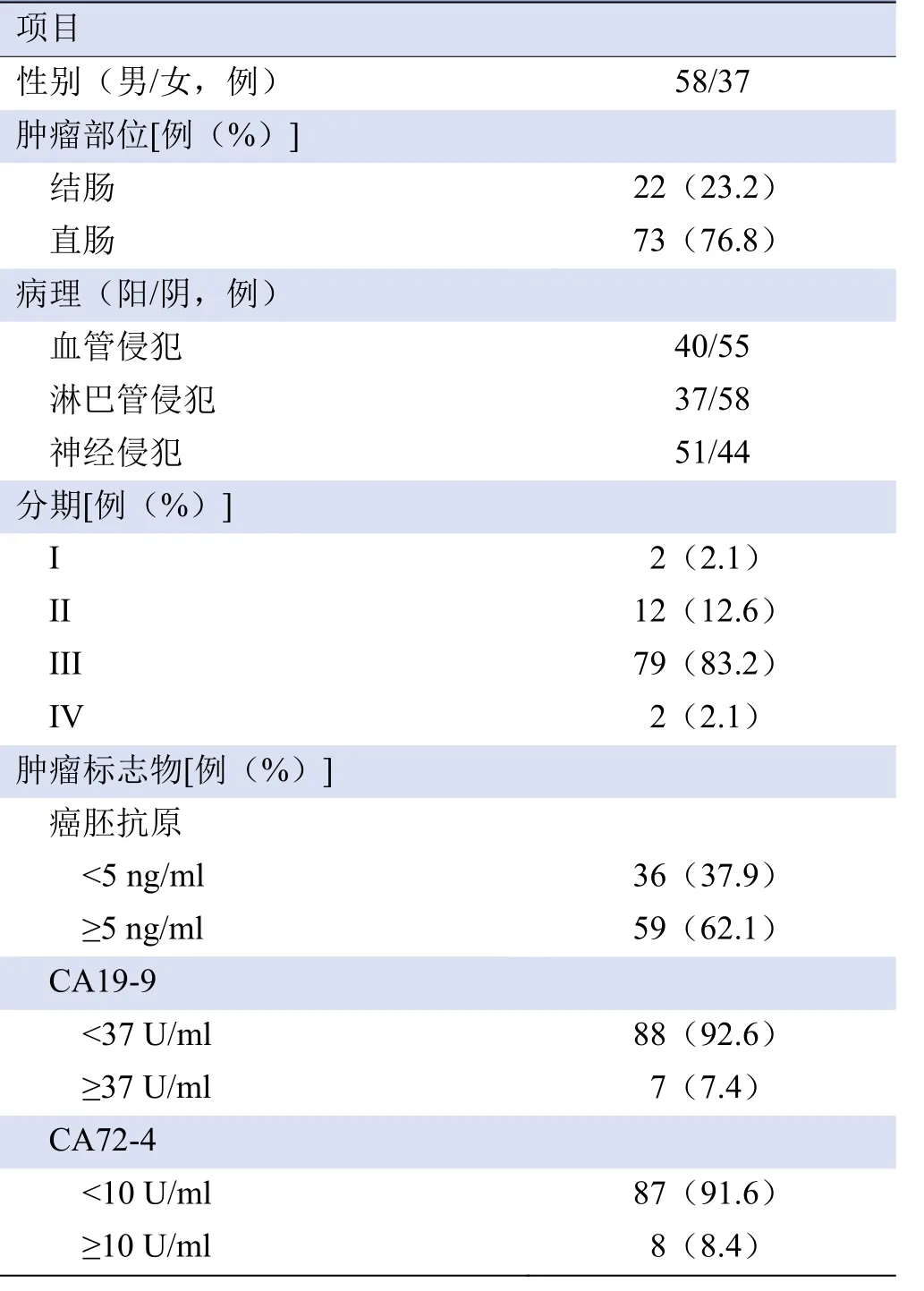
表1 95例结直肠癌患者一般资料
1.2 CT检查方法 所有患者用光谱CT进行增强扫描,采用双筒高压注射器,从肘正中静脉注入1.5 ml/kg碘克沙醇(320 mgI/ml),速度3.5 ml/s,随后以相同速度注入50 ml生理盐水。采集25 s动脉期、60~70 s静脉期及2 min延迟期图像。主要参数:层厚5 mm,管电压120 kV,自动毫安秒,螺距0.953,转速0.5 s/转。采集后图像利用IntelliSpace Portal 10.1后处理工作站进行数据测量。
1.3 图像分析及数据测量 患者行光谱CT增强后选择静脉期及延迟期图像,重建后的光谱基数据导入后处理工作站,测量结直肠肿瘤病变两期的碘密度(iodine density,ID):感兴趣区选择在肿瘤实质区域,范围35~55 mm2,避开非肿瘤部位、水肿区及血管伪影,测量3个不同层面感兴趣区ID的平均值,并同时测量肿瘤同层面腹主动脉或髂外动脉ID的平均值。用同一方法对纳入患者选择其病变上或下5个层面的正常肠壁及血管,测量两期的ID。计算ECV,ECV(%)=(1-红细胞压积)×(IDROI/IDblood)×100,其中红细胞压积于检查前3 d内采集,IDROI为肿瘤及正常肠壁的ID,IDblood为肿瘤同层面腹主动脉或髂外动脉的ID。为保证结果的可重复性,3个月后重新测量一次数据。
1.4 病理及免疫组化检查 所有送检组织送病理切片,病理阳性标准严格按照试剂说明书进行。疑有血管、淋巴管内癌栓及神经侵犯者行免疫组化染色,血管、淋巴管及神经侵犯分别用CD31、D2-40、S100表示,染色后棕黄色为(+),见图1。

图1 血管、淋巴管内癌栓及神经侵犯病理免疫组化染色(20×10)。A.血管内癌栓(箭);B.淋巴管内癌栓(箭);C.神经侵犯(+,箭)
1.5 统计学分析 采用SPSS 25.0软件,符合正态分布的计量资料用±s表示,两组比较采用独立样本t检验,计数资料以例数或百分比表示,前后2次测量结果用组内相关系数(ICC)检验。以术后病理结果为“金标准”,应用受试者工作特征曲线下面积(AUC)分析ECV的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 血管、淋巴管、神经侵犯阳性及阴性组间ECV比较 3项免疫组化阳性与阴性组的ECV在延迟期差异均有统计学意义(均P<0.001),在静脉期差异均无统计学意义(均P>0.05),见表2、图2~3。

图2 男,50岁,直肠下段中分化腺癌,无血管、淋巴管及神经侵犯,红细胞压积0.533。A.静脉期病变常规CT图;B.延迟期病变常规CT图;C.静脉期病变碘密度图,ECV=0.23;D.延迟期病变碘密度图,ECV=0.26
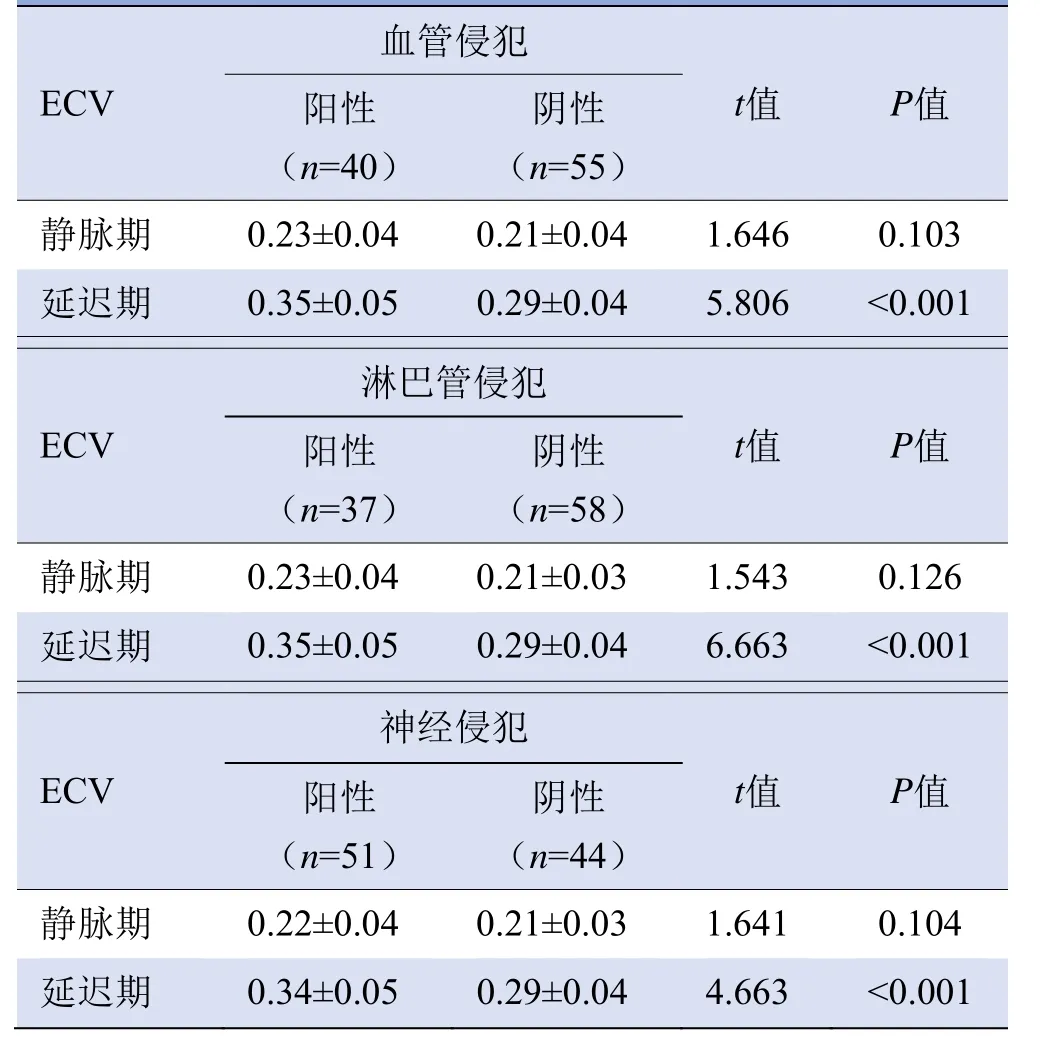
表2 静脉期及延迟期血管、淋巴管、神经侵犯阳性、阴性组的ECV比较
2.2 ECV对血管、淋巴管、神经浸润的诊断效能静脉期、延迟期ECV对于免疫组化的AUC分别为:血管侵犯0.576、0.798,淋巴管侵犯0.575、0.838;神经侵犯0.584、0.759,见表3、图4A~C。

表3 ECV对血管、淋巴管、神经侵犯的诊断效能
2.3 结直肠癌与同期正常肠壁的ECV比较 静脉期、延迟期ECV对于结直肠癌的AUC分别为0.962、0.975,两期结直肠癌与同期正常肠壁的ECV相比差异均有统计学意义(P均<0.001),见表4、图3 E、F、图4D。
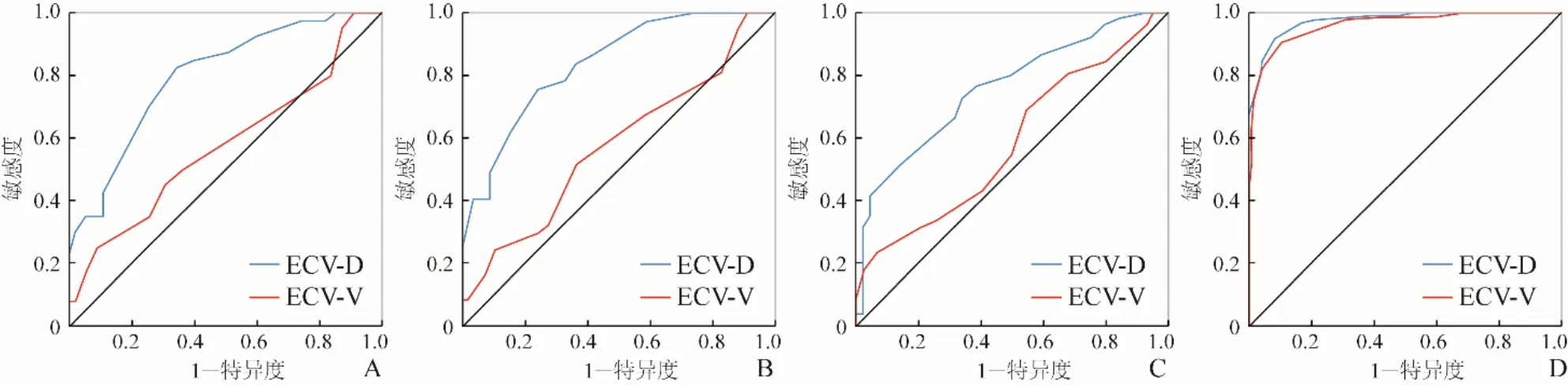
图4 ECV对结直肠癌神经、血管、淋巴管浸润及结直肠癌的受试者工作特征曲线。ECV-D为延迟期;ECV-V为静脉期;A.血管侵犯;B.淋巴管侵犯;C.神经侵犯;D.结直肠癌

表4 静脉期、延迟期结直肠癌与同期正常肠壁ECV比较

图3 男,60岁,直肠下段中分化腺癌,有血管、淋巴管及神经侵犯,红细胞压积0.421。A.静脉期病变常规CT图;B.延迟期病变常规CT图;C.静脉期病变碘密度图,ECV=0.23;D.延迟期病变碘密度图,ECV=0.40;E.静脉期正常肠壁碘密度图,ECV=0.09;F.延迟期正常肠壁碘密度图,ECV=0.15
2.4 一致性检验 结直肠癌与正常肠壁静脉期、延迟期测量结果的一致性良好(ICC均>0.75)。
3 讨论
细胞外基质是位于机体细胞外的生物大分子,包括胶原蛋白、蛋白多糖以及各种代谢相关的酶和细胞因子等。细胞外基质在正常情况下抑制肿瘤生长,但在恶性肿瘤中发生变化,引起肿瘤微环境改变,在一定程度上可以反映肿瘤的演变情况[11]。肿瘤微环境是肿瘤发生、发展过程中由细胞外基质和基质细胞组成的复杂系统,基质细胞主要包括成纤维细胞、炎症免疫细胞、脂肪细胞和血管内皮细胞等,其中癌相关成纤维细胞在肿瘤生长、进展和转移过程中起到关键作用。Kalluri[12]提出细胞外基质重塑性癌相关成纤维细胞(F4型),具有重塑细胞外基质的功能,增强了肿瘤的增殖和侵袭性。
ECV是细胞微环境中细胞外基质占据的空间,代表细胞外基质的体积分数,影像学检查测得的ECV值与组织活检测得的细胞外间质量具有一致性[13-15],因此可以用ECV值定量表示病变的细胞外间质[16]。相关研究发现胰腺癌、胸腺瘤组织的ECV与肿瘤的治疗及预后相关[17-18],本研究探讨通过ECV评估结直肠癌神经、血管及淋巴管浸润的可行性及诊断效能。
3.1 ECV评估结直肠癌神经、血管、淋巴管侵犯的价值神经侵犯是指结直肠癌的癌细胞侵犯神经鞘,诱发神经重塑和神经环境的改变,从而影响肿瘤的微环境,预示病变侵袭性强,容易引起扩散及转移[19]。血管、淋巴管癌栓的形成在临床上认为是肿瘤预后的重要危险因素。相关研究表明在子宫内膜癌、胃癌、结直肠癌等肿瘤中,脉管癌栓形成是预后的独立危险因素[20-22]。
本研究利用增强后造影剂在组织细胞的分布,基于ID测量结直肠癌的ECV[23-24],发现免疫组化表达阳性组的ECV升高明显,提示肿瘤破坏血管、淋巴管、侵犯神经等,可引起细胞微环境变化。血管、淋巴管、神经侵犯是肿瘤发生转移的关键因素,邵瑞丽[25]发现ECV可以预测结肠癌的肝转移及淋巴结转移,但其未纳入对血管、淋巴管、神经侵犯的研究。本研究发现静脉期所测ECV与免疫组化是否阳性之间差异无统计学意义,而延迟扫描的ECV值升高,且与免疫组化是否阳性差异有统计学意义,表明对比剂在细胞外间质中平衡分布可能需要较长的时间,在静脉期肿瘤组织内的对比剂还未达到细胞外间质的平衡状态[26],此期ECV不能评估对肿瘤的神经、血管及淋巴管浸润,而延迟期可评估其状态[27]。本研究对比延迟期与静脉期的ECV,发现延迟期均高于静脉期,且对神经、血管和淋巴管是否浸润有明显差异,表明延迟期造影剂在织细胞间隙中的分布更接近平衡状态,更能反映肿瘤细胞外间质的变化。本研究同时测量正常肠壁的ECV作为对照,发现肿瘤组织的ECV高于正常肠壁,进一步表明ECV能够反映肿瘤的细胞外间质变化。
本研究中免疫组化表达阳性的ECV升高,与既往在结肠癌发生肝转移和淋巴结转移ECV值更高[25]的研究结果一致,即ECV升高是不良预后指标;而另一项研究发现在IV期胰腺癌中,肿瘤ECV分数较高的患者预后更好[18],其原因可能是:虽然胰腺癌和结直肠癌均为消化道肿瘤,生物学特性却存在差异,胰腺癌为乏血供肿瘤,而结直肠癌血供较丰富,容易产生大量的肿瘤新生血管,对比剂进入细胞外间隙相对增多;同时胰腺癌更易发生坏死,也会影响ECV的结果,具体还需在今后的研究中进行大样本量及多中心验证。
3.2 ECV反映肿瘤细胞外间质改变可能的机制 肿瘤细胞的发生伴随着细胞外微环境的变化,在转化细胞与微环境中基质和免疫细胞的相互作用演化过程中,出现细胞外基质沉积、成纤维细胞激活、不断聚集,以及一些炎症细胞浸润,使得肿瘤细胞微环境的可视化量化因子ECV发生变化[28]。本研究结果显示肿瘤组织的ECV升高,进一步反映出结直肠癌微环境变化的病理改变,可能的机制为:一方面,肿瘤细胞数量越多,密度越大,合成的大分子蛋白增多,影响细胞整体运动,使造影剂扩散受限,在细胞外间隙滞留时间长[29]。另一方面,肿瘤相关的基质细胞通过刺激肿瘤血管生成、重塑细胞外基质,癌细胞与肿瘤微环境之间复杂的相互作用引起ECV的变化[30]。此外,恶性肿瘤新生血管网丰富、但欠成熟,血管脆性大,因此血流量、血容量、血管通透性明显增加,导致造影剂进入组织间隙增多引起ECV变化[31]。
3.3 本研究的创新点 ①结直肠癌的神经、血管、淋巴管浸润诊断依赖于有创的病理组织活检,本研究与既往研究相比,应用双层探测器光谱CT参数ID计算ECV,无创评估结直肠癌导致的肿瘤组织细胞外微环境改变,仅需采集一次红细胞压积及CT检查,避免了有创检查。②ECV在组织纤维化和淀粉样变研究较多,对肿瘤微环境改变的研究尚少,本研究为临床术前无创评估结直肠癌神经、血管及淋巴管浸润提供新的思路和方法,也为双层探测器光谱CT参数更好地应用于肿瘤研究提供了思路和参考。③目前关于ECV的研究多集中于普通CT,需要平扫和增强两项检查,本研究采用光谱CT碘密度参数,避免了二次扫描,且经增强图像测得的ECV易整合至常规检查中,于临床更为方便可行。
3.4 本研究的局限性 ①本研究样本量较小,仅纳入结直肠癌患者,腺瘤等良性肿瘤未纳入本研究,使结果有一定局限性。②结直肠属空腔器官,不同于实质器官,测量数据过程中虽尽量将感兴趣区放置在肿瘤实性部分提高准确度,但难以避免部分肿瘤组织坏死及水肿的影响,部分测量结果可能存在偏差。③关于延迟时间的确定,目前未见统一报道。本研究用2 min延迟扫描,用静脉期作为对照,结果显示两期ECV均可反映细胞微环境变化,但延迟期ECV值升高明显,能够反映肿瘤组织的神经、血管、淋巴管浸润情况,具体延迟时间更长是否更有意义有待进一步探索。④本研究纳入对象的红细胞压积均在检查前3 d内采集,不同时间窗可能影响结果的准确度,需在此后的研究中证实。⑤本研究探讨了ECV对结直肠癌发生神经、血管及淋巴管浸润的价值,但未进一步随访患者的生存期,今后将结合两方面的研究,对结直肠癌患者的转移因素及预后进行全面分析,得出更可靠的结果。
总之,经初步研究发现,ECV可以反映结直肠癌神经、血管、淋巴管浸润情况,也可以区分癌组织与正常肠壁。希望随着研究的不断跟进,ECV在结直肠疾病的诊断、淋巴转移及预后方面提供更多价值。
利益冲突 所有作者均声明不存在利益冲突
——淋巴管系统

