脓毒症性凝血病患者预后预测模型的建立
何习斯, 邹志业, 文 莎, 陈燕宏, 孟新科
脓毒症凝血功能障碍是导致患者多器官功能障碍的重要因素之一,目前受到广泛关注。据文献研究[1-2]结果显示,50%~70%的脓毒症患者存在凝血功能障碍。脓毒症性凝血病(sepsis-induced coagulopathy, SIC)贯穿脓毒症病理生理的整个过程,从脓毒症到脓毒性休克,SIC的发生率随之增加[3]。基于脓毒症(Sepsis-3)新定义及诊断标准[4],以及2017年国际血栓与止血大会(international society on thrombosis and hemostasis, ISTH)科学标准委员会提出SIC的诊断标准,用于区分脓毒症凝血功能异常[5]。SIC诊断标准简便、快捷,主要包括序贯器官衰竭评分(sequential organ failure assessment, SOFA)、血小板计数(PLT)和国际标准化比值(international normalized ratio, INR)三项,该评分标准可用于早期筛查弥散性血管内凝血(disseminated intravascular coagulation, DIC),也可以评估疾病的严重程度。有研究[6]表明,绝大多数显性DIC患者符合SIC的标准,而且在所有病例中SIC的发生先于显性DIC。
本研究基于美国重症监护医学信息数据库-Ⅲ(Medical Information Mart for Intensive Care-Ⅲ, MIMIC-Ⅲ),通过医疗大数据分析确定新脓毒症定义下的SIC患者28 d死亡的危险因素,建立预后预测模型,旨在及早识别影响SIC患者预后的危险因素,尽早给予有效干预及防治措施,避免SIC向DIC进展,提高患者的生存率。
1 资料与方法
1.1数据来源和伦理学 本研究为回顾性队列研究,所有数据均从MIMIC-Ⅲ数据库提取,该数据库是美国麻省理工学院计算生理学实验室和贝斯以色列迪康医学中心建立的重症医学数据库,包含2001年至2012年在ICU住院患者的临床数据。数据包括生命体征、评分、实验室检测、影像学报告、住院时间及生存数据等。本研究的研究者已完成美国国立卫生研究院(NIH)网站上的“保护人类研究参与者”课程并获得数据使用权(证书编号:43312706)。数据库的创建、维护和使用得到了麻省理工学院和贝斯以色列迪康医疗中心的机构审查委员会的批准。为了保护隐私,数据库中所有患者的记录均是匿名化处理,无需知情同意。
1.2纳入及排除标准 纳入标准:①年龄≥18岁;②符合脓毒症(Sepsis-3)诊断标准[4]。排除标准:①INR或PLT数据缺失;②住ICU时间<24 h;③入院前使用抗凝药或存在血液系统疾病;④不符合SIC诊断。
1.3SIC诊断和分级 2017年ISTH科学标准委员会提出的SIC诊断标准[5]。该诊断标准包括PLT、INR和SOFA评分三项,评分≥4分即可诊断SIC。基于PLT和INR的最差值,将SIC患者的严重程度分为三级[7]:轻度SIC(1.2≤INR<1.4,100×109/L≤PLT<150×109/L)、中度SIC(1.4≤INR<1.6,80×109/L≤PLT<100×109/L)和重度SIC(INR≥1.6,PLT≤80×109/L)。
1.4数据提取 从MIMIC-Ⅲ数据库中提取一般资料(年龄、性别)、合并症(慢性阻塞性肺病、糖尿病、充血性心力衰竭、高血压病、心脏瓣膜病、慢性肾脏病及实体肿瘤等)、实验室检查[血白细胞计数(WBC)、PLT、INR]、干预措施(有无使用呼吸机及血管活性药物)及住ICU时间等数据。所有提取的实验室检查结果为患者入ICU首个24 h内的最大值(max)和最小值(min)。提取入ICU首个24 h内最差的数据,计算SOFA评分。

2 结果
2.1SIC患者存活组和死亡组基本资料比较 共入选脓毒症患者12 681例,根据纳排标准,最终纳入SIC患者6347例。根据28 d临床结局,分为存活组5396例和死亡组951例,SIC患者总体病死率为14.98%(951/6347)。死亡组年龄、充血性心力衰竭比例、血管活性药物治疗比例、机械通气治疗比例、住ICU时间、血WBCmax、INRmax、SOFA评分、重度SIC比例均高于存活组,而糖尿病、高血压病、轻度SIC患者比例及PLTmin低于存活组,差异均有统计学意义(均P<0.05);两组患者性别分布及中度SIC、慢性阻塞性肺病、心脏瓣膜病、慢性肾脏病和实体肿瘤比例比较差异均无统计学意义(均P>0.05)。见表1。

表1 SIC患者存活组和死亡组基本资料比较
2.2SIC患者28 d死亡的多因素Logistic分析 为避免多重线性问题,最后纳入轻度SIC、重度SIC、年龄、SOFA评分、充血性心力衰竭、高血压病、糖尿病、血WBCmax为自变量,结局为因变量进行多因素Logistics回归分析,结果显示,重度SIC、年龄、SOFA评分、血WBCmax是SIC患者28 d死亡的独立危险因素(均P<0.05)。见表2。
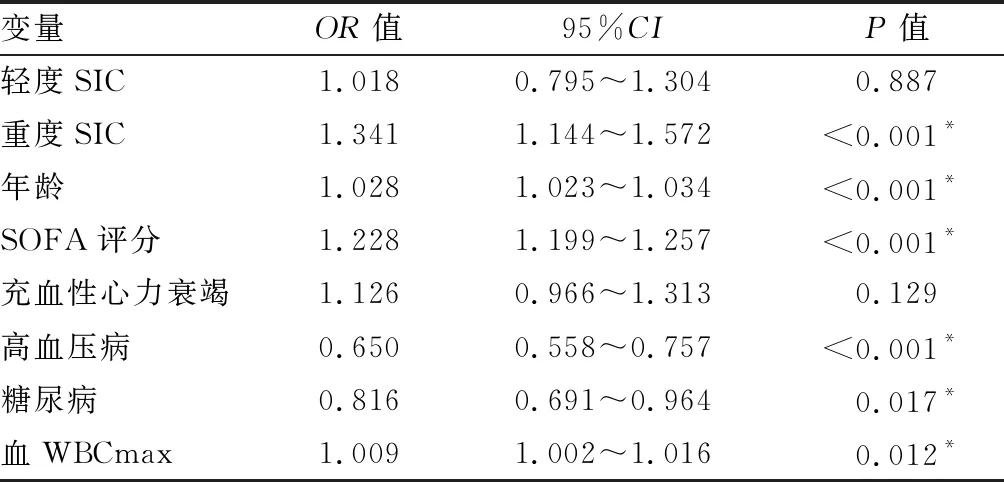
表2 SIC患者28 d死亡多因素Logistics回归分析
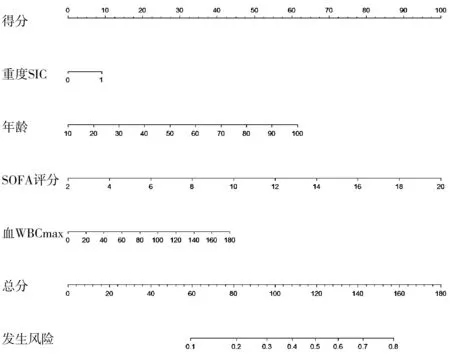
2.3SIC患者预后预测模型的建立与验证 将多因素Logistic回归分析中OR>1、P<0.05的因素(重度SIC、年龄、SOFA 评分、血WBCmax)纳入列线图构建预后风险评估模型(见图1),模型方程=-5.031+0.332×重度SIC+0.025×年龄+0.204×SOFA评分+0.009×WBCmax。使用Bootstrap法内部重复抽样1000次进行验证,校正曲线判断预测值与实际值一致性较好(见图2)。通过Hosmer-Lemeshow拟合优度检验来评价预测模型的校准能力,结果显示,Hosmer-Lemeshow检验表中χ2=14.287,P=0.075,提示模型预测值与实际观测值差异无统计学意义(P>0.05),预测模型有较好地校准能力。DCA曲线分析显示,阈值概率在0.3~0.8之间时,都能获得较高的净获益,提示模型预测具有较高的临床实用性。
注:SIC为脓毒症性凝血病;SOFA为序贯器官衰竭评分;WBCmax为白细胞计数最大值
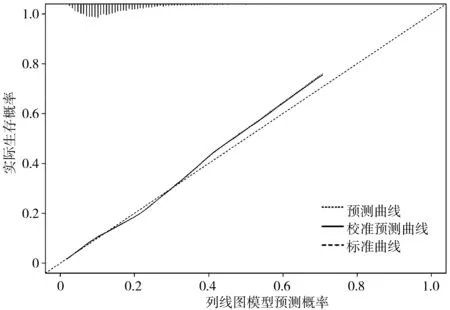
图2 SIC患者预测预后列线图的校准曲线
2.4预测模型预测SIC患者预后的ROC曲线 预测模型预测SIC患者28 d死亡的ROC曲线AUC为0.703,95%可信区间(95%CI)为0.685~0.722,P<0.001,即该模型预测SIC患者发生死亡的概率为70.3%;当模型截断值为0.170时,敏感度为55.7%,特异度为73.9%;随着模型分值的增高,SIC患者28 d死亡的发生概率增高。对比重度SIC、年龄、SOFA评分和血WBCmax各指标的AUC,预测模型的AUC值高于单一指标构建模型的AUC值,预测效果优于单个指标预测。预测模型AUC与重度SIC、年龄、SOFA评分、血WBCmax的AUC比较差异均有统计学意义(重度SIC:Z=13.189,P<0.001;年龄:Z=10.214,P<0.001;SOFA评分:Z=6.325,P<0.001;WBCmax:Z=13.000,P<0.001)。见表3、图4。
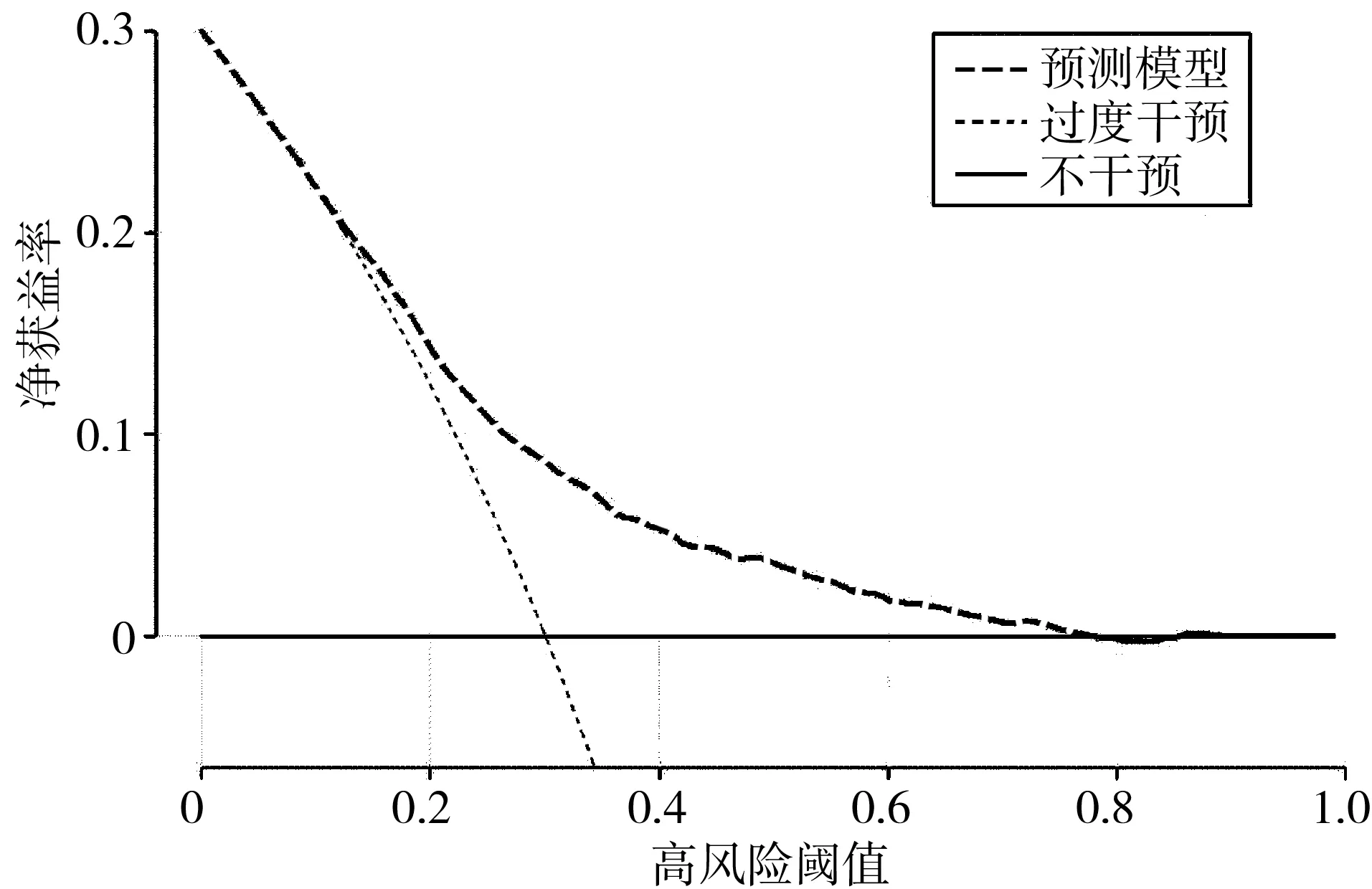
图3 SIC患者预测列线图的决策曲线
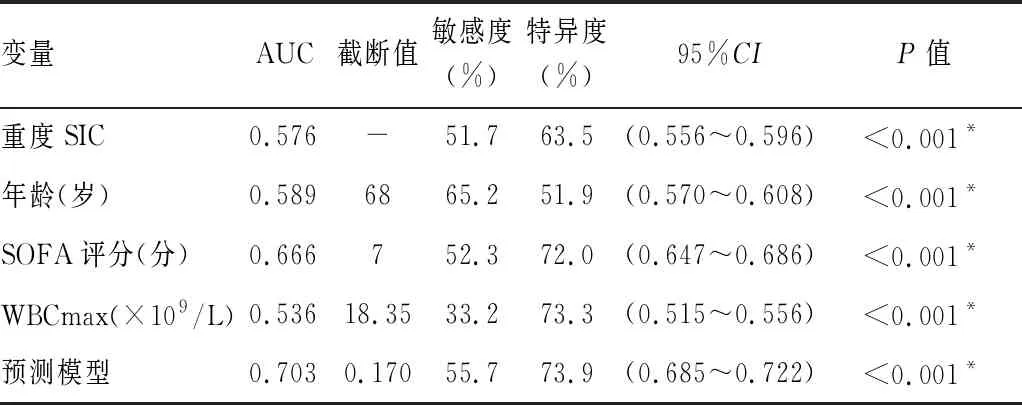
表3 危险因素和预测模型预测SIC患者28 d死亡的比较
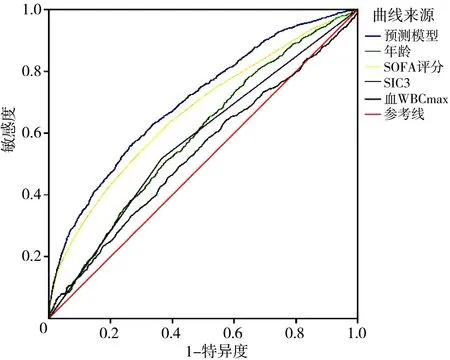
注:SIC3为重度脓毒症性凝血病;SOFA为序贯器官衰竭评分;WBCmax为白细胞计数最大值
3 讨论
SIC涉及凝血、炎症、宿主免疫及内皮细胞等多个生理过程的功能障碍[1,5]。SIC的提出有助于对急危重患者DIC的早期诊断和潜在危险的快速干预。SIC患者的病理生理复杂性和疾病发展过程的异质性,导致临床结局在入院时有些难以预测,极大增加脓毒症患者的死亡风险[8]。本研究在校正了患者住院变量和SIC严重程度后,发现重度SIC与患者28 d病死率独立相关。基于MIMIC-Ⅲ数据库建立SIC患者预后预测模型,该模型发现,重度SIC、年龄越大、SOFA评分越高和血WBCmax越高,患者死亡风险越高,模型预测效果优于单个指标预测。
脓毒症的发病率和病死率随着年龄的增长而急剧增加[9]。老年人存在临床合并症发生率高、营养不良、适应性免疫缺陷等因素,一旦发展成脓毒症[10],容易合并器官功能障碍,住院死亡的风险也更大。此外,老年脓毒症患者往往临床症状不典型,这使病情进一步复杂化并可能延误诊断[11]。本研究结果表明,年龄是SIC患者28 d死亡的危险因素。
SOFA评分连续评估在预测危重患者预后方面有重要的意义。Iba 等[12]回顾性分析323例经抗凝血酶补充治疗的脓毒症合并凝血障碍患者SOFA评分、日本急诊医学学会 (Japanese association of acute medicine, JAAM)DIC评分的变化与28 d病死率的关系,与SOFA评分没有改善的病例相比,SOFA评分改善的病例病死率显著降低。SOFA评分与脓毒症DIC患者28 d病死率的相关性最强。本研究结果也同样证实,SIC死亡组患者的SOFA评分高于存活组,SOFA 评分是SIC患者28 d死亡的危险因素。
本研究在临床合并症方面发现,SIC死亡组合并高血压病和糖尿病比例低于存活组,多因素分析发现,高血压病和糖尿病是死亡组的保护因素,几项临床研究[7,13]也有这个趋势。本研究推测,高血压病患者使用β-受体阻滞剂可减弱早期脓毒症的肾上腺素能反应。使用β-受体阻滞剂可能影响脓毒症心脏功能、代谢、免疫学和凝血紊乱的调节[14],与患者病死率降低有关。在最近的一项荟萃分析中,脓毒症发病前β-受体阻滞剂暴露降低了脓毒性休克患者的病死率[15]。胰岛素减轻组织再灌注损伤,保护血管内皮细胞,强化胰岛素控制血糖可改善脓毒症患者预后[16]。但高血压和糖尿病为保护因素的具体原因仍需进一步探究。很少有文献说明凝血功能障碍与充血性心力衰竭之间的关系。本研究结果显示,死亡组合并充血性心力衰竭比例高于存活组,其中机制可能是充血性心力衰竭的神经内分泌系统激活与凝血途径激活、内皮功能障碍和促炎细胞因子水平升高有关[17]。有研究[18]也观察到,充血性心力衰竭过程中的组织缺血和血流停滞可能导致DIC发生。尽管药物治疗取得了进步,充血性心力衰竭仍然是导致发病和死亡的主要原因。后期针对合并充血性心力衰竭的SIC患者,实施适当的抗凝治疗能否获得更好的临床结果,有待进一步的临床研究。
脓毒症凝血功能障碍的机制是炎症因子激活凝血和纤维蛋白的形成,从而导致微血管血栓形成,组织灌注不足,甚至器官功能障碍[19-22]。凝血功能障碍可能是由活化的嗜中性粒细胞和内皮组织因子之间的相互作用所致。Morikawa等[23]通过研究脓毒症DIC患者的多形核白细胞变形能力的变化,评估DIC患者严重程度与多形核白细胞变形能力之间的关系。结果发现,多形核白细胞变形与脓毒症DIC患者的严重程度和治疗反应有关。在凝血治疗方面的研究[24-25]提示,活化蛋白C(activated protein C,APC)还能抑制白细胞和中性粒细胞的炎症反应,抑制白细胞趋化,维持内皮细胞的完整性,防止毛细血管渗漏引起低血压。这说明血白细胞计数等促炎细胞过度表达似乎对内皮功能障碍和器官损伤有重要的贡献。本研究结果表明,SIC死亡组WBCmax高于存活组,是SIC患者28 d死亡的独立危险因素。因此,缓解炎症和凝血激活的医疗干预方式已被视为一个重要问题。
本研究也存在一定的局限性。首选,本研究SIC诊断标准是在Sepsis-3诊断标准基础上提出,筛选的队列相比其他诊断标准更小;其次,存在部分数据缺失(PLT或INR),导致排除而无法纳入分析;最后,动态指标对患者预后有直接影响,本文仅研究入院24 h内指标对SIC患者预后影响。
本研究通过 MIMIC-Ⅲ数据库大样本资料进行分析,建立SIC患者预后预测模型,结果显示,重度SIC、年龄、SOFA评分、血WBCmax是影响SIC患者预后的独立危险因素,预测模型有较好的校准能力,预测模型相对单个指标有更好的预测价值。在救治疾病过程中,早期进行预后预测评估,及时做出相应的临床决策,防止病情恶化,具有重要的临床意义。

