大鼠高位脊髓损伤早期心肌组织PI3K/AKT/GLUT4信号通路的变化
郑如洁, 李佳琦, 廖 烨, 魏丽钦, 黄钦凤, 陈 辉
高位脊髓损伤(spinal cord injury, SCI)在创伤早期常常出现多系统多器官的并发症,且多以心血管功能异常为死亡的首要原因,显著增加了这类患者手术及麻醉的风险,继发心血管功能异常,增加其致死率[1-2]。多项研究[3-4]证实,高位SCI早期存在心肌损伤。前期研究[5]已发现,高位SCI大鼠早期心肌存在葡萄糖代谢异常,表现为葡萄糖转运蛋白4(glucose transporter 4, GLUT4)膜转位减少。磷脂酰肌醇3-激酶/蛋白激酶B/葡萄糖转运蛋白4(phosphatidylinositol 3-kinase/protein kinase B/glucose transporter 4, PI3K/AKT/GLUT4)信号通路作为胰岛素主要的下游分子通路,是调控细胞能量代谢的重要途径。在心肌葡萄糖代谢过程中,胰岛素是主要调控激素,其通过与细胞膜表面的胰岛素受体结合,激活下游PI3K/AKT通路,促进GLUT4转位至细胞膜,增加葡萄糖摄取,发挥调节糖代谢的作用[6]。高位SCI早期GLUT4减少是否是PI3K/AKT/GLUT4通路上游表达受损导致,目前未知,正是本研究所要探讨的问题。
1 材料与方法
1.1实验动物 健康雄性 SD 大鼠30只,8~10周龄,体质量 250~300 g,购于福建医科大学动物实验中心,许可证号:SCXK(闽)2016-0002。所有动物均在实验室适应性喂养1周。本实验经学校伦理委员会批准(批准号:IACUC FJMU 2022-0487)。
1.2动物分组及处理 采用随机数字法分为五组(每组n=6):假手术组(Sham组)、高位SCI后4 h组(SCI 1组)、高位SCI后12 h组(SCI 2组)、高位SCI后24 h组(SCI 3组)和高位SCI后48 h组(SCI 4组)。建模前为大鼠提供正常舒适饲养条件,并记录大鼠饮食及排泄情况。术前大鼠禁食 8 h,禁饮1 h,称质量。麻醉采用戊巴比妥钠(50 mg/kg)腹腔注射[7],起效后,大鼠俯卧位固定于鼠台上,稍垫高颈背部,备皮,以C7棘突(棘突最高处)为中心做正中切口,做标记,10%活力碘消毒3遍。纵行切开皮肤及皮下组织,暴露 C6~T1棘突及椎板。用持针器咬除C7棘突及全椎板,显露其下方白色硬脊膜和脊髓。打击脊髓采用改良的Allens打击法,10 g砝码从5 cm高的中空玻璃管内垂直下落撞击脊髓1次。Sham组只显露 C7硬脊膜和脊髓,不打击。实时造模成功的标志:打击后大鼠的双下肢回缩性扑动,尾巴可呈痉挛性摆动,撞击处脊髓由白色变灰暗。致伤后用明胶海绵彻底止血,逐层缝合肌肉和皮肤。建模前后的大鼠均需进行Basso-Beattie-Bresnahan(BBB)评分量表评估,建模前各组大鼠评分<21分及苏醒后评分>1分的大鼠排除使用。术后观察记录苏醒时间,给予液体治疗(腹腔注射生理盐水40 mL/kg),抗感染治疗(肌注青霉素20万U,2次/d),截瘫护理(人工排尿排便3次/d,膀胱按摩),记录排尿排便情况。建模成功大鼠分别于脊髓打击后4、12、24和48 h进行BBB评分并取材。
1.3透射电镜 切取1 mm×1 mm×1 mm心肌组织,用pH为7.2的3%戊二醛-1.5%多聚甲醛-0.1 mmol/L PBS固定,漂洗,用1%锇酸-1.5%亚铁氰化钾再固定,再漂洗、脱水、浸透包埋后切片染色,Philips EM 208型透射电镜观察并摄片。
1.4Western blot法 组织块剪成小块,制成匀浆,12 000 r/min离心10 min后收集上清,即为总蛋白溶液,膜蛋白用膜蛋白提取试剂盒提取。BCA法测定蛋白浓度。取10 μL样本经SDS-PAGE电泳后转膜,将 PVDF 膜用5%脱脂牛奶封闭液室温封闭2 h,分别加入兔抗PI3K p85和兔抗P-AKT(稀释度为1∶1000,Abcam,英国),温育1.5 h。用TBST洗3次。加入山羊抗兔IgG(稀释度为1∶1000,Sigma,美国),温育1.5 h。经化学发光法显影曝光后,以GAPDH做内参,采用Image J软件测定目标带灰度值。
2 结果
2.1术后表现及BBB评分结果 Sham 组大鼠术后四肢灵活,活动和进食等行为均与术前基本一致,BBB评分为标准值21分。SCI 各组大鼠术后双下肢呈弛缓性瘫痪,活动和进食均较术前明显减少,无自主排尿排便, 各组BBB评分均降低,在伤后12 h内评分均为0分,伤后24 h和48 h可见评分稍有升高。SCI各组BBB评分与Sham组比较,差异均有统计学意义(P<0.01)。见表1。

表1 各组大鼠BBB评分比较[M(P25,P75),n=6]
2.2透射电子显微镜观察心肌细胞改变 Sham组心肌细胞结构完整;SCI各组心肌细胞存在不同程度的肌丝溶解、肌浆网扩张、细胞间隙增宽、溶酶体增多和线粒体结构破坏等变化。见图1。
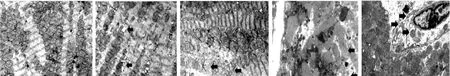
Sham组 SCI 1组 SCI 2组 SCI 3组 SCI 4组 注:Sham组为假手术组;SCI 1组为高位SCI后4 h组;SCI 2组为高位SCI后12 h组;SCI 3组为高位SCI后24 h组;SCI 4组为高位SCI后48 h组;Sham组心肌细胞结构大致正常;SCI 1组大多数细胞未见异常改变,仅少量心肌细胞出现结构变化,偶见肌浆网扩张;SCI 2组线粒体肿胀,嵴稀疏化,肌丝溶解;SCI 3组线粒体肿胀破坏,呈空泡样改变,肌丝溶解;SCI 4组细胞肿胀,部分坏死脱落,线粒体漏出,肌丝广泛性溶解
2.3蛋白质免疫印迹法检测PI3K、p-AKT和GLUT-4 与Sham组比较,SCI 1组、SCI 2组和SCI 3组心肌组织PI3K和p-AKT含量降低(P<0.05),其中SCI 1组和SCI 2组含量显著下降(P<0.01),于伤后48 h基本恢复正常。与Sham组比较,SCI 1组、SCI 2组和SCI 3组心肌细胞膜 GLUT-4 含量降低(P<0.05),其中SCI 3组降至最低(P<0.01),而SCI 4组差异无统计学意义。见图2、表2。
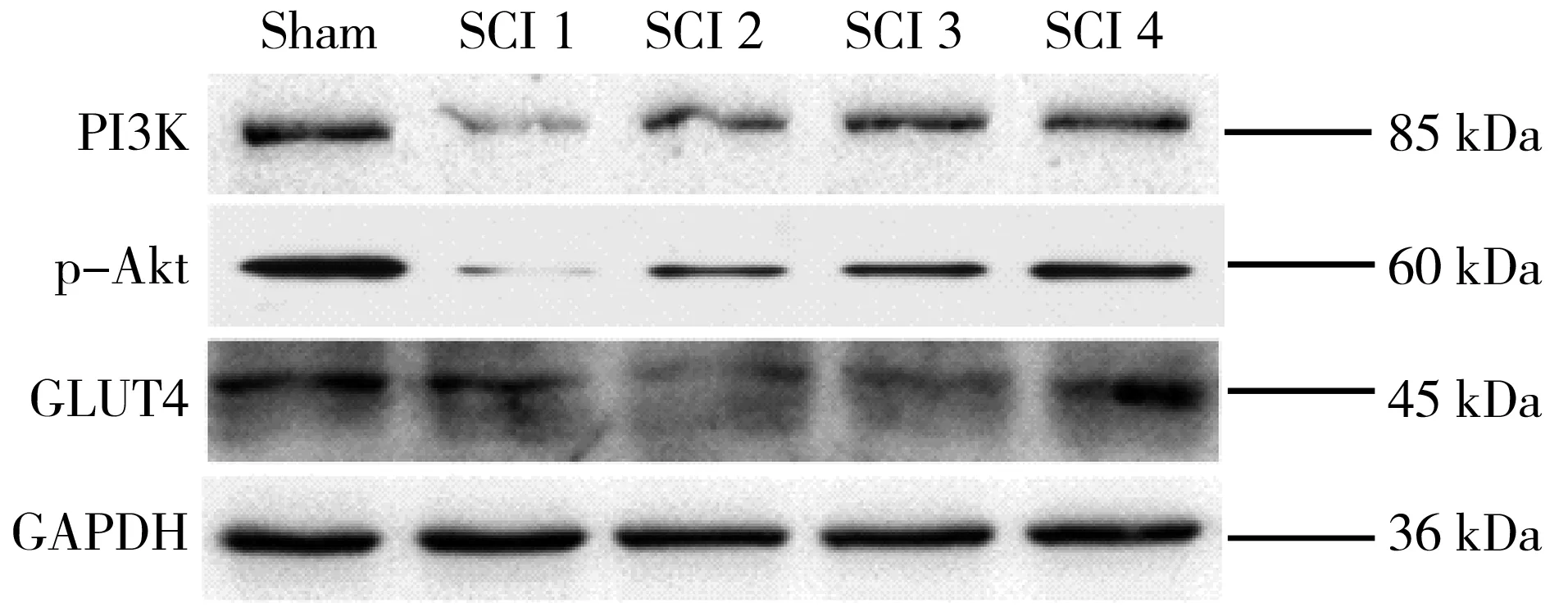
注:PI3K为磷脂酰肌醇3-激酶;p-AKT为磷酸化蛋白激酶B;GLUT4为葡萄糖转运蛋白4
表2 各组大鼠心肌组织PI3K、p-AKT和心肌细胞膜GLUT4含量
3 讨论
本实验采用改良的Allens打击法建立高位SCI模型。术后大鼠双下肢呈弛缓性瘫痪,BBB评分趋近于0分,表明高位SCI大鼠下肢运动功能严重受损,建模成功。电镜下可观察到心肌细胞出现超微结构破坏,表现为肌丝溶解、闰盘连接分离、肌浆网扩张、细胞膜部分破裂溶解、线粒体肿胀嵴稀疏等,证明高位SCI早期存在心肌细胞损伤,与文献报道一致[4]。本研究发现,大鼠高位SCI早期心肌PI3K和p-AKT表达降低,心肌细胞膜GLUT4含量减少,说明PI3K/AKT/GLUT4信号通路存在异常。
磷脂酰肌醇3-激酶家族(PI3Ks)通过磷酸化磷脂酰肌醇和磷酸肌醇的3′-羟基参与调控细胞代谢、生存和囊泡运输等多种生理过程。根据作用底物和序列同源性的不同,PI3Ks可分为Ⅰ型PI3Ks、Ⅱ型PI3Ks和Ⅲ型PI3Ks[8]。Ⅰ型PI3Ks又分为ⅠA和ⅠB两种亚型,其中ⅠA亚型是由一个p85调节亚基和一个p110催化亚基组成的异质二聚体;调节亚基p85可以直接与细胞膜上的酪氨酸受体,如胰岛素受体底物1结合后,激活催化亚基p110,实现信号向下游通路的传递[9]。Luo等[10]通过构建PI3K p85亚基敲除大鼠模型,发现PI3K信号分子受损会引起骨骼肌胰岛素抵抗和全身葡萄糖耐受不良,表明PI3K p85亚基是调节能量代谢的重要分子。AKT是位于PI3K信号通路下游的丝氨酸/苏氨酸蛋白激酶,磷酸化后作用于AKT的底物160 kDa,驱动GLUT4转位,促进葡萄糖摄取。研究证实敲除AKT可以抑制胰岛素介导的葡萄糖摄取,而AKT过表达则会增加葡萄糖摄取,表明AKT是葡萄糖摄取的重要分子[11]。本实验结果显示,在高位SCI 后24 h内,p-AKT均呈低表达,与上游PI3K蛋白低表达存在一致性,证实是上游PI3K表达下调引起信号传导受损,致AKT磷酸化水平降低。
前期研究已证实,高位SCI后大鼠心肌存在能量代谢障碍,表现为GLUT4转位减少,本实验结果与此一致。GLUT4是心肌中主要的葡萄糖转运体,参与跨膜转运葡萄糖[12]。细胞膜GLUT4含量减少,即GLUT4转位减少。有研究[13]显示,PI3K及AKT抑制剂分别抑制PI3K和AKT表达后,心肌细胞GLUT4的转位显著下降,葡萄糖摄取显著减少,表明PI3K和AKT是GLUT4转位的重要调控分子。本实验发现,PI3K和AKT蛋白在高位SCI 后表达下调,这与GLUT4转位降低基本一致,证明PI3K/AKT/GLUT4通路存在异常,上游PI3K和AKT表达下调可能是GLUT4转位减少的机制之一。PI3K、p-AKT和心肌细胞膜GLUT4含量在伤后24 h内降低,但后者与前两者降低趋势不完全一致,考虑可能与腺苷酸-活化蛋白激酶(AMPK)的激活有关。AMPK是心肌重要的能量感受器和代谢调节中心。当心肌能量需求增加时,AMP与ATP比值增加激活AMPK,后者激活AKT的底物160 kDa和TBC1D1,促进GLUT4囊泡向细胞膜的转运,诱导GLUT4转位增加;另一方面,AMPK也能抑制细胞膜上GLUT4的内吞循环,进一步增加具有活性的GLUT4含量[14-15]。目前研究认为,AMPK通路是心肌应激性适应的保护机制,在心肌缺血等病理情况下被激活。Russell等[16]发现,缺血心肌氧化代谢受损,AMPK活性增强,诱导GLUT4转位,通过不依赖PI3K的途径促进葡萄糖代谢,表明AMPK是受损心肌的重要保护机制。故本实验猜测高位SCI大鼠心肌也存在同样的代偿机制,从而出现伤后24 h内 PI3K、p-AKT与下游GLUT4降低趋势不完全一致的现象。需后续实验进一步验证。
PI3K和AKT在葡萄糖摄取和GLUT4转位中起着至关重要的作用。在早期研究中,PI3K抑制剂如渥曼青霉素可以完全阻断胰岛素对葡萄糖摄取的刺激[17];同时,另一研究[14]也证实渥曼青霉素显著降低了葡萄糖摄取和GLUT4转位,均表明PI3K是胰岛素刺激的葡萄糖转运所必需的。AKT作为PI3K的直接下游靶点,通过构建和使用AKT的抑制剂,几乎完全抑制了胰岛素刺激的GLUT4转位[19];而无活性AKT突变体的过表达,同样显著降低了胰岛素介导的GLUT4转位[20]。以上均证实PI3K和AKT与GLUT4转位关系密切。故在本研究中未使用PI3K和AKT抑制剂再次验证其关系。
Duckworth 等[21]发现,高位SCI 患者血浆胰岛素水平升高,出现胰岛素抵抗和糖耐量异常,但胰岛素与受体结合量无明显差异,说明该类患者胰岛素抵抗为胰岛素与受体结合后的信息传导异常。本研究结果与此一致,说明PI3K/AKT/GLUT4通路相关蛋白表达下调,与心肌胰岛素抵抗有关。在葡萄糖代谢的分子机制中,PI3K/AKT/GLUT4通路作为其关键途径,该通路上任一分子受损均可引起胰岛素级联反应减弱或中断,进而产生胰岛素抵抗。心肌出现胰岛素抵抗时,葡萄糖摄取量显著减少,使以葡萄糖为能量底物的一系列氧化分解速率显著降低,心脏功能受损[22]。另有研究证实,心肌AKT表达下调会减少葡萄糖的摄取和ATP的产生,出现胰岛素抵抗,证明AKT通路与心肌胰岛素抵抗关系密切;研究同时发现心肌收缩和舒张功能均有一定程度受损,而上调AKT的表达可以改善葡萄糖摄取和能量供用,有利于心肌功能的恢复[23]。以上均证实,PI3K/AKT/GLUT4通路的异常与心肌损伤密切相关。如何上调高位SCI早期PI3K/AKT/GLUT4通路,进而改善胰岛素抵抗达到心肌保护的作用,也将是我们未来研究的方向。
本实验的不足之处在于未能检测大鼠血中血糖水平及心肌细胞内葡萄糖摄取率,以进一步佐证GLUT4转位减少所致的糖代谢异常。
综上所述,大鼠高位SCI早期心肌细胞GLUT4减少可能与PI3K/AKT/GLUT4信号通路上游表达异常有关,其具体机制有待进一步探究。

