D-GalN/LPS诱导大鼠急性肝衰竭中髓过氧化物酶和 Nrf2/HO-1信号通路的变化
王柯尹, 魏大海, 邹卓林, 孙丹凤, 徐艳丽
急性肝衰竭(acute liver failure, ALF)是由病毒、药物、饮酒等诱发的肝细胞大量变性、坏死,临床以极度乏力、黄疸、凝血异常、肝性脑病等为主要表现的疾病,具有起病急、病情重和病死率高等特征,尚无特效治疗药物和方法[1]。因此,深入研究ALF的发病机制及寻找有效的治疗方法显得尤为重要。目前,免疫介导炎性细胞因子的大量释放是ALF发病的中心环节。另有研究[2-3]表明,氧化应激能激活相关信号通路,调控细胞因子、趋化因子等水平,在炎症、慢性肝病、肿瘤等疾病的发生发展中扮演重要角色。核因子E2相关因子2(NF-E2-related factor 2, Nrf2)是抗氧化应激中参与多种蛋白表达的一个重要转录激活因子,可与血红素氧合酶-1(heme oxygenase 1, HO-1)等抗氧化酶组成Nrf2/HO-1信号通路,在维持细胞氧化还原及内稳态中发挥重要作用[4]。髓过氧化物酶(myeloperoxidase, MPO)又称过氧化物酶,属于血红素过氧化物酶,可催化产生各种有氧化作用的自由基,在调节炎症、氧化应激和血管内皮损伤中起着重要作用[5]。MPO和 Nrf2/HO-1信号通路都与组织损伤过程中的氧化应激反应相关,但是其在ALF中的具体分子机制目前尚不明确。本研究旨在探讨 MPO 和 Nrf2/HO-1 信号通路协同在ALF大鼠氧化应激和炎症反应中发挥的作用,为ALF临床预防和治疗提供新思路。
1 材料与方法
1.1实验动物和试剂 选取SPF级SD雄性大鼠48只(体质量 200~220 g),由浙江维通利华实验动物技术有限公司提供[许可证号:SCXK(浙)2019-0001],操作符合中华人民共和国实验动物管理条例规定。本研究通过医院伦理委员会审核(伦理审批件文号:LS2019-047)。D-GalN和LPS购自上海阿拉丁生物制品有限公司(货号: G115553、L118716);MPO试剂盒购自南京建成生物医学工程研究所(货号:A044-1-1);ELISA试剂盒购自杭州联科生物技术股份有限公司;MPO、Nrf2和HO-1抗体购自Affinity生物科学公司(货号:22225-1-AP、AF0639、AF5393);β-actin抗体、二抗购自上海威奥生物科技公司(货号:WB0196、WB0176)。
1.2实验方法 SD大鼠12 h昼夜交替饲养,实验前 1 d 下午禁食,饮水不限,据随机数字表法分组:对照组(n=12),腹腔注射与ALF组等量的生理盐水;ALF组(n=36):D-GalN 加入生理盐水稀释到10%浓度,NaOH调节 pH 至7.0,腹腔注射 D-GalN 800 mg/kg和LPS 8 μg/只。注射后 6、12、24 h给予10%水合氯醛麻醉,采门静脉血3~5 mL,3000 r/min离心10 min,上清液备用,取肝脏标本。
1.3病理检查和相关检测
1.3.1 病理检查 肝脏标本经甲醛固定,脱水,石蜡包埋,HE染色后在显微镜下观察。全自动生化分析仪检测生化指标。ELISA法检测血清 MPO、肿瘤坏死因子-α(TNF-α)和 白细胞介素-6(IL-6)水平,参照试剂盒说明书进行。
1.3.2 mRNA检测 Trizol法提取肝组织RNA,用逆转录试剂盒(Promega)逆转录成cDNA。Nrf2正反向引物序列为CTGGCTGATACTACCGCTGTT和GTGGAGAGGATGCTGCTGAA;HO-1正反向引物序列为TTTCACCTTCCCGAGCATC和TTAGCCTCTT CTGTCACCCTGT;β-actin正反向引物序列为ATAGCACAGCCTGGATAGCAACGTAC和CACCTTC TACAATGAGCTGCGTGTG,以β-actin为内参,检测 Nrf2 和 HO-1在肝组织中的相对转录水平。
1.3.3 Western blot 法检测蛋白 取肝组织 100 mg 提取蛋白,按照试剂盒说明操作,煮沸上样液使蛋白变性后进行凝胶电泳,转膜后将PVDF膜放入 5%脱脂奶粉封闭 2 h,洗膜后加入MPO、Nrf2、HO-1和β-actin 抗体,于 4 ℃孵育过夜,TBST洗膜 5 min×3次,二抗(1∶2000)室温孵育 1 h,洗膜后化学发光显色。
1.3.4 MPO测定 取肝组织用冷生理盐水漂洗,干燥,组织匀浆,离心取上清液,采用比色法测定,按照试剂盒说明书操作。

2 结果
2.1肝组织病理 对照组肝小叶规则,肝索排列有序,未见肝细胞变性、坏死。ALF 组 6 h 时开始出现肝窦淤血改变,少量肝细胞轻度肿胀、坏死。可见少许炎细胞;12 h 时大鼠肝脏结构破坏明显,空泡化,细胞核碎裂,大片细胞坏死,几乎见不到正常肝细胞,肝小叶形态紊乱,肝索断裂,炎症程度严重;24 h时肝细胞严重水泡变性,肝小叶明显破坏,肝窦见大片充血,但相对于12 h有所缓解。见图1。
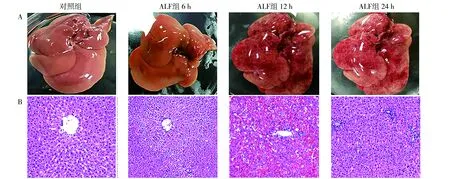
注:A为肝组织形态;B为肝组织HE染色(×100);ALF为急性肝衰竭
2.2血清肝功能 ALF组6、12 h血清总胆红素(TBiL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)水平显著升高,且12 h 达到峰值,24 h 有所下降,与对照组比较差异均有统计学意义 (P<0.05)。见表1。

表1 各组大鼠血清TBiL、ALT及AST水平比较
2.3血清MPO和相关炎症因子 与对照组比较,ALF组血清MPO表达于造模后12 h为最高(65.75±7.02),24 h后相对下降(53.92±5.63);ALF组血清TNF-α于造模后6 h达高峰(102.17±14.80),12 h开始下降(83.33±11.22),24 h继续下降(64.25±9.29),高于对照组(11.30±3.26);IL-6于造模后6 h升高最明显(89.25±10.86),12 h后逐渐下降(77.33±8.02),24 h为(65.58±7.31),但高于对照组(10.83±2.92),与对照组比较差异有统计学意义(P<0.01)。见图2。

注:ALF为急性肝衰竭;MPO为髓过氧化物酶;TNF-α为肿瘤坏死因子-α;IL-6为白细胞介素-6;与对照组比较,**P<0.01
2.4肝组织MPO活性 ALF组肝组织MPO活性明显高于对照组,其活性程度受 D-GalN/LPS 诱导后的时间变量影响,且呈逐渐增高趋势。ALF组诱导后12 h 达最高值,为(28.08±4.65) U/g,与对照组(12.17±1.26)U/g比较差异有统计学意义(P<0.01)。见图3。
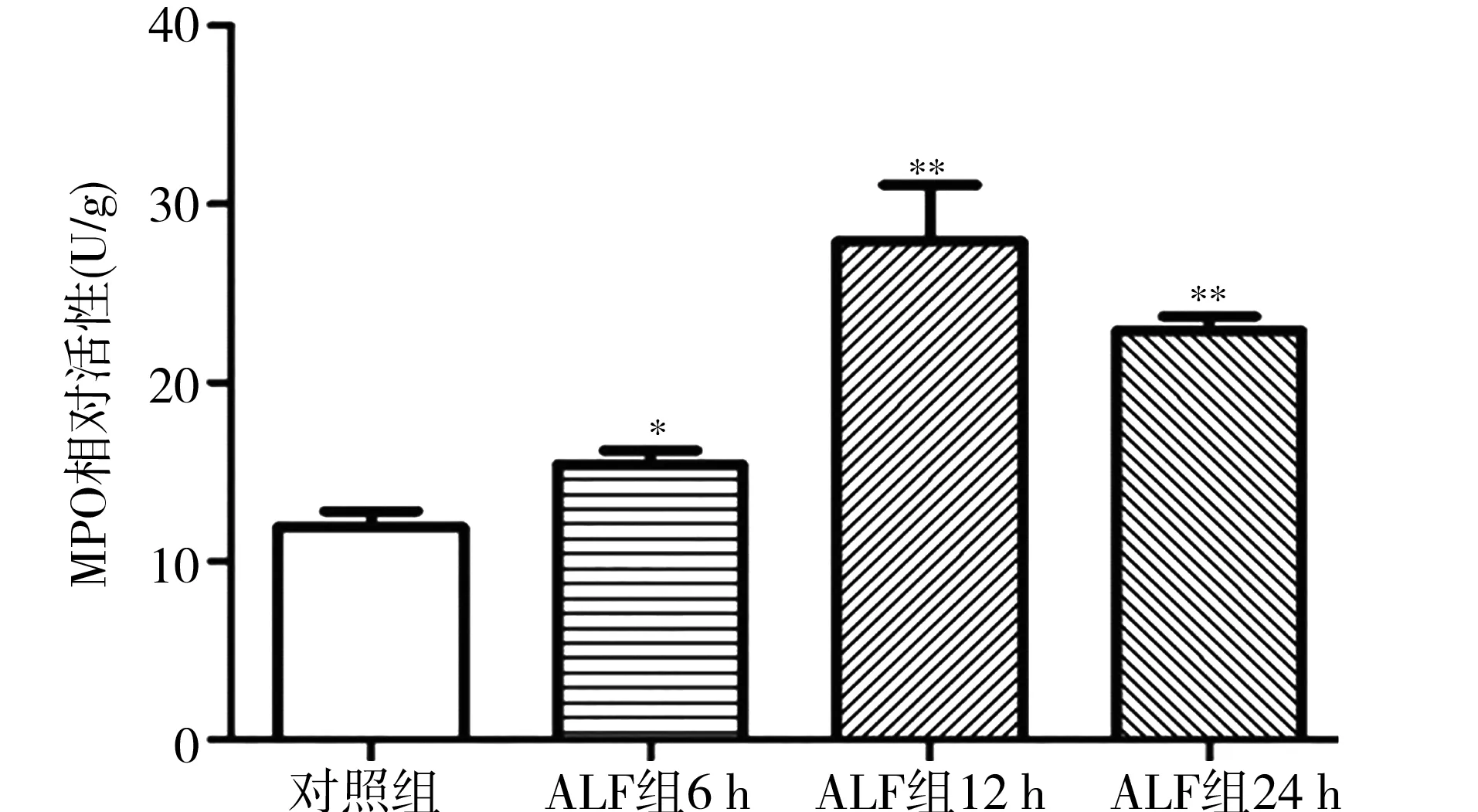
注:ALF为急性肝衰竭;MPO为髓过氧化物酶;与对照组比较,**P<0.01
2.5肝组织Nrf2和HO-1 mRNA水平 与对照组比较,ALF组肝组织Nrf2和HO-1 mRNA水平明显增加,其中12 h为最高,差异均有统计学意义(P<0.01)。见图4。
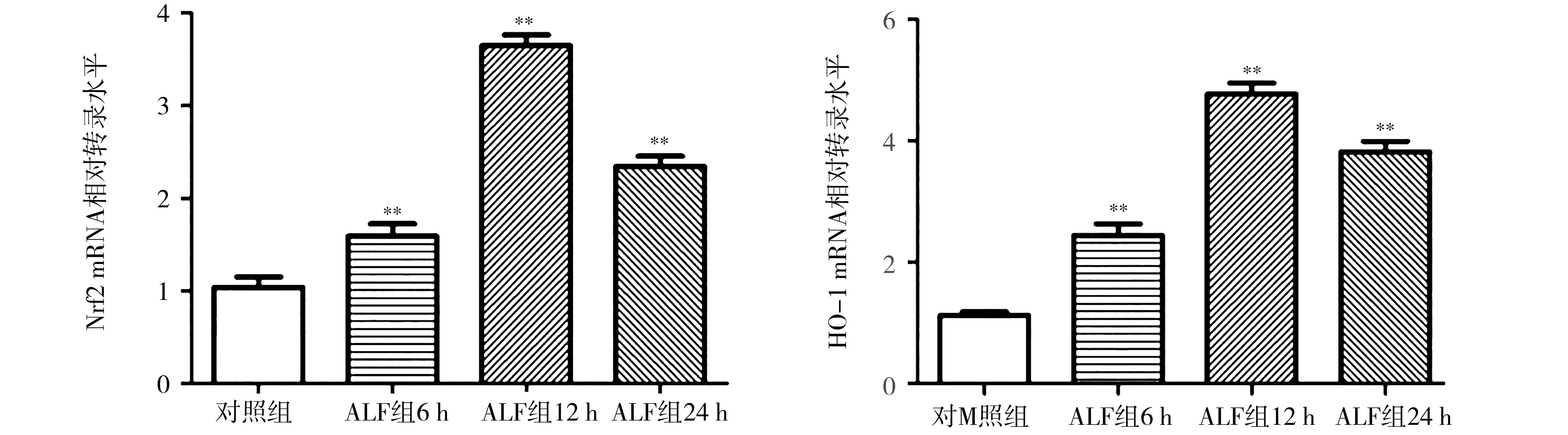
注:ALF为急性肝衰竭;Nrf2为核因子E2相关因子2;HO-1为血红素氧合酶-1;与对照组比较,**P<0.01
2.6肝组织MPO、Nrf2和HO-1蛋白表达 对照组肝组织有少量 MPO、Nrf2 和 HO-1表达,ALF组 MPO、Nrf2 和 HO-1蛋白表达量在造模后 6 h 逐渐增加,于12 h达高峰,24 h开始下降,差异有统计学意义(P<0.01)。见图5。
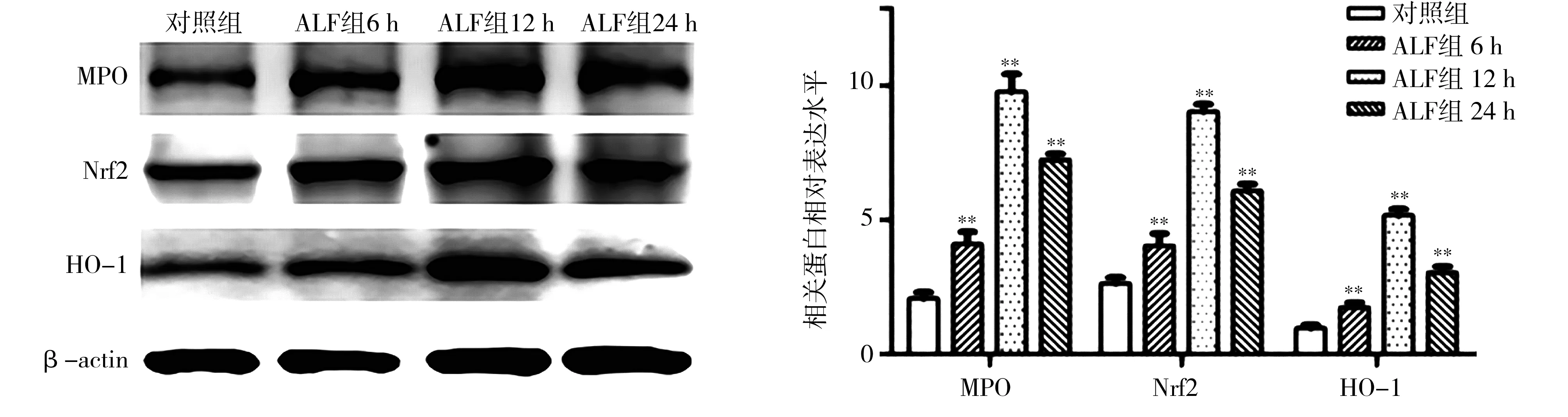
注:ALF为急性肝衰竭;MPO为髓过氧化物酶;Nrf2为核因子E2相关因子2;HO-1为血红素氧合酶-1;与对照组比较,**P<0.01
3 讨论
ALF发病机制十分复杂,炎症刺激、内毒素血症和肝细胞能量代谢障碍均起重要作用[6]。近年来氧化应激在肝脏疾病中的作用越来越受到重视。氧化应激能够激活一系列信号通路,引起相关连锁反应,诱导细胞凋亡蛋白酶,使肝细胞大量凋亡[7]。研究氧化应激通路及其影响因素可能对ALF的发生机制和防治具有重要意义。
MPO是介导氧化应激反应的重要蛋白酶,主要存在于中性粒细胞、单核细胞和肝Kupffer细胞等,参与如败血症、脂肪肝、冠心病等多种疾病的发生、发展[8-10]。正常生理状态下,MPO具有强效杀灭病原微生物作用,可通过产生次氯酸盐破坏病原体,保护组织器官免受侵袭。但当机体处于炎症反应状态时,中性粒细胞便会受刺激产生大量 MPO,诱发释放过量活性氧(ROS),机体氧化和抗氧化作用失去平衡,引起细胞功能和稳态受损,ROS还可被 Toll 样受体识别,激活相关信号通路,促进IL-6、TNF-α等释放,干扰细胞正常生理功能[11]。Kremserova 等[12]在 LPS 诱导肺损伤的模型中,发现敲除 MPO 后 IL-6、干扰素-γ等水平明显下降,炎症反应减轻。本研究显示,ALF组 MPO、TNF-α、IL-6水平均高于对照组(P<0.01),且ALF组大鼠肝组织MPO活性明显高于对照组,至诱导后12 h 达最高值,提示D-GalN/LPS损伤肝细胞后代谢物激活单核巨噬细胞释放多种补体、细胞因子,在炎症介质作用下,MPO含量及活性增加,再参与炎症,形成氧化应激、炎症反应、组织细胞损伤的恶性循环,加重肝损伤。
Nrf2 是在抗氧化应激反应中调控多种蛋白表达的重要转录激活因子,在减轻氧化应激及炎症引发的机体损伤中发挥重要作用[13]。研究[14]表明,Nrf2在HSCs和Kupffer细胞及实质肝细胞中均可被激活,在肝脏炎症、肝细胞凋亡和再生中发挥着复杂的作用。Lamle等[14]给Nrf2基因敲除小鼠酒精饮食后,发现小鼠死亡率上升,肝细胞脂肪变性加重,毒性产物增多,提示 Nrf2 在酒精性肝病中对肝细胞起保护作用。HO-1是一种在应激状态下可迅速激活细胞发挥抗炎、抗氧化、抑制细胞凋亡等作用的重要因子[15]。Nrf2/HO-1 信号通路的激活可调控炎症细胞的募集,在抗氧化和抗炎反应之间提供平衡点,维持机体内稳态[16]。目前,MPO是否可通过氧化应激及炎症介质调节 Nrf2/HO-1 信号通路影响ALF的发生尚不明确。
Nrf2/HO-1作为新近发现的抗氧化应激和抵抗炎症刺激的防御性信号通路,在肝细胞损伤中发挥保护作用。MPO是参与氧化应激反应的关键酶,可通过多种机制调节体内氧化应激信号通路。研究[17]显示,MPO与中性粒细胞膜上相关物质结合,可能导致 p38 促分裂原活化蛋白激酶(MAKP)、细胞外调节蛋白激酶(ERK)和磷酸酰肌醇-3-激酶(PI3K)磷酸化,细胞脱颗粒增加,促使ROS产生。而最近的研究[18]认为,MAKP、ERK和 PI3K/AKT 等上游激酶均可促进 Nrf2与Keap蛋白解离,诱导下游HO-1等多种抗氧化保护性基因,启动抗氧化连级反应。Jiang等[19]的研究也发现,Nrf2受 PI3K/AKT信号通路的调控发挥一系列正常的生理学作用。本研究结果显示,ALF组血清IFN-α、IL-6水平于6 h达到峰值,MPO、Nrf2和HO-1蛋白表达均于造模 6 h 升高,12 h 最明显,后逐渐下降,与对照组比较差异有统计学意义(P<0.01)。TNF-α和 IL-6 水平变化趋势与肝脏 MPO、Nrf2和HO-1蛋白表达一致,但时间略早,考虑为机体发生肝衰竭时TNF-α、IL-6等多种炎性介质浸润,促进MPO等氧化因子释放,相关蛋白激酶被激活,诱导ROS等的产生,刺激 Nrf2/HO-1通路,从而通过抗氧化应激对ALF中炎症反应和组织损伤发挥保护作用,提示 MPO与Nrf2/HO-1信号通路在整个ALF过程中形成了多个相互影响的复杂关系,但其具体作用机制仍有待进一步研究。
总之,本研究建立D-GalN/LPS诱导大鼠ALF模型,进一步检测与炎症因子密切相关的MPO、Nrf2 和 HO-1的表达,发现MPO 蛋白表达和 Nrf2/HO-1信号通路激活程度可以判断 D-GalN/LPS诱导ALF大鼠的肝损伤严重程度。本研究结果不仅对氧化应激及炎症在ALF进展过程中扮演的角色进行多系统的研究,而且还有助于加深对ALF发病分子机制的理解,为评估ALF肝脏损伤程度及临床治疗奠定了基础。

