脑脊液炎症因子对颅脑损伤术后继发颅内感染的诊断价值
刘 盼, 孙家安, 王金柱, 王德震, 刘寒松, 刘 畅
近年来颅脑损伤的发病率越来越高,这类患者大多需要接受急诊手术清除颅内的积血或者留置脑室引流装置。诸多研究[1]表明,神经外科术后患者会出现各种各样的颅内感染(如硬膜下积脓、脑脓肿、脑室炎及脑膜炎等),有文献[2]报道术后感染率0.3%~8.9%,而我国的多中心研究[3]显示,神经外科开颅术后颅内感染率7.4%~8.6%。术后继发颅内感染不仅会加重患者病情,导致入住重症医学科(ICU)时间及机械通气时间延长,还会增加患者的致残率和病死率[4]。目前诊断颅内感染的金标准仍然是脑脊液(CSF)或脓液培养到病原微生物,实际上在临床上由于抗生素的及早使用,CSF培养阳性率不到20%。很多患者高度怀疑颅内感染但因为CSF培养阴性而延迟了抗生素的调整,导致患者病情进展甚至恶化。因此,寻找更加敏感而且特异性的指标来协助诊断颅内感染具有重要的临床意义。目前已有文献[5]报道检测CSF中的炎症因子水平来协助诊断术后颅内感染,但均缺乏大样本量的研究。本研究前瞻性分析了228例颅脑损伤术后患者CSF中炎症因子的变化特点,旨在探讨其对术后继发颅内感染的诊断价值,为临床上更好的治疗此类患者提供参考依据。
1 资料与方法
1.1研究对象 前瞻性选择郑州大学附属郑州中心医院ICU 2018年6月1日至2020年12月31日连续收治的228例接受颅脑手术并在术中放置脑室引流管的颅脑损伤患者为研究对象。纳入标准:①年龄18~75岁;②发病至入院时间在6 h以内;③有明确外伤史并经急诊头颅CT证实颅脑损伤;④有急诊手术指征且家属同意接受外科手术治疗,术中放置脑室引流管。排除标准:①术后3 d内死亡者;②既往有血液病、肿瘤性疾病及长期使用激素或免疫抑制剂患者;③既往因各种原因引起的意识障碍者;④既往有颅脑手术史者;⑤既往有严重的心肝肾疾病者。本研究所有检测指标和治疗均经患者授权人知情同意,获得郑州市中心医院伦理审批(202251)。
1.2研究方法 所有患者在入院后均详细记录一般临床资料,并给予重症监护,根据病情给予镇痛镇静、机械通气、控制血压等治疗,急诊行颅脑手术,术式包括脑室钻孔引流术、颅内血肿清除术+脑室引流术、去骨瓣减压术等,术中均留置脑室引流管。术后继续入住ICU并根据病情给予相应治疗,术后3 d连续监测CSF中白细胞介素(IL)-2、IL-4、IL-6、IL-10、肿瘤坏死因子-α(TNF-α)和γ-干扰素(γ-IFN)水平。每日10:00由床边护士自脑室引流装置留取CSF 10 mL,采用酶联免疫吸附法(ELISA)检测上述因子水平,试剂盒由上海研生生化试剂有限公司提供,整个过程中遵循无菌操作原则。所有患者根据术后是否继发颅内感染分为非感染组和感染组,其中颅内感染诊断标准参考《中国神经外科重症病人感染诊治专家共识(2017)》[6]中规定的金标准:CSF、脓液、分泌物或组织标本、分流导管细菌培养阳性。
1.3观察指标 ①一般临床资料:包括年龄、性别、发病至就诊时间、体重指数(BMI)、ABO血型、既往史、格拉斯哥昏迷评分(GCS)、急性生理和慢性健康状况评分Ⅱ(APACHEⅡ);②入院时生命体征:包括体温(T)、心率(HR)、呼吸频率(RR)、平均动脉压(MAP);③入院时实验室指标:包括血白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、C-反应蛋白(CRP)、降钙素原(PCT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、D-二聚体(DD)、心肌肌钙蛋白-I(cTnI)、B-型脑钠肽(BNP)、血尿素氮(BUN)、血肌酐(SCr)、血清白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST);④术后脑脊液炎症因子:术后连续监测3 d,包括IL-2、IL-4、IL-6、IL-10、TNF-α和γ-IFN;⑤其他指标:包括脑室引流管留置时间、诊断术后感染时间、CSF病原微生物培养结果、ICU停留时间、机械通气时间及预后结局(良好、致残及死亡)。

2 结果
2.1一般资料 228例患者中非感染组206例,感染组22例,术后继发颅内感染率为9.6%。感染组22例患者中CSF培养结果为凝固酶阴性的葡萄球菌8例(36.4%)、金黄色葡萄球菌2例(9.1%)、鲍曼不动杆菌5例(22.7%)、肺炎克雷伯杆菌7例(31.8%)。感染组患者术后感染平均时间为术后5.0 d。感染组APACHEⅡ评分、入院HR、手术持续时间、脑室引流管留置时间、ICU停留时间及机械通气时间均明显大于非感染组,而患者发病至就诊时间、GCS评分、入院Hb及ALB均明显小于非感染组,非感染组患者预后结局明显优于感染组,差异均有统计学意义(均P<0.05)。见表1。

表1 两组颅脑损伤患者临床资料比较
2.2术后CSF炎症因子 非感染组患者术后CSF中IL-2、IL-4和TNF-α均呈升高趋势,IL-6逐渐下降,而感染组患者术后CSF中IL-2、IL-4和TNF-α升高趋势更为明显,IL-6逐渐升高,γ-IFN呈下降趋势。感染组患者术后第1天(IL-2)、术后第2天(IL-2、IL-4和IL-6)和术后第3天(IL-4、IL-6和TNF-α)均明显大于非感染组,而术后第3天 γ-IFN明显小于非感染组,差异均有统计学意义(均P<0.05)。两组IL-10变化比较差异无统计学意义。见表2~7。
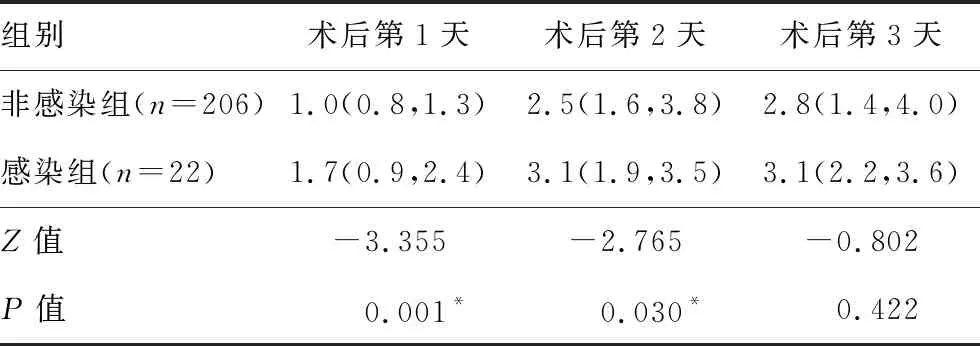
表2 两组颅脑损伤患者术后CSF中IL-2变化比较[M(QL,QU),pg/mL]
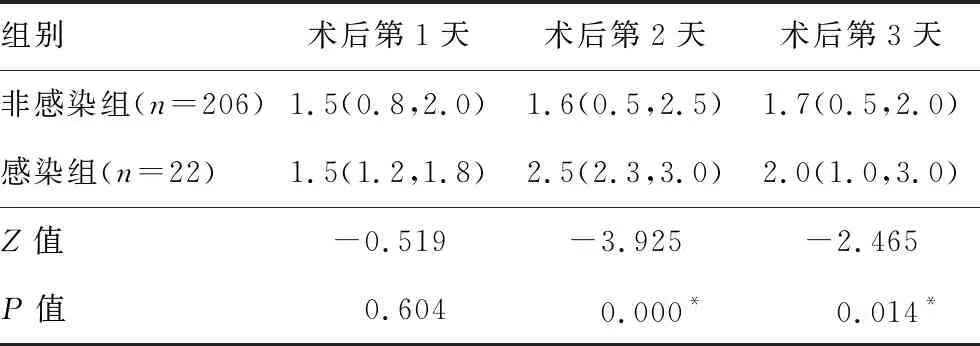
表3 两组颅脑损伤患者术后CSF中IL-4变化比较[M(QL,QU),pg/mL]
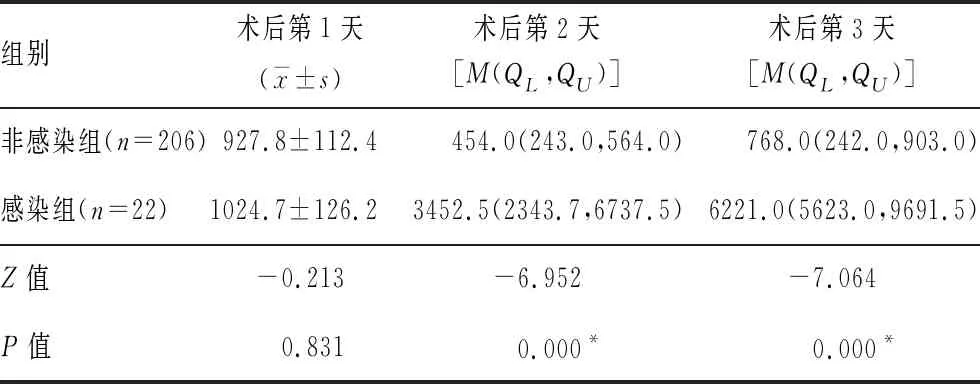
表4 两组颅脑损伤患者术后CSF中IL-6变化比较(pg/mL)

表5 两组颅脑损伤患者术后CSF中IL-10变化比较[M(QL,QU),pg/mL]

表6 两组颅脑损伤患者术后CSF中TNF-α变化比较(pg/mL)

表7 两组颅脑损伤患者术后CSF中γ-IFN变化比较[M(QL,QU),pg/mL]
2.3CSF炎症因子诊断颅脑术后继发颅内感染的ROC结果 对单因素分析差异有统计学意义的CSF炎症因子进行ROC分析发现,术后第3天IL-6(IL-6-D3)诊断颅内感染的临床价值最高,其AUC为0.958[95%CI(0.933~0.984),P<0.05],最佳截断点为4349 pg/mL时,其敏感度、特异度和约登指数分别为0.909、0.893和0.802;其次为IL-6-D2、TNF-α-D3、IL-6-D1、IL-4-D2、γ-IFN-D3、IL-2-D1、IL-4-D3和IL-2-D2。见表8。

表8 CSF炎症因子诊断颅脑术后颅内感染的ROC结果
3 讨论
神经外科术后继发的原发性颅内感染不同,主要与术后留置引流管相关,部分患者存在CSF鼻漏或耳漏,尤其是颅脑损伤患者[7]。研究[8]显示,颅脑术后患者存在着CSF的波动,常伴有CSF细胞数、多核细胞比例、乳酸及蛋白水平的升高,这种情况在术后早期普遍存在。临床医生在遇到这些情况时首先需要鉴别是非感染性还是感染性发热,而单纯的以CSF培养阳性来诊断颅内感染极易造成延误治疗,因为CSF培养的阳性率不到20%[9]。临床工作中还发现,在颅脑损伤的早期尤其是开颅术后早期也存在着白细胞计数及CRP和PCT的升高,这是机体因为创伤引起全身炎症反应综合征,在一定程度上干扰了颅内感染的诊断。研究[10]显示,一些临床危险因素可能有助于鉴别是否合并颅内感染,如免疫抑制状态、糖尿病史、手术时间超过3 h、脑室引流超过5 d等。然而对开颅术后早期的颅内感染诊断并不能完全照搬自发性颅内感染的标准,且干扰因素较多,需要更多有效的临床指标来协助诊断[11]。
促炎反应和抗炎反应持续存在于感染全过程,研究[12]显示,颅内感染过程中往往存在促炎反应/抗炎反应的紊乱,造成炎症因子水平的变化。葛风等[13]研究了76例重度颅脑损伤术后诊断为颅内感染的患者,检测其CSF中的炎症因子水平,发现感染组IL-6、IL-8、TNF-α和γ-IFN水平在诊断感染之前就已经明显升高,尤其是CSF中的高迁移率族蛋白B1(HMGB1),对诊断术后颅内感染的敏感度和特异度分别达到了82.24%和91.73%。李时光等[14]的研究发现,颅内感染CSF中S100蛋白和PCT水平明显升高,并且细菌性脑炎时S100蛋白和PCT水平升高程度明显高于病毒性脑炎。本研究发现,所有颅脑损伤患者术后早期CSF中的IL-2和IL-6水平均出现不同程度的升高,且感染组升高更为明显,与非感染组比较差异有统计学意义。有学者同时检测了颅内感染患者血清及CSF中的IL-6,结果发现,CSF中的IL-6变化更为明显,提示颅内感染时CSF中的IL-6升高更快更明显,这一趋势同样适用于IL-2,这一点与两者的促炎功能一致,CSF中的IL-2和IL-6升高能够诱导体内急性期蛋白的合成,促进血管内皮表达黏附分子,增强局部炎症反应[15]。本研究发现,IL-4在感染组也有不同程度的升高,与非感染组比较差异也有统计学意义,提示其作为抗炎因子在早期也开始发挥作用。此外还发现,在术后第3天感染组TNF-α水平明显升高,与非感染组比较差异有统计学意义,提示其在颅内感染发生时具有促进局部炎症的作用。而γ-IFN的变化则呈现出相反的趋势,在感染组明显降低,与非感染组比较差异有统计学意义,提示在颅内感染的早期其活性受到抑制,减弱了机体的的抗炎能力,这一点在细菌性脑膜炎患者中的表现更为明显[16]。此外,作为抗炎介质的IL-10在两组间的变化趋势抑制,表现为先升高后降低,组间比较差异无统计学意义,提示其对于颅内感染的发生和促进意义不大。
本研究中对单因素分析显示有统计学意义的炎症因子指标进行ROC分析,结果显示,术后第3天CSF中IL-6(IL-6-D3)诊断颅内感染的临床价值最高,AUC为0.958[95%CI(0.933~0.984),P<0.05],最佳截断点为4349 pg/mL时,其敏感度、特异度和约登指数分别为0.909、0.893和0.802;其次为IL-6-D2、TNF-α-D3、IL-6-D1、IL-4-D2、γ-IFN-D3、IL-2-D1、IL-4-D3和IL-2-D2。进一步证实CSF中IL-6水平的升高对诊断术后颅内感染具有极高的临床价值,尤其是IL-6>5000 pg/mL的患者,这一点与Markus Lenski等[5]的研究结果一致。提示对于临床高度怀疑术后颅内感染的患者,要密切监测CSF中IL-2和IL-6等炎症因子水平的变化,一旦发现其持续升高时就应该严密监测CSF生化常规结果,尽可能多送CSF培养以获得病原学依据,必要时送检CSF宏基因组二代测序(NGS),高度警惕颅内感染。
综上所述,颅脑损伤术后患者CSF中IL-2、IL-4、IL-6和TNF-α水平的升高对诊断颅内感染具有极高的临床价值,其中术后第3天IL-6诊断价值最高,值得在临床中推广应用。同时本研究仍存在不足之处,仅为单中心研究,尚需要更大规模的多中心研究进一步证实。
利益冲突声明:本研究无相关的利益冲突问题。

