16p11.2微缺失/微重复胎儿的产前诊断和遗传学分析
傅婉玉,王俊育,王元白,江矞颖,李燕青
(福建省泉州市妇幼保健院·儿童医院产前诊断中心,泉州 362000)
染色体微缺失/微重复综合征是指由微小的染色体变异引起的遗传性疾病。16p11.2是指16号染色体短臂(p)上的11.2区域,16p11.2核心易感区两侧存在低拷贝重复区域(low copy repeats,LCRs),减数分裂过程中易因同源染色体上非等位基因重组而产生拷贝数变异(copy number variants,CNVs),且该区域CNVs无论是微缺失还是微重复,均已证实能引发临床症状[1]。据报道,16p11.2微缺失在人群中发病率为0.028%~0.043%[2],其往往表现为神经发育障碍和自闭症谱系障碍等,且这类患者更容易发生肥胖[1]。16p11.2微重复的人群发病率在0.035%~0.053%之间,其往往表现为低体重、小头畸形以及发育迟缓等[2]。16p11.2微缺失和微重复的遗传特点明显不同,大多数微缺失是新发突变的,而大多数微重复则是遗传的。本研究回顾性分析我院2017年至2021年8月发现的9例涉及16p11.2微缺失/微重复胎儿的病例资料,以期为产前遗传咨询提供一定参考。
资料与方法
一、研究对象
回顾性分析2017年1月1日至2021年8月31日在我院产前诊断中心因中孕期血清学筛查(即唐氏综合征产前筛查,简称唐筛)高风险、胎儿超声结构异常、胎儿超声软指标异常[如颈后透明层(NT)增厚、侧脑室增宽、脉络丛囊肿、轻度肾盂扩张等]、孕妇高龄等指征于孕18~26+6周行羊水染色体核型及单核苷酸多态性微阵列芯片(SNP-array)检查的2 942例孕妇的临床资料,共检出涉及16p11.2区域CNVs的9例。本研究中所有行介入性产前诊断的孕妇在检测前均充分知情并签署知情同意书。
二、染色体核型分析和SNP-array检测
采用超声引导行羊膜腔穿刺术,抽取30 ml羊水分别用于羊水染色体核型分析和SNP-array检测。20 ml用于羊水细胞培养,羊水培养后进行细胞收获、染色体制备、染色,进行核型分析。羊水细胞共计数可分析核型30个,分析5个核型。染色体的命名依据人类细胞遗传学国际命名体制(ISCN 2016)的标准。
另外10 ml羊水样本及夫妻双方外周血各3 ml送至第三方检测公司(北京贝康医学检验所)进行检测,通过离心收集沉淀,按照Affymetrix Cytoscan 750K基因芯片试剂盒(赛默飞世尔,美国)说明书进行操作,提取羊水细胞基因组DNA,经稀释消化、扩增、纯化后,将芯片上的探针与用生物素进行标记后的相应待测片段进行杂交、洗涤、结合染色后放入GeneChip扫描仪(Affymetrix,美国)扫描,采用Chromosome Analysis Suite(ChAS) v4.0软件对扫描检测的荧光信号进行分析。根据美国医学遗传学会指南,通过查询DGV、OMIM、Pubmed、DECIPHER以及UCSC数据库对CNVs的临床意义进行分析。
结 果
一、染色体核型结果
本文共分析8个家系的9例胎儿,羊水染色体核型检测结果显示家系1~8中家系1、2、4、6、7、8胎儿染色体核型检查均未见明显异常;家系3胎儿染色体核型为45XN,rob(13;21)(q10;q10)[15]/46,XN,[35];家系5胎儿染色体核型为46,XN,t(2;12)(p16;q21.2)mat,即胎儿为母源2号染色体与12号染色体平衡易位携带者。
二、SNP-array结果及妊娠结局
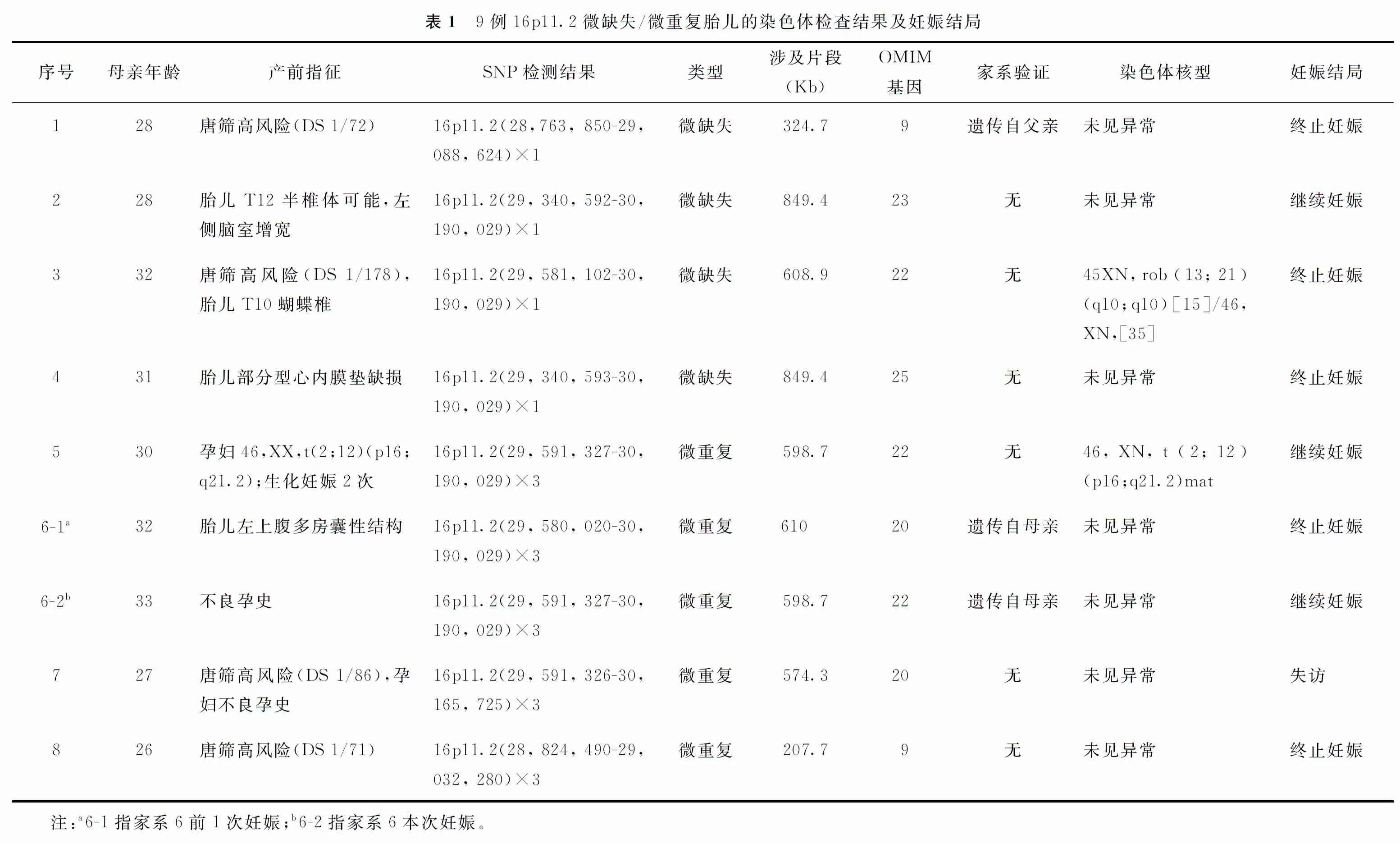
本研究共检出涉及16p11.2区段核心易感区域CNVs胎儿9例,检出率为0.31%(9/2 942)。其中,微缺失发生率0.14%(4/2 942),微重复发生率0.17%(5/2 942)。9例检出16p11.2区段核心易感区域CNVs的片段大小从207.7~849.4 Kb不等,其中涉及远端易感区微缺失和微重复各1例,近端易感区微缺失3例、微重复4例(详见表1)。家系1胎儿经父母验证遗传自表型正常的父亲,经遗传咨询,孕妇及家属仍选择终止妊娠;家系2孕期彩超检查提示第12胸椎(T12)半椎体可能、左侧脑室增宽,孕妇及家属选择继续妊娠,出生前彩超检查提示胎儿左侧脑室增宽恢复正常,于2019年12月22日经剖宫产1男婴,撰稿时胎儿1周岁11个月,电话随访家属自述发育良好,未发现脊柱侧弯;家系3胎儿因唐筛高风险,行染色体核型检查提示罗氏易位(嵌合型)、16p11.2微缺失,孕23周排畸彩超检查发现胎儿T10蝴蝶椎,孕妇及家属选择终止妊娠;家系5经遗传咨询,孕妇及家属选择继续妊娠,于2021年10月1日经阴道分娩1女婴,至撰稿时家属自述发育良好;家系6前1次妊娠因胎儿左上腹多房囊性包块(10 cm×8 cm×7 cm)合并16号染色体微重复而选择终止妊娠,本次妊娠羊水染色体SNP-array检出胎儿与前1次妊娠胎儿存在相同片段16p11.2微重复,经验证遗传自表型正常的母亲,孕期彩超随访未见明显结构异常,孕妇及家属选择继续妊娠,于2021年8月30日经阴道分娩1女婴,撰稿时婴儿3月龄,生长发育状况良好;家系4和家系8均选择终止妊娠;家系7失访。
讨 论
CNVs是一种结构变异,涉及特定DNA序列拷贝数的改变,包括缺失和重复。16p11.2区域的CNVs关联了几种不同的复发性综合征[3],主要有16p11.2p12.2微缺失综合征、16p11.2p12.2微重复综合征、远端16p11.2微缺失综合征、近端16p11.2微缺失综合征及近端16p11.2微重复综合征[4]。越来越多的证据表明16p11.2区域CNVs在神经精神疾病的病因学中有重要影响,包括自闭症、精神分裂症、发育迟缓和其他复杂性状等[5-8]。有文献报道16p11.2微缺失与大头畸形相关,而16p11.2微重复与小头畸形相关[6,9]。此外,还有关于16p11.2区域CNVs与眼部发育异常、肥胖和女性生殖道疾病、Mayer-Rokitansky-Küster-Hauser综合征相关的报道[10-11]。
最常见的16p11.2区域CNVs是约600 Kb的复发性缺失,由断点4至5(BP4-BP5)引起,即典型16p11.2缺失综合征(OMIM:611913),该区域覆盖有:PRRT2、KCTD13、TBX6、HIRIP3等29个基因[4];其远端为非典型16p11.2缺失(OMIM:613444),这类缺失较少见,此区域包含SH2B1、CD19等9个基因[12]。存在16p11.2复发性微缺失的胎儿最常见的超声检查特点是骨骼畸形(特别是椎骨畸形),其次是心血管畸形和孤立的超声标志物[13]。本研究中家系2彩超提示胎儿T12半椎体;家系3胎儿因孕18周时唐筛提示高风险,行介入性诊断确诊16p11.2微缺失,孕23周排畸彩超发现胎儿T10蝴蝶椎。TBX6基因与常染色体显性和隐性脊椎骨发育不全5(OMIM:122600)相关。TBX6基因杂合性缺失的表型在不同种族中也不尽相同,在中国汉族人群中主要导致半椎体畸形、脊柱侧弯[14]。Liu等[15]研究发现半椎体/蝴蝶椎是TBX6相关先天性脊柱侧弯(TACS)最显著的特征。WU等[16]报道在中国汉族人群中TBX6基因以一种特殊的作用形式即无功能等位基因(包括16p11.2微缺失综合征中TBX6基因的缺失)合并另一个常见的亚效等位基因单体型T-C-A(3个常见的单核苷酸多态性位点:rs2289292、rs3809624、rs3809627)产生效应继而导致半椎体和脊柱侧弯。有临床报告表明16p11.2微缺失综合征患儿心脏畸形的发生率略有增加[17]。本研究中家系4胎儿排畸彩超提示胎儿心内膜垫缺损,羊水SNP-array结果为典型16p11.2 微缺失综合征。Puvabanditsin等[18]报告了第1例16p11.2微缺失相关心内膜弹性纤维变性(EFE)患者;Shinawi等[19]研究发现16p11.2微缺失患者的先天异常包括先天性心脏缺陷、先天性膈疝、腭裂、多指畸形、下肋骨融合和幽门狭窄等。16p11.2微缺失综合征涉及的基因缺失较多,其如何导致患儿心脏畸形的机制尚未完全明确,有研究推测HIRIP3为其候选基因[20-21]。
16p11.2微缺失和微重复的遗传特点明显不同,大多数微缺失是新发突变,而微重复则大多是遗传自父母,这可能是由于微重复引起的表型不太严重,从而更有可能传递给后代[22]。本研究中家系1胎儿经验证为遗传自表型正常的父亲;家系6女方先后两次妊娠的胎儿经验证均遗传自表型正常的母亲,但因女方及家属拒绝对前1次妊娠的胎儿进行尸检,胎儿左上腹多房囊性包块的性质及来源与胎儿16p11.2微重复综合征是否相关尚不明确,本次妊娠胎儿在孕期彩超随访中未发现异常故选择继续妊娠。2013年有西方学者报道,16p11.2近端微缺失、远端微缺失和近端微重复、远端微重复的外显率分别约为62.4%、46.8%和11.2%和27.2%[23],提示该片段的缺失/重复存在不完全外显率或者表现度差异。而由中国深圳华大基因研究院、英国桑格研究所以及美国国立人类基因组研究所等多家机构共同发起的“千人基因组计划”公布的数据中,中国汉族人群中16p11.2微缺失综合征的外显率约为44%[24]。Shen等[25]报告了1个中国家庭中3例具有相同16p11.2微缺失的家庭成员不同发育轨迹和不一致的表型,进一步说明16p11.2微缺失表型的复杂性和异质性。16p11.2微重复表型的特征具有更广泛的变异性,从无明显症状到严重残疾都有发生,其最常见的诊断是儿童智力障碍、运动迟缓和注意力缺陷多动障碍等,以及成年后的焦虑症[26];其导致临床表现度差异的原因可能是受累片段大小不同、相同基因的外显率不同、区段遗传物质丢失后染色体空间结构发生改变、环境因素等[27]。本研究中共有3例孕妇选择继续妊娠,至撰稿时电话随访家属均称生长发育良好,但因年龄尚小,无法准确评估其精神及神经发育情况,仍需长期跟踪随访。
目前,G显带染色体核型分析技术仍然是细胞遗传学产前诊断的“金标准”,可分析大于5 Mb的染色体结构异常,包括染色体平衡易位、罗氏易位、倒位等。与传统的染色体核型技术相比,染色体微阵列分析(CMA)技术[包括微阵列比较基因组杂交(aCGH)和SNP array两大类]对于检测染色体组100 bp以上的微小缺失、重复等不平衡性重排具有突出优势[28]。本文涉及的16p11.2微缺失和微重复的片段大小均在1 Mb以下,低于染色体核型分析的检测范围,CMA技术则可明确诊断;但本研究中染色体核型分析技术检测出家系3及家系5胎儿为CMA无法检测的染色体罗氏易位及平衡易位携带者。提示染色体核型分析结合CMA技术用于产前高危孕妇筛查有一定的应用价值。当发现胎儿存在16p11.2的CNVs时,产前遗传咨询应结合超声表现、亲代验证情况,慎重选择妊娠结局。本研究亦存在一些不足:收集例数较少,未能将16p11.2微缺失与微重复单独分析;部分家系因经济及依从性问题拒绝家系验证;胎儿出生后随访时间较短,患儿预后资料不全。后续仍需更多的数据进一步分析。
综上,胎儿16p11.2微缺失/微重复可表现为产前不同器官结构的异常,当产前超声提示胎儿结构异常,尤其是椎体异常和心脏畸形时应考虑16p11.2区域CNVs可能,建议行SNP-array检测协助排查遗传学病因。16p11.2区域CNVs存在不完全外显率及表现度差异,且可遗传自表型正常的亲代,因此产前遗传咨询具有一定的挑战性。当产前诊断发现16p11.2区域CNVs时,应建议亲代验证明确胎儿染色体变异的来源,以协助判断预后,为产前遗传咨询和临床决策提供参考。

