卵巢过度刺激综合征的分子机制和治疗研究进展
陈佳叶,方兰兰,孙莹璞
(郑州大学第一附属医院生殖与遗传专科医院,郑州 450052)
卵巢过度刺激综合征(OHSS)是辅助生殖技术(ART)的严重并发症之一,OHSS以卵巢增大、雌激素水平升高、血管通透性增加、胸腹水及血栓形成等为主要特征;根据临床症状分为轻、中、重度OHSS,其中轻度OHSS发生率可达20%~30%,中重度OHSS发生率为2%~3%[1]。临床上OHSS的治疗目前多为对症治疗,如静脉补液扩容、改善血液高凝状态、穿刺引流胸腹水等,必要时需终止妊娠;OHSS严重者可致孕妇死亡[2]。但OHSS的发病机制尚不明确,如何预测OHSS发生和早期防治仍是目前面临的重大挑战。本文将综述近年来OHSS发生的分子机制和防治措施的研究进展,为OHSS早期防治和个性化精准治疗提供参考。
一、OHSS发生的病理生理改变
人绒毛膜促性腺激素(HCG)是促进OHSS发生的关键因素,在ART助孕过程中外源性促性腺激素的基础上,外源性给予HCG可触发级联反应,表现为血清中雌激素等激素水平上升,血管内皮生长因子(VEGF)、各类细胞因子、肾素等血管活性物质释放,导致毛细血管通透性增加,体液大量外渗进入第三间隙,产生胸腹腔积液,导致有效循环血容量减少、血液浓缩、低血容量休克,发生卵巢增大、脏器功能衰竭等一系列OHSS病理生理改变。
二、OHSS分子机制研究进展
目前研究已证实OHSS的发病与大量生长因子、其他细胞因子以及卵巢肾素-血管紧张素-醛固酮系统(OVRAS)等相关。
(一)生长因子与OHSS
1.VEGF:VEGF是调节血管生成及毛细血管通透性的重要因子,在使用相同促排方案的患者中,与对照组相比,OHSS组的颗粒细胞和卵泡液中VEGF水平明显升高[3]。动物模型的研究表明,靶向VEGF或其受体可以阻止OHSS的发展[4]。多巴胺激动剂卡麦角林可阻断VEGF及其受体复合物的下游信号通路,给予患者卡麦角林后,可预防OHSS发生,降低发病风险[5]。此外,环氧合酶2(COX-2)和内质网应激可以通过调节VEGF表达参与OHSS发生发展。COX是花生四烯酸转化为前列腺素和其他类花生酸的关键酶。在多项研究中发现,COX-2与血管生成相关,COX-2过表达使得大量促血管生成因子产生,包括VEGF等[6]。此外,免疫组织化学结果显示COX-2和VEGF在卵巢中具有相似的空间分布,COX-2定位于卵巢颗粒细胞及卵巢血管中[7]。HCG注射可上调卵泡液内COX-2表达,进一步研究发现,COX-2基因在OHSS大鼠卵巢中的表达增加,给予COX-2选择性抑制剂美洛昔康后抑制VEGF高表达,降低其卵巢重量的增加[8]。因此,COX-2调节VEGF表达可能是OHSS发病机制之一。内质网应激也上调人卵巢颗粒细胞中VEGF的表达;抑制内质网应激可降低OHSS大鼠VEGF的表达[9],提示内质网应激上调VEGF表达可能与OHSS相关。故VEGF被认为是促使OHSS发生发展的一个重要介质。
2.色素上皮衍生因子(PEDF):PEDF是一种天然、高效的新生血管抑制剂,在VEGF存在的情况下可以明显抑制血管内皮细胞管腔形成和迁移,具有抗血管生成作用[10]。PEDF在人卵巢中表达,由颗粒细胞产生和分泌,HCG可下调PEDF的表达,并且PEDF的表达与VEGF的表达情况相反[11]。PEDF和VEGF之间的平衡可能参与维持卵巢的正常生理活动,这两种因子之间的平衡部分受HCG或LH的调节。此外,PEDF通过抑制HCG上调的VEGF和炎症介质表达,改善OHSS小鼠体重增加、卵巢增大、血管通透性增加等症状[12]。这些研究表明,PEDF通过调节VEGF与炎症介质的表达参与OHSS发生发展。
3.双调蛋白(AREG)及相关受体:AREG是人颗粒细胞和卵泡液中表皮生长因子受体(EGFR,又称HER1/ErbB1)最主要的配体,EGFR和HER2(ErbB2)属于酪氨酸激酶受体家族,是一种广泛表达的跨膜酪氨酸激酶,AREG结合EGFR,激活细胞内信号级联,调控多种生理活动[13]。OHSS患者颗粒细胞和卵泡液中AREG、EGFR和HER2高表达,卵泡液中AREG蛋白水平与窦卵泡数量、回收卵母细胞数、血清雌二醇水平等呈正相关。AREG作用于颗粒细胞可上调VEGF的表达和分泌,且这一促进作用在OHSS患者中更迅速、更显著[3]。此外,研究表明,HCG诱导的AREG上调颗粒细胞中芳香化酶的表达,进而促进雌二醇的合成[14]。这些结果表明颗粒细胞分泌的AREG在OHSS的发生发展中起重要作用,提示EGFR/HER2介导的信号转导通路可能是预防和治疗OHSS新的药物靶点。
4.转化生长因子β1(TGF-β1):TGF-β1是TGF-β超家族成员之一,是一种功能多样但结构保守的蛋白质[15]。其中,TGF-β1及TGF-β受体在颗粒细胞中均有表达,人卵泡液中也可检测到TGF-β1蛋白。进一步研究发现,TGF-β1结合并活化TGF-β受体,通过SMAD、ERK1/2和p38 MAPK信号通路上调人颗粒细胞中VEGF和芳香化酶的表达以及雌二醇的生成[16]。在接受IVF助孕的患者中,OHSS患者卵泡液中TGF-β1、雌二醇和VEGF水平均升高且相关。此外,OHSS小鼠卵巢TGF-β1表达增加,阻断TGF-β1信号通路可抑制VEGF高表达,使OHSS小鼠体重增加和卵巢增大症状得到改善[17]。因此,TGF-β1可能通过上调VEGF和雌二醇的表达参与OHSS的发生发展,靶向TGF-β1信号通路可作为预防OHSS发生的新型分子治疗措施。
5.Sprouty2(SPRY2):SPRY2是EGFR介导的ERK1/2信号传导通路中的重要调节因子[18]。研究表明,表皮生长因子(EGF)、成纤维细胞生长因子(FGF)等通过激活ERK1/2信号通路上调人颗粒细胞中SPRY2的表达[19]。接受IVF助孕的患者中,并发OHSS的患者颗粒细胞中SPRY2表达水平显著升高,提示SPRY2的高表达可能与OHSS发生相关。进一步研究发现,HCG通过ERK1/2信号通路上调人颗粒细胞中SPRY2的表达,阻断SPRY2内源性表达后,AREG上调的COX-2及PGE2表达受抑制[20]。此外,新近研究发现,在OHSS患者卵泡液中,外泌体miR-27通过靶向SPRY2下调活性氧的产生并促进颗粒细胞凋亡[21]。以上结果表明HCG诱导的SPRY2介导人颗粒细胞中AREG对COX-2/PGE2表达的上调可能是OHSS的发病机制之一。
(二)其他细胞因子在OHSS发生中的作用
1.白细胞介素(IL):卵巢自身合成和分泌的IL在OHSS发生发展中发挥一定的作用。研究发现,OHSS患者的腹腔积液中IL-1水平较高,而IL-1受体拮抗剂水平较低,IL-6和IL-8水平显著升高[22]。在OHSS患者血清中IL-6水平也显著升高,但随着症状的改善,其水平逐渐下降至正常[23]。此外,OHSS患者外周血单核细胞中IL-2高表达[24]。IL参与炎症反应,增加血管通透性导致OHSS发生[23]。
2.其他细胞因子:其他的一些细胞因子也与OHSS发病密切相关,如肿瘤坏死因子α(TNF-α)、一氧化氮(NO)等。卵巢自身合成TNF-α,在颗粒细胞中检测出高亲和力受体[25]。OHSS患者腹腔积液中TNF-α水平显著升高[26]。此外,研究发现HCG抑制NO合成[23],且OHSS患者腹腔积液中NO最终代谢产物——亚硝酸盐水平显著降低[27],NO的降低可增加毛细血管通透性,故低水平NO可能与OHSS相关。
(三)OVRAS与OHSS
OVRAS受HCG调节,对卵泡发育、排卵和类固醇激素分泌有重要影响。血管紧张素及其受体广泛分布于卵泡、排卵前卵泡膜细胞和颗粒细胞中,并调节类固醇生成[28]。使用促性腺激素促排卵患者血中及卵泡液中肾素原浓度大幅增加,而且浓度与排卵前卵泡数量呈正相关。OHSS患者的卵泡液和血浆中可检测出高肾素活性[29]。进一步研究发现,卵泡内血管紧张素Ⅱ诱导前列腺素释放,促进血管生成,增加血管通透性[30],是OHSS发生的重要机制。
(四)激素与OHSS
1.雌激素:OHSS患者血清高雌二醇水平与OHSS的发生显著相关[31]。动物实验中,与对照组小鼠相比,OHSS小鼠卵巢芳香化酶的表达和血清雌二醇水平上调[32]。有研究发现囊性纤维化跨膜传导调节因子(CFTR)作为一种cAMP激活的氯离子通道,其在体液平衡调节中起重要作用;在OHSS大鼠中,雌二醇上调CFTR表达可能与OHSS体液渗漏相关[33]。提示升高的雌二醇可能通过上调CFTR表达参与OHSS的发生发展。
2.褪黑素及其受体:褪黑素是一种主要由松果体合成和分泌的神经内分泌激素,其他组织器官也可少量合成[34]。褪黑素通过结合并激活两种膜结合的G蛋白偶联受体MT1和MT2,从而发挥其生物学功能[35]。研究表明,褪黑素及其受体MT1参与颗粒细胞中LH的下游反应通路[36]。OHSS患者卵泡液中褪黑素、芳香化酶及雌激素水平高于非OHSS患者,且褪黑素水平与VEGF及雌激素水平呈正相关[37]。进一步研究发现褪黑素通过MT2和PI3K/AKT信号通路上调人颗粒细胞中VEGF的表达[38]。MT2选择性拮抗剂4-P-PDOT阻断OHSS组大鼠VEGF表达的上调,有利于改善卵巢增大和体重增加的症状。以上结果表明褪黑素对人颗粒细胞中VEGF的表达具有促进作用,提示卵巢局部褪黑素高表达和褪黑素上调的VEGF可能与OHSS的发病相关[32],卵泡液中的褪黑素可能是OHSS发生的有效预测因子。
小结,OHSS的发病机制涉及多种分子和信号通路。除传统观点中的VEGF、OVRAS等在OHSS的发病中起重要作用外,人颗粒细胞中某些因子或激素也参与OHSS的发生发展,如AEGR、TGF-β1、褪黑素等;与非OHSS患者相比,OHSS患者颗粒细胞内AEGR、TGF-β1、SPRY2等分子表达及褪黑素水平增加,进而通过下游信号通路,上调VEGF、COX-2和雌激素等OHSS相关因子和激素,参与OHSS发生发展,如图1和图2所示。
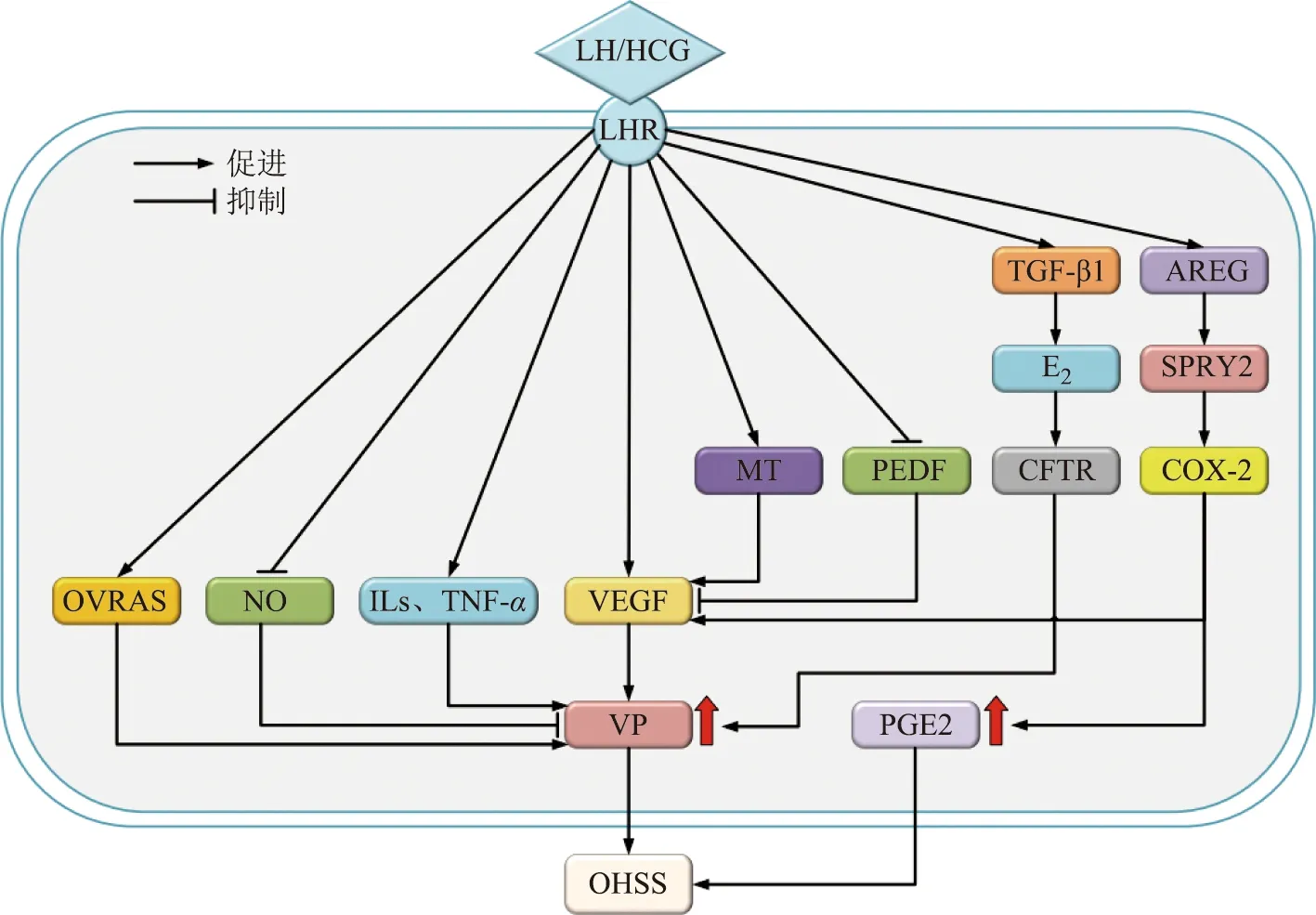
LHR:黄体生成素受体;TGF-β1:转化生长因子1;AREG:双调蛋白;E2:雌二醇;SPRY2:Sprouty2;MT:褪黑素;PEDF:色素上皮衍生因子;CFTR:囊性纤维化跨膜传导调节因子;COX-2:环氧合酶2;OVRAS:卵巢肾素-血管紧张素-醛固酮系统;NO:一氧化氮;ILs:白细胞介素;TNF-α:肿瘤坏死因子α;VEGF:血管内皮生长因子;VP:血管通透性;PGE2:前列腺素E2;OHSS:卵巢过度刺激综合征。图1 多种分子及激素参与调节OHSS发生

Theca cells:卵泡膜细胞;Granulosa cells:颗粒细胞;Cumulus cells:卵丘细胞;Oocyte:卵母细胞;LH:黄体生成素;HCG:人绒毛膜促性腺激素;LHR:黄体生成素受体;AREG:双调蛋白;EGFR:表皮生长因子受体;SPR2:Sprouty2;TGF-β1:转化生长因子1;COX-2:环氧合酶2;VEGF:血管内皮生长因子;AROM:芳香化酶;PGE2:前列腺素E2;Melatonin:褪黑素;MT2:褪黑素受体。图2 非OHSS患者与OHSS患者颗粒细胞中分子标记物表达的比较
三、OHSS的治疗
上述关于OHSS发病机制的研究为预防和治疗OHSS提供了新思路。VEGF是OHSS发生发展的关键因子,使用药物来阻断VEGF和VEGF受体2(VEGFR-2)在卵巢中的过表达可阻止OHSS的发生。但VEGFR-2抑制剂SU5416抑制磷酸化的同时会产生的不良副作用使其不能用于临床治疗。研究表明,多巴胺激动剂卡麦角林可使VEGFR-2去磷酸化,是预防OHSS有效且安全的药物[39]。但其预防OHSS的用量尚未达成共识,临床应用受限,安全性以及对妊娠结局的影响尚不清楚。血管紧张素转换酶抑制剂和血管紧张素转换酶受体拮抗剂可以阻断OVRAS,但其对OHSS的防治效果仍不明确[40]。
近年来关于OHSS相关分子及信号通路的研究中也提到了一些预防与治疗的新思路。给予OHSS小鼠褪黑素受体拮抗剂卢吲哚[32]或TGF-β1抑制剂SB431542[17],其体重增加和卵巢增大的症状均有改善。给予OHSS大鼠MT2选择性拮抗剂4-P-PDOT后可抑制VEGF高表达,进而改善体重增加和卵巢增大的症状[32]。这些动物实验结果为之后的临床研究和应用提供了新的方向和依据,在已有的研究基础上,进一步阐明相关分子促使OHSS发生发展的具体调控机制,对涉及的信号通路或受体深入研究,以期发现OHSS的分子靶标和治疗靶点。
四、结论与展望
随着对OHSS的深入研究,多种分子及信号通路已被证实与OHSS发生发展密切相关,已证实VEGF、COX-2、雌激素等与OHSS病理生理改变息息相关,在HCG/LH的作用下,AREG、TGF-β1、SPRY2等分子标记物表达及褪黑素水平增加,导致上述OHSS相关分子水平升高,这些分子之间通过相应的信号通路构成信号网格共同参与OHSS的发生发展。这为OHSS的早期诊断和精准治疗提供了新的方向,一些分子抑制剂及受体拮抗剂能改善OHSS动物的相关症状,但其临床应用的安全性和有效性尚有待于进一步研究。这些研究为探究OHSS的发病机制提供了新的思路和灵感,在此基础上进行深入研究,可为临床个性化精准治疗提供依据。

