优化选择性卵裂期单胚胎移植策略的妊娠结局分析
季玉娟,郑爱燕,丁洁,蒲艳,许咏乐,王馥新,李惠敏,孟庆霞*
(1.南京医科大学附属苏州医院,苏州市立医院生殖与遗传中心,苏州 215000;2.南京医科大学生殖医学国家重点实验室,南京 211166)
近30多年来,随着辅助生殖技术(ART)的飞速发展,治疗难治性不孕不育症在技术方面取得重大突破的同时,多胎妊娠率也明显升高,高达30%~40%[1],而自然妊娠中双胎妊娠发生率仅为0.01%~2%[2]。多胎妊娠大大增加了孕妇、胎儿、新生儿围产期疾病和并发症的发病风险,并使新生儿死亡率、成年后慢性病发病风险增高。有研究显示,多胎妊娠的早期自然流产率较高,双胎妊娠为36%,三胎妊娠为53%,四胎妊娠高达65%[3];且有数据显示我国多胎妊娠的整体早产率从2012年的46.8%上升到了2018年的52.7%[4]。有观点认为ART子代出生缺陷发生率显著高于自然妊娠,且缺陷发生的主要原因是多胎妊娠,多胎妊娠的出生缺陷发生率是单胎妊娠的两倍[2]。
ART的多胎妊娠率升高主要是因为多胚胎移植。一些国家规定移植胚胎数目不能超过2个,并鼓励优先进行单胚胎移植(SET)[5-8]。2018年中华医学会生殖医学分会(CSRM)发表了专家共识,建议通过选择性单胚胎移植(eSET)策略,持续关注减少多胎妊娠[9]。ART助孕的理想目标是获得单胎妊娠,其中最重要措施就是减少移植胚胎数目。eSET从胚胎移植数目上合理地限制了多胎妊娠的发生,其被认为是解决ART相关多胎妊娠及母婴健康问题最根本的措施[9]。因此,本研究回顾性分析我中心通过体外受精后第2天(D2)、D3胚胎形态学连续观察进行卵裂期选择性单胚胎移植的临床应用价值。
资料和方法
一、研究对象及分组
回顾性分析2019年6月至2020年10月在苏州市立医院生殖与遗传中心行IVF/ICSI-ET卵裂期胚胎新鲜周期移植或全胚冷冻保存后第1个冻融卵裂期胚胎移植患者的临床资料。
纳入标准:患者行第1个IVF/ICSI-ET助孕周期,或之前有1次成功助孕经历的患者再次行IVF/ICSI-ET助孕;年龄≥20岁且<35岁;体质量指数(BMI)18~30 kg/m2;卵巢储备功能正常[基础FSH<10 U/L,基础窦卵泡计数(AFC)≥9个和/或抗苗勒管激素(AMH)>1.1 ng/ml];采用降调节长方案或拮抗剂方案促排卵;获得合格卵数≥6个;均行卵裂期胚胎移植。
排除标准:子宫畸形和宫腔异常;Ⅲ/Ⅳ期子宫内膜异位症;未处理的严重输卵管积水;卵巢囊肿或一侧卵巢切除;自然流产2次以上(包括生化妊娠);存在ART及妊娠禁忌证或患有对妊娠有明确影响的疾病。
共纳入731个移植周期,根据患者是否进行D2胚胎形态学观察和胚胎移植数目分为:D2、D3连续观察卵裂期单胚胎移植组(连续观察单胚组)70个周期;无D2观察、仅D3观察卵裂期单胚胎移植组(D3观察单胚组)97个周期;仅D3观察卵裂期双胚胎移植组(D3观察DET组)564个周期。
二、研究方法
1.促排卵方案:降调节长方案:月经第2天给予长效GnRH-a(珠海丽珠)3.75 mg皮下注射,28~40 d后,达降调标准(E2≤183.0 pmol/L,LH≤5.0 U/L,窦卵泡直径4~8 mm),给予Gn启动;拮抗剂方案:月经第2或第3天查血,行B超检查后给予Gn启动,采用灵活方案,最大卵泡达到12~14 mm或者E2水平1 101.0~1 835.0 pmol/L开始添加GnRH-ant(默沙东,美国),每日250 μg,直至HCG日。HCG日标准:B超提示4枚主导卵泡直径达到17 mm或3枚主导卵泡直径达到18 mm。HCG注射后36 h取卵。
2.人工授精、胚胎培养及移植:将获得的卵丘卵母细胞复合体(COCs)用G1 plus培养液(Vitrolife,瑞典)冲洗3次,置于含G1 plus培养液的胚胎培养皿(BD,美国)于常规培养箱(K-MING-1000,美国)中培养(培养条件:37℃,6.2%CO2,5%O2)。4~6 h后根据处理后精子情况行IVF(处理后前向运动精子总数≥3×106)或ICSI(处理后前向运动精子总数<3×106)。授精后17~19 h观察受精情况,将观察到双原核(2PN)的正常受精合子放入微滴培养皿独立培养,每个微滴含25 μl G1 plus培养液,按顺序标记后置培养箱中培养3 d(培养条件同前)。根据受精后第2天(D2)上午(受精后41~43 h)和D3上午(受精后64~66 h)胚胎的细胞数目、碎片数量和卵裂球均匀度进行胚胎形态学评分,D2优质胚胎指4细胞、碎片程度≤2度(即碎片率5%~20%),卵裂球均匀度≤2度(即卵裂球体积轻度不均);D3优质胚胎指6~10细胞、碎片程度≤2度,卵裂球均匀度≤2度。
连续观察单胚组根据D2和D3胚胎形态学评分选择1枚相对最优的卵裂期胚胎移植或者冷冻,具体选择标准如下:(1)如果D2和D3均为优质胚胎,则根据D3胚胎情况选择最优胚胎,第1个标准是细胞数,由优至劣依次是8、9、10、7、6;第2个标准是卵裂球均匀度,越均匀越优;最后是碎片程度,碎片越少越优。例如一个8细胞胚胎由优至劣的顺序是811→821→812→822。(2)如果D2没有优质胚胎,而D3有优质胚胎,则根据D3胚胎质量选择最优胚胎,选择标准同第一条。(3)如果D2有优质胚胎,而D3没有优质胚胎,则根据D2胚胎选择最优胚胎,首先考虑4细胞,其次考虑卵裂球均匀度,最后考虑碎片程度;例如一个4细胞胚胎由优至劣的顺序是411→421→412→422。(4)如果D2和D3均无优质胚胎,则根据D3胚胎选择可移植胚胎,具体如下:①如细胞数≥10,碎片程度≤2度,卵裂球均匀度≤2度的胚胎,首选细胞数目,细胞数目越少越优;其次是卵裂球均匀度,越均匀越优;最后是碎片程度,越少越优。②如细胞数在6~10之间,碎片程度≤3度(碎片率>20%),卵裂球均匀度≤2度,首选细胞数目,由优到劣的顺序是8、9、10、7、6,其次是卵裂球均匀度,最后是碎片程度。
D3观察单胚组仅根据D3胚胎形态学评分选择1枚相对最优质的卵裂期胚胎移植或者冷冻。
D3观察DET组仅根据D3胚胎形态学评分择优选择2枚的卵裂期胚胎移植或者冷冻。
每组行胚胎冷冻的条件是:患者有卵巢过度刺激的风险;存在不利于移植的内膜因素;HCG日孕酮(P)≥4.76 nmol/L。其余胚胎均行体外培养至囊胚后冷冻保存。
3.黄体支持:新鲜周期移植者,经阴道超声引导下取卵后次日开始黄体支持:阴道给予雪诺同(默克雪兰诺,德国)90 mg/d+口服地屈孕酮片(雅培,美国)10 mg,bid。取卵后第6天给予达必佳(辉凌,瑞士)0.1 mg单次皮下注射。
全胚冷冻保存者第1次冻融胚胎移植(FET)在取卵后第2个月经周期进行。月经周期规律者采用自然周期准备内膜,在月经第11~12天开始阴道超声监测排卵,排卵后次日开始给予HCG(珠海丽珠)2 000 U,隔日注射,共5次,联合每晚阴道给予黄体酮软胶囊(安琪坦,西班牙)200 ng和地屈孕酮片(达芙通,雅培)10 mg,bid,排卵后第3天行FET。月经周期不规律或无排卵者行人工周期准备内膜,在月经周期第2天开始给予补佳乐(先灵,德国)3 mg,bid,11~12 d阴道超声评估子宫内膜厚度,达到7~8 mm开始行内膜转化,阴道给予雪诺同90 mg/d或者黄体酮软胶囊200 mg,bid,联合地屈孕酮片20 mg,bid,内膜转化后第4天行FET。
4.妊娠结局判断及随访:移植后第14天测血β-HCG,HCG阳性者继续维持黄体支持;移植后35 d行B超检查,见孕囊者确认为临床妊娠。黄体支持至妊娠9~10周,行第2次B超检查,确定持续妊娠后停止黄体支持,继续随访至活产。
5.观察指标:主要观察指标为临床妊娠率(临床妊娠周期数/移植周期数)、种植率(孕囊数/移植胚胎数);次要观察指标为多胎妊娠率(多胎妊娠周期数/临床妊娠周期数)、HCG阳性率(HCG阳性周期数/移植周期数,HCG阳性定义为血HCG>10 U/L)、异位妊娠率(异位妊娠周期数/移植周期数)、早期流产率(孕周<12周的自然流产周期数/临床妊娠周期数)及促排卵和胚胎发育实验室指标等。
三、统计学分析
采用SPSS 22.0对数据进行统计学分析。计量资料进行正态性检验,不符合正态分布的用中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,多组整体比较采用Kruskal-Wallis秩和检验,两两比较采用Kruskal-Wallis单因素方差分析。计数资料用百分率(%)表示,多组整体比较采用R×C表χ2检验或Fisher确切概率检验,两两比较采用Bonferroni校正法。并对妊娠结局的影响因素进行多因素Logistic回归分析。P<0.05表示差异有统计学意义。
结 果
一、3组患者的一般情况比较
3组患者的年龄、BMI、基础性激素水平、AFC等比较均无显著性差异(P>0.05)。D3观察单胚组的AMH水平和男方因素不孕比例显著低于其他两组(P<0.05),继发不孕和排卵障碍比例显著高于其他两组(P<0.05);连续观察单胚组使用长方案促排卵比例显著低于D3观察DET组(P<0.05);D3观察DET组盆腔输卵管因素不孕比例显著高于其他两组(P<0.05)(表1)。

表1 各组患者的一般临床资料比较[M(P25,P75),%]

续表
二、3组患者促排卵及胚胎发育实验室指标比较
3组患者的不同授精方式占比、Gn总量、HCG日内膜厚度、HCG日P水平、刺激天数均无显著性差异(P>0.05)。D3观察单胚组的获卵总数、成熟卵子数、2PN受精数、卵裂数、优胚数、成囊胚数均显著低于其他两组(P<0.05),连续观察单胚组的优胚数和成囊胚数均显著高于D3观察DET组(P<0.05),D3观察DET组的HCG日E2水平显著高于D3观察单胚组(P<0.05)(表2)。
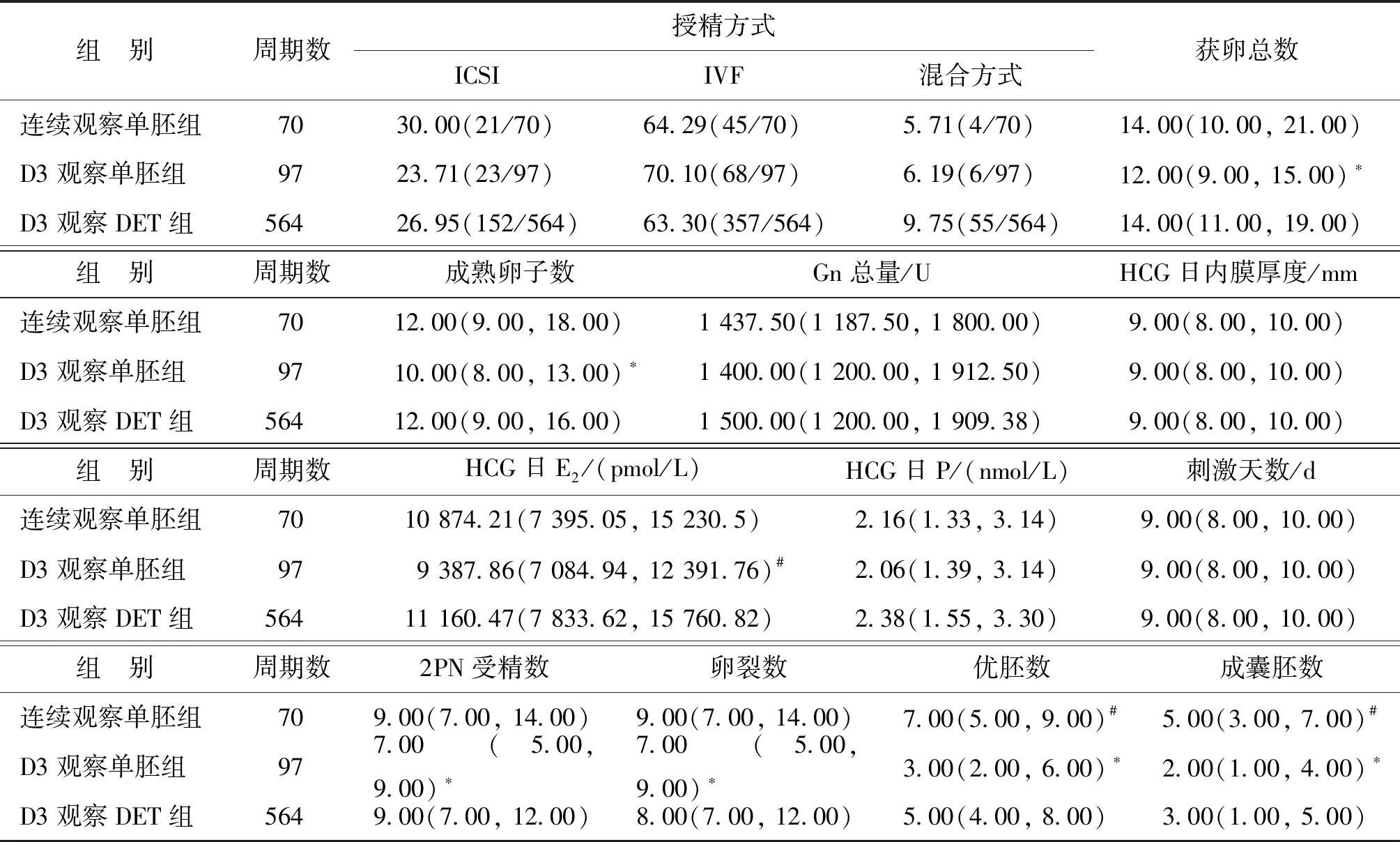
表2 各组患者促排卵和胚胎发育的实验室指标比较[%,M(P25,P75)]
三、3组患者临床妊娠结局比较
D3观察单胚组的临床妊娠率、HCG阳性率显著低于其他两组(P<0.05),连续观察单胚组的种植率显著高于其他两组(P<0.05);3组间的异位妊娠率、早期流产率无显著性差异(P>0.05)(表3)。连续观察单胚组和D3观察单胚组均无多胎妊娠发生,D3观察DET组的多胎妊娠率为42.37%(161/380)。
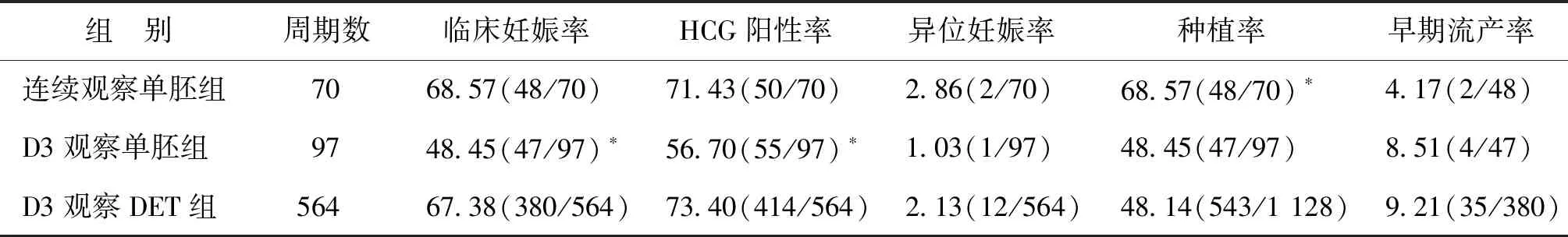
表3 各组患者临床妊娠结局比较(%)
四、3组患者两种周期类型的临床妊娠结局比较
连续观察单胚组中鲜胚移植29个周期,FET 41个周期;D3观察单胚组中鲜胚移植56个周期,FET 41个周期;D3观察DET组中鲜胚移植189个周期,FET 375个周期。3组患者新鲜周期的种植率、FET周期的临床妊娠率无显著性差异(P>0.05)。D3观察单胚组新鲜周期的临床妊娠率显著低于其他两组(P<0.05),连续观察单胚组FET周期的种植率显著高于D3观察DET组(P<0.05)。D3观察DET组新鲜周期的多胎妊娠率为40.46%(53/131),FET周期的多胎妊娠率为43.37%(108/249)(表4)。

表4 新鲜周期与FET周期的临床妊娠结局比较
五、多因素Logistic回归分析临床妊娠率的影响因素
以临床妊娠率为因变量,纳入的混杂因素有AMH、不孕类型、不孕因素、HCG日E2水平、促排卵方案、获卵数、成熟卵子数、2PN受精数、卵裂数、优胚数等,进行多因素Logistic回归分析显示,各因素对临床妊娠率的影响均无统计学意义(P>0.05)(表5)。

表5 多因素Logistic回归分析临床妊娠率的影响因素
讨 论
IVF-ET技术应用之初,往往移植多个胚胎以保证一定的临床妊娠率,从而导致多胎妊娠的大幅增加[10]。多胎妊娠的孕妇容易发生妊娠高血压综合征(简称妊高征)、产前子痫、妊娠糖尿病、产后出血等严重并发症。叶蓉华等[11]研究了各项并发症在双胎和单胎妊娠两组中的发病率,双胎妊娠组的妊高征(28.6% vs. 9.8%)、产后出血(11.5% vs. 2.0%)、妊娠糖尿病(3.8% vs. 1.0%)的发生率均显著高于单胎妊娠组(P<0.05)。李天凤等[12]研究发现,双胎组孕妇妊娠期肝内胆汁淤积综合征(3.67% vs. 0.84%)和贫血(13.07% vs. 8.99%)的发病率显著高于单胎组(P<0.05)。此外,多胎妊娠的高剖宫产率还增加了新生儿的健康风险。李天凤等[12]研究显示与单胎妊娠相比,双胎妊娠孕妇及家属因担心自然分娩困难、容易出现并发症而选择剖宫产的比率显著增加(95.18% vs. 61.80%),双胎妊娠组孕周明显缩短[(34.65±5.13)周vs.(35.80±5.17)周],新生儿早产率(12.16% vs. 11.27%)和低体重儿发生率(36.01% vs. 2.11%)显著增高(P<0.001)。随着对围产期并发症的深入了解,以及体外胚胎培养及冷冻技术的不断进步[13],国内外越来越多的生殖领域专家倡导通过eSET从源头上降低多胎妊娠的发生。既往多个研究也显示了单胚胎移植的有效性。刘丽等[14]研究发现,eSET组的临床妊娠率(50.77% vs. 53.83%)和早期流产率(18.18% vs. 9.48%)与DET组并无显著性差异(P>0.05),而多胎妊娠率显著低于DET组(0% vs.29.86%,P<0.001)。周立花等[15]的研究结论与刘丽等[14]类似。Pandian等[16]发现随着eSET率的增加,多胎出生率呈线性下降,且对临床妊娠率和活产率基本无影响。本研究结果显示对于年龄<35岁、卵巢储备功能正常的患者进行卵裂期单胚胎移植,如果仅根据D3胚胎形态学评分选择胚胎移植(D3观察单胚组)可以获得接近50%的临床妊娠率,早期自然流产率为8.51%;如果再结合D2胚胎形态学评分(连续观察单胚组)可以获得与D3观察DET组相似的临床妊娠率(68.57% vs. 67.38%),且两组的早期自然流产率亦无显著性差异(4.17% vs. 9.21%)。
D3胚胎评分仅反映了受精后65~67 h观察点的胚胎发育情况,若仅观察D3胚胎,会丢失在此之前很长一段时间内的胚胎发育信息。近年来,关于胚胎动力学的研究发现,早期胚胎发育过程中胚胎的细胞分裂时间点、细胞周期间隔时间和细胞分裂同步性,以及胚胎的直接分裂(AC)等都是关乎胚胎质量的重要参数[17-19]。本中心郑爱燕等[20]研究发现,在D3形态学评分优质的胚胎中,最终形成可用囊胚的胚胎和废弃胚胎的2细胞和5细胞分裂时间、2细胞发育到3细胞的时间(CC2)、3细胞发育成4细胞的时间(S2)均存在显著性差异(P<0.05),形成囊胚的D3优质胚胎和未形成囊胚的D3优质胚胎到达5细胞分裂时间分别为(46.4±8.0) h和(43.1±8.3) h。提示2细胞到5细胞这段时间是胚胎发育的关键时期,因此增加D2胚胎形态学观察可以给优选胚胎带来更多有价值的信息。本研究中D2胚胎观察时间点为受精后41~43 h,据此推测该时间点发育到4细胞的胚胎形成囊胚率高于发育到4细胞以上的胚胎;而D2胚胎细胞数不足4细胞时,说明胚胎发育缓慢,潜能不足。魏玉兰等[21]研究发现D2的2细胞和3细胞胚胎,其临床妊娠率均显著低于4细胞胚胎。可见D2胚胎发育过慢或者过快都会影响胚胎发育的能力,D2胚胎形态学评分是评估胚胎发育潜能的一个重要指标。因此,D2、D3连续胚胎评分能够提供胚胎发育过程中更多的胚胎发育信息,比单纯D3观察更有利于筛选最优质胚胎。
本研究中两个eSET组均无多胎妊娠发生,而D3观察DET组的多胎妊娠率高达42.37%。据文献报道双胎妊娠的剖宫产率高达75%[22]。剖宫产后由于疤痕处肌层纤维薄弱,孕囊可能植入其中生长,瘢痕子宫再次妊娠时容易发生前置胎盘、胎盘植入、子宫破裂、产后出血和早产等严重并发症[23-26]。随着生育政策调整和生育年龄延迟,选择生育多孩和高龄女性生育的情况越来越多,因此,为了母婴健康和社会效益,进行eSET以避免医源性多胎妊娠和高剖宫产率显得尤为必要。本研究的不足之处是观察的终点是临床妊娠率,后续将继续随访,收集活产率、早产率及围产期并发症等相关数据进行分析;本研究为回顾性分析,组间样本量差异较大,虽然采用了非参数秩和检验对观察指标评估的影响不大,但仍需扩大样本量后进行匹配性研究;另外,因本研究排除了获卵数少的患者,且只统计了此次取卵的首次移植周期结局,因此Logistic回归分析中各因素对临床妊娠率的影响并不明显。
综上所述,对于年龄<35岁、卵巢储备功能正常的患者进行D2、D3连续胚胎形态学观察后行卵裂期eSET是可行的优化移植策略,可获得较理想的临床妊娠率,降低多胎妊娠率;同时减少了因胚胎体外培养带来的潜在风险,有利于改善妊娠结局。

