PCOS患者冻融胚胎移植周期中三种内膜准备方案妊娠结局及围产期结局比较
孙婷,师赞,柏海燕,师娟子,刘珊
(西北妇女儿童医院生殖中心,西安 710003)
多囊卵巢综合征(PCOS)主要表现为生殖功能障碍及代谢功能紊乱,是导致育龄期女性不孕的最常见病因,国外患病率为8%~13%[1],我国报道为5%~10%[2]。由于PCOS的卵巢高反应性,这部分患者在ART治疗中是发生卵巢过度刺激综合征(OHSS)的高风险人群,目前的治疗更倾向于全胚冷冻策略。因此,在后续的冻融胚胎移植(FET)中,内膜准备方案的选择成为影响PCOS患者妊娠结局和围产期结局的重要因素。
由于排卵障碍,PCOS患者目前最常用的内膜准备方案是激素替代治疗(HRT)。HRT的优点是容易规划,方便患者,但同时可能与更高风险的副作用相关,如母体血栓和男性胎儿生殖道畸形的发生[3-4]。此外,一旦确定妊娠,外源性雌激素及孕激素需要一直应用至胎盘功能建立。更重要的是,部分PCOS患者外源性激素的用量对于适当的内膜准备可能是不足的[5]。除HRT外,临床工作中常用的内膜准备方案还包括促性腺激素释放激素激动剂降调节联合激素替代周期治疗(GnRH-a+HRT)及促排卵治疗。本研究通过对PCOS患者FET治疗的3种不同内膜准备方案的妊娠结局及围产期结局进行比较,以期为PCOS患者选择最佳的内膜准备方案提供可行性建议。
资料和方法
一、研究对象
对2019年1月至2020年12月在西北妇女儿童医院生殖中心进行FET治疗的PCOS患者临床资料进行回顾性分析。
纳入标准:PCOS患者新鲜周期取消移植、前次移植失败或前次移植后活产并有冻存胚胎而完成FET周期者。PCOS的诊断采用2003年鹿特丹标准[6],排除其他引起高雄激素血症的疾病后,以下3条符合其中2条即可:(1)稀发排卵或无排卵;(2)高雄激素临床表现和(或)高雄激素血症;(3)卵巢多囊样改变,即单侧或双侧卵巢中直径2~9 mm的卵泡≥12个。
排除标准:PCOS患者合并以下情况:(1)夫妻任何一方染色体异常;(2)输卵管积液;(3)子宫内膜异位症、子宫腺肌病;(4)存在宫腔粘连、子宫内膜息肉、子宫肌瘤、子宫畸形(单角子宫、纵隔子宫等)等因素;(5)卵巢囊肿;(6)行植入前遗传学诊断/植入前遗传学筛查(PGD/PGS)者。
本研究共纳入符合标准的928名PCOS患者的1 112个FET周期。根据内膜准备方案不同分为3组:A组(HRT方案,615个周期)、B组(GnRH-a+HRT方案,461个周期)、C组(促排卵方案,36个周期)。
二、诊疗回顾
1.内膜准备方案:(1)HRT方案:月经第3~5天给予戊酸雌二醇(补佳乐,拜耳,德国)2~6 mg/d或雌二醇凝胶(爱思妥,博赏,法国)2~4卡尺/d,用药8~14 d,期间根据内膜厚度调整用药;当内膜厚度≥8 mm时,予以黄体酮注射液(浙江仙琚制药)60 mg/d或黄体酮软胶囊(0.1 mg/粒,安琪坦,Besins,法国)0.6 mg/d转化内膜;应用黄体酮4 d后行冻融卵裂期胚胎移植,应用黄体酮6 d后行冻融囊胚期胚胎移植。(2)GnRH-a+HRT方案:月经第2~5天予以长效醋酸曲普瑞林(达菲林,益普生,法国)肌肉注射或长效醋酸亮丙瑞林(贝伊,珠海丽珠制药)皮下注射3.75 mg,30 d后口服戊酸雌二醇2~6 mg/d或雌二醇凝胶2~4卡尺/d,连续8~14 d,期间根据内膜厚度调整用药;内膜转化方案及胚胎移植时机同HRT方案。(3)促排卵方案:月经第3~5天口服来曲唑片(LE,芙瑞,浙江恒瑞医药)2.5 mg/d共5 d,5~7 d后B超监测,根据卵泡生长及内膜状况酌情添加人绝经期促性腺激素(HMG,珠海丽珠制药)75~150 U/d,期间根据内膜厚度及卵泡大小调整用药。卵泡直径达17 mm以上且内膜厚度≥8 mm时予以人绒毛膜促性腺激素(HCG,珠海丽珠制药)10 000 U肌肉注射。HCG次日B超监测是否排卵,如排卵则予以黄体酮软胶囊0.4 mg/d或黄体酮注射液40 mg/d转化内膜;如未排卵则HCG后第2天予以黄体酮软胶囊0.4 mg/d或黄体酮注射液40 mg/d转化内膜。应用黄体酮3 d后行冻融卵裂期胚胎移植,应用黄体酮5 d后行冻融囊胚期胚胎移植。
2.胚胎移植及黄体支持:全部胚胎均采用玻璃化冷冻。卵裂期胚胎于移植前18 h复苏,囊胚期胚胎于移植前3 h复苏。移植后予以黄体酮注射液40~60 mg/d肌肉注射或黄体酮阴道缓释凝胶(雪诺同,默克雪兰诺,德国)1支/d阴道置入或黄体酮软胶囊0.4~0.6 mg/d阴道置入。移植后继续黄体支持,确定妊娠后用至孕70 d。
3.妊娠的判断及随访:移植后12 d或14 d检测血清β-HCG,≥50 U/L为HCG阳性;移植后28~35 d早孕超声检查,见孕囊者为临床妊娠;异位妊娠为超声或手术或病理检查证实孕囊位于宫腔外者。记录分娩时新生儿出生孕周及出生体重,产后1年电话随访子代生长发育情况。活产为胎龄28周或以上活产婴儿的分娩;早产即28孕周<出生胎龄<37孕周;低出生体重即分娩时出生体重低于2 500 g。
三、分析指标
患者一般资料,包括年龄、体质量指数(BMI);内膜准备及胚胎移植情况,包括孕酮转化日内膜厚度、移植胚胎数、移植囊胚占比、移植优胚(包括优质囊胚和优质卵裂胚)占比及移植结局(胚胎种植率、HCG阳性率、临床妊娠率、流产率、活产率、异位妊娠率);单胎及双胎早产率、出生体重、出生孕周。
四、统计学分析

结 果
一、患者一般情况比较
共纳入1 112个FET周期,其中HRT方案准备内膜615个周期(A组)、GnRH-a+HRT方案461个周期(B组)、促排卵方案36个周期(C组)。3组患者间年龄、BMI、移植胚胎数、囊胚占比及优胚占比均无显著性差异(P>0.05)。B组及C组转化日内膜厚度显著高于A组(P<0.05)(表1)。

表1 患者一般情况比较[M(P25,P75),(-±s),%]
二、患者妊娠结局比较
三组患者间活产率、流产率、异位妊娠率均无统计学差异(P>0.05),C组的活产率有高于A、B组趋势。C组的胚胎种植率显著高于A、B组(P<0.05)。B组的HCG阳性率、临床妊娠率显著高于A组(P<0.05)。C组的HCG阳性率、临床妊娠率及活产率在3组中最高,但因样本量小,与其余两组比较无统计学差异(P>0.05)(表2)。

表2 患者妊娠结局比较(%)
三、患者子代围产期结局的比较
三组患者间单胎子代的早产率、出生体重及出生孕周均无显著性差异(P>0.05),但C组的早产率较A组和B组有降低趋势。本研究中3组的移植囊胚占比均为80%以上,且多数为单囊胚移植,双胎活产占比仅为10.62%(67/631),其中C组仅1周期为双胎。A组、B组间双胎子代的早产率、出生体重及出生孕周均无显著性差异(P>0.05),但均较各自的单胎子代早产率显著升高,出生体重显著下降,出生孕周显著缩短(P<0.01)(表3)。
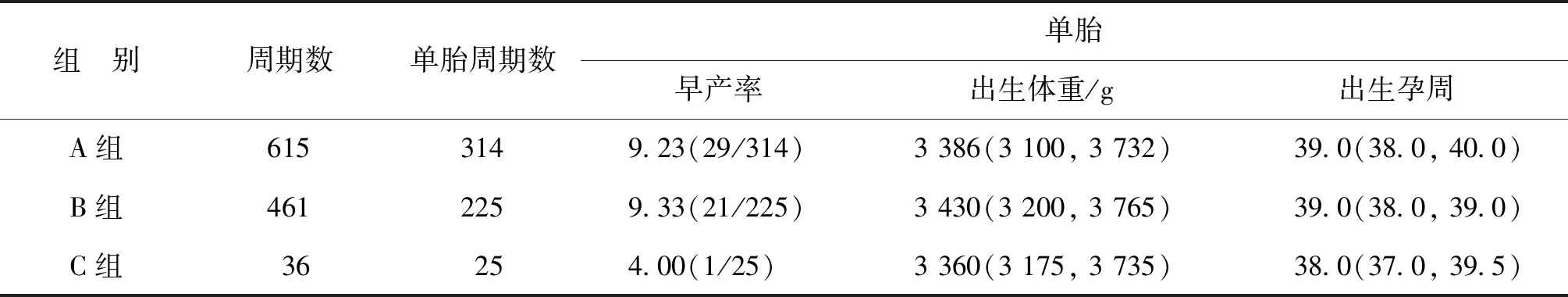
表3 患者子代出生体重及出生孕周的比较[M(P25,P75),%]

续表
讨 论
PCOS的治疗包括控制饮食、运动锻炼、减重、抗雄激素治疗及改善胰岛素抵抗等。对有生育需求者,促排卵治疗后多数可获得自然受孕,但仍有25%~30%需进行IVF-ET治疗[7],PCOS患者发生OHSS的几率高达20%~30%,其中重度OHSS达15%[8]。而IVF促排卵过程中多个卵泡所产生的超生理水平类固醇,会影响内分泌环境及胚胎种植窗,导致子宫内膜容受性降低,继而出现胚胎种植率及临床妊娠率下降。因此为了预防OHSS发生及改善妊娠结局,近年来PCOS患者的全胚冷冻策略获得了越来越多的关注,然而适合PCOS患者的最佳内膜准备方法尚未确定。
我们发现,PCOS患者应用GnRH-a+HRT方案的HCG阳性率、临床妊娠率显著高于HRT方案(P<0.05)。GnRH-a可以改善内膜容受性,避免自发排卵,从而降低周期取消率、增加妊娠率,并能更好地控制治疗周期及移植时间[9]。多项研究发现GnRH-a+HRT方案的胚胎着床率和临床妊娠率显著高于HRT方案[10-11]。我们已知,PCOS患者较高的黄体素生成素(LH)水平使得抗苗勒管激素与雄激素的分泌增加,而升高的雄激素与子宫内膜表面雌激素受体竞争性结合,进一步影响了子宫内膜的分泌与增生,损害子宫内膜容受性[12-14];PCOS患者应用GnRH-a预处理可有效降低LH水平,从而减少对子宫内膜容受性的不利影响。HRT方案由于缺乏GnRH-a对垂体的抑制最终会导致LH升高,升高的LH水平对胚胎的种植窗会产生消极影响[9]。
我们的数据表明3种方案的活产率、流产率、异位妊娠率不存在显著性差异(P>0.05),其中HRT方案与GnRH-a+HRT方案的活产率类似。而应用GnRH-a预处理会导致患者的治疗费用及周期时间显著增加[15]。2021年我中心的一项回顾性研究发现,与HRT方案比较,GnRH-a预处理并不能提高PCOS患者FET周期的活产率[16]。
值得注意的是,虽未达到统计学差异,但促排卵方案进行内膜准备的FET周期HCG阳性率、临床妊娠率、活产率方面均较HRT方案和GnRH-a+HRT方案有增高趋势,尤其是活产率的增幅超过15%。2019年一项来自中国的回顾性研究发现,在调整混杂因素后,PCOS患者FET周期中促排卵方案准备内膜的活产率显著高于HRT方案[17]。2021年Aslih等[18]通过比较PCOS女性FET周期应用来曲唑诱导排卵与HRT方案发现,来曲唑能显著提高临床妊娠率。来曲唑是第三代芳香化酶抑制剂,对雌激素受体无拮抗作用,是基于正常的中枢反馈诱导的单个卵泡发育,可以有效阻断雄激素向雌激素转化[19]。2019年Peigné等[20]的一项回顾性研究发现,在调整混杂因素后,促排卵方案的活产率显著高于HRT方案,该项研究提示PCOS患者的一线内膜准备方案可能是促排卵方案而非HRT方案,HRT方案存在潜在黄体缺陷的可能。与上述研究不同的是,一项2021年的Meta分析发现促排卵周期与HRT周期在活产率、持续妊娠率、临床妊娠率、胚胎种植率及流产率方面不存在显著差异,然而应用来曲唑促排卵方案的流产率较HRT周期有降低趋势[21]。当然,我们的研究中促排卵方案组数据量较小,未来还需要更大样本量及更严谨的前瞻随机对照研究,以进一步分析探讨。
我们发现促排卵方案的胚胎种植率显著高于GnRH-a+HRT方案和HRT方案,我们推测可能的原因如下:首先,来曲唑阻断了颗粒细胞中的雄激素向雌激素转化,以减少卵巢内和血清中雌激素水平[22],降低的雌激素水平可以减少雌激素受体的泛素化,上述过程可能导致更快的内膜增殖以及子宫和内膜血流的增加,从而对妊娠结局产生正面影响[23];其次,一些证据表明来曲唑能改善子宫内膜的容受性[17]。Miller等[24]认为子宫内膜整合素avβ3的低表达与IVF的不良预后相关,来曲唑联合小剂量HMG治疗可能通过增加整合素avβ3的表达以改善IVF预后。Ganesh等[25]提到,不明原因性不孕症女性应用来曲唑可使子宫内膜上皮和基质的容受性标志物显著增加,如整合素、白血病抑制因子和L选择素;来曲唑联合小剂量HMG应用可促使卵泡发育诱发排卵,促排卵过程中产生的雌孕激素可更接近于自然周期,更有利于胚胎着床。
与此同时,我们还发现GnRH-a+HRT方案及促排卵方案的转化日内膜厚度显著高于HRT方案(P<0.05)。长效GnRH-a的降调节作用使得子宫内膜表面雌激素受体的表达增加,对外源性雌激素的反应增强,最终促进了子宫内膜生长;而来曲唑联合小剂量HMG促排卵方案较人工周期方案的子宫内膜更厚,可能是由于来曲唑阻断雄激素向雌激素转化,降低雌激素水平[17],从而降低雌激素受体的泛素化,这一过程导致内膜增殖以及内膜的血流增加[23]。
我们的研究表明,A组、B组的双胎子代与单胎子代比较,早产率显著升高,出生体重显著下降,出生孕周显著缩短(P<0.01),单胎子代在早产率、出生体重、出生孕周方面均明显优于双胎。我们发现3组患者单胎子代的早产率、出生体重及出生孕周均不存在显著性差异(P>0.05),但促排卵方案的早产率较HRT方案和GnRH-a+HRT方案趋于更低。既往有多个研究将HRT方案FET与自然受孕女性进行比较,对其安全性以及对胎儿的影响进行研究,发现HRT周期的不良产科结局明显升高,包括围产期死亡率、早产及低出生体重等,并且一些研究发现HRT周期可能与极低出生体重儿和小于胎龄儿相关[26-27]。目前研究已表明双胎妊娠是导致子代围产期结局不良的重要因素[28]。因此,我们有理由推测,与GnRH-a+HRT方案和HRT方案比较,促排卵方案的围产期结局可能更优。
综上所述,PCOS患者FET周期治疗中,GnRH-a降调节联合HRT与HRT这两种方案的活产率相似,但长效GnRH-a因价格较高且治疗周期时间较长,加重了患者的经济负担;PCOS患者采用促排卵方案准备内膜,可能改善其妊娠结局和围产期结局。
本研究的局限性为研究方法是回顾性分析,且3组间病例数相差较大,今后尚需更大样本的前瞻随机对照研究来进一步探讨内膜准备方案对PCOS患者FET周期妊娠结局及围产期结局的影响。

