p66Shc对绵羊早期胚胎发育的影响
赵勇超 张通 王兆琛 刘春洁 张文广 张家新

摘要 [目的]探討p66Shc对绵羊早期胚胎发育的影响。[方法]以受精后28 h为节点,将早期胚胎分为早卵裂胚胎和晚卵裂胚胎,观察不同时期卵裂胚胎的进一步发育情况,同时通过实时荧光定量PCR检测不同来源的4-8细胞阶段胚胎中p66Shc基因的表达水平;利用siRNA分子干扰技术将特异性siRNA分子通过显微注射到绵羊合子细胞质中,以敲减早期胚胎p66Shc基因;通过免疫荧光技术检测p66Shc基因对绵羊早期胚胎发育过程中活性氧(ROS)和氧化应激标记物(8-OHdG)表达的影响。[结果]早卵裂胚胎的囊胚发育率显著高于晚卵裂胚胎(P<0.05);晚卵裂胚胎中p66Shc mRNA表达水平显著高于早卵裂胚胎(P<0.05);将绵羊早期胚胎中的p66Shc基因敲减后,与对照组相比,其胚胎内p66Shc mRNA水平、 p66Shc蛋白水平显著降低,ROS和8-OHdG水平显著低于对照组(P<0.05);基因敲减后桑椹胚发育率显著升高(P<0.05)。[结论]低水平的p66shc可以提高绵羊早期胚胎对氧化应激的抵抗力,并进一步提高其发育能力。
关键词 绵羊;p66Shc;早期胚胎;卵裂;氧化应激
中图分类号 S 826 文献标识码 A
文章编号 0517-6611(2021)20-0108-05
doi:10.3969/j.issn.0517-6611.2021.20.028
开放科学(资源服务)标识码(OSID):
Effects of p66Shc on the Early Embryo Development of Sheep
ZHAO Yong-chao ZHANG Tong WANG Zhao-chen1 et al (1.College of Animal Science,Inner Mongolia Agricultural University/Inner Mongolia Key Laboratory of Animal Genetics,Breeding and Reproduction,Hohhot,Inner Mongolia 010018; 2.College of Medicine,Shanxi Datong University,Datong,Shanxi 037009)
Abstract [Objective]To explore the effects of p66Shc on early embryo development of sheep.[Method] The early embryos were divided into early cleavage (EC) embryo and late cleavage(LC) embryo at 28 h after fertilization (28hpi).The further development of cleavage embryos at different stages were observed.At the same time,the expression level of p66Shc gene in 4-8 cell stage early embryos from different sources was detected by real-time quantitative PCR.Using siRNA molecular interference technology,specific siRNA molecules were microinjected into the cytoplasm of sheep zygotes,so as to knock down p66Shc gene of early embryos.The effects of p66Shc gene on reactive oxygen species (ROS) and oxidative stress marker (8-OHDG) during the early embryo development process of sheep were investigated by using immunofluorescence technique.[Result]The blastocyst development rate of EC embryos was significantly higher than that of LC embryos (P<0.05).The expression level of p66Shc mRNA in LC embryos was significantly higher than that in EC embryos (P<0.05).After knocking down p66Shc interference,p66Shc mRNA and protein levels in early sheep embryos were significantly decreased than those in control group(P<0.05),the expression levels of ROS and 8-OHdG in early sheep embryos were lower significantly than those in control group (P<0.05).Moreover,morula development rate was significantly increased (P<0.05)after knocking down p66Shc gene.[Conclusion]Low level of p66Shc could improve the resistance of early sheep embryos to oxidative stress and further improve their developmental ability.
Key words Sheep;p66Shc;Early embryo;Cleavage;Oxidative stress
基金项目
内蒙古自治区科技重大专项(2020ZD0003)。
作者简介 赵勇超(1995—),女,内蒙古赤峰人,硕士研究生,研究方向:家畜繁殖生物学与繁殖技术。*通信作者,教授,博士,博士生导师,从事家畜繁殖生物学与繁殖技术研究。
收稿日期 2021-01-19
近年来,绵羊体外胚胎生产(IVEP)被广泛关注,利用IVEP体系可以采集有生殖障碍、性成熟前、妊娠期、哺乳期及屠宰后的母羊卵巢卵母细胞用于生产,可以大幅提高优秀种质资源利用率、缩短世代间隔,对于绵羊的品种改良具有重要的应用价值。IVEP是包括多个步骤方法的操作体系,其中包括体外成熟(IVM)、体外受精(IVF)、受精卵体外培养(IVC),其中受精卵体外培养是对胚胎质量影响最大的阶段[1]。体外培养的胚胎容易受到环境氧化应激的影响[2]。在对牛早期胚胎的研究中发现,合子首次卵裂发生在受精后20~48 h,13.5%的早期胚胎发育停滞在2-4细胞期。然而,在受精28 h前卵裂的胚胎的发育停滞仅为0.6%,但受精28 h后卵裂的胚胎发育停滞率高达14%[3]。体外培养过程中胚胎过度产生ROS会超越胚胎抗氧化防御能力,触发细胞凋亡、坏死或永久性细 胞周期阻滞[4-5]。人体外胚胎培养中,培养基中第1天的ROS水平升高与胚胎发育延迟,囊胚破碎率及形态发育异常率升高相关,第3天在培养基中产生的ROS是囊胚发育的重要生化指标[6-7]。因此,体外胚胎发育能力低于体内胚胎很大程度与细胞内ROS水平异常升高有关[3]。利用低氧环境培养或补充抗氧化剂[8-9]的方式可以减少细胞内ROS的产生,从而改善囊胚发育能力。
p66Shc是衔接蛋白Shc1家族的成员,合子发育至囊胚阶段均有表达[10],在生长因子受体信号转导、ROS的产生和氧化磷酸化代谢中发挥作用[11]。对牛胚胎的研究发现,高氧环境会导致p66Shc的表达水平显著增加[12],而低氧环境或胚胎培养基中补充过氧化氢酶后p66Shc的表达水平显著降低[ 13-14]。降低未成熟牛卵母细胞的p66Shc水平可以显著降低其受精后的胚胎发育停滞的发生率[ 13]。这些结果表明p66Shc参与介导早期胚胎抗氧化应激,并影响了其进一步的发育。
为了确定p66Shc对绵羊早期胚胎发育的影响,笔者通过检测绵羊早期胚胎的卵裂模式及不同卵裂模式下p66Shc基因表达和线粒体活性,在此基础上研究p66Shc基因干扰后对绵羊胚胎细胞内ROS产生、DNA氧化应激损伤和胚胎发育潜能的影响,旨在为提高绵羊早期胚胎体外发育能力提供理論基础。
1 材料与方法
1.1 药品及试剂
TCM-199、DPBS、青链霉素合剂(PS)均购自 Gibco 公司;促卵泡生成素(FSH)、促黄体生成素(LH)购自 Bioniche 公司;雌二醇(E2)、胎牛血清(FBS)、 牛血清白蛋白(BSA)、透明质酸酶、聚乙烯醇(PVA)、半胱胺均购自 Sigma 公司;siRNA购自上海Gene Pharma公司;qRT-PCR引物购自上海生工公司;RNeasy Mini kit (Qiagen)微量样品总RNA提取试剂盒购自Qiagen公司;Reactive Oxygen Species Assay Kit购自Solarbio公司;SYBR Premix Ex Taq Ⅱ购自TaKaRa公司;p66Shc兔源一抗、8-OHdG兔源一抗和Alexa 488标记的山羊抗兔的二抗均购自Proteintech公司。
1.2 卵母细胞收集和体外成熟
将屠宰场收集的绵羊离体卵巢保存在37 ℃的灭菌生理盐水(含双抗)的保温瓶中,2~3 h内送回实验室。将卵巢用含青链霉素的灭菌生理盐水冲洗3次,用10 mL注射器抽取1~2 mL预热的采卵液(DPBS+1 mg/mL BSA+6 IU/mL肝素钠+1%PS),从卵巢表面抽取直径3~6 mm的卵泡内容物,挑选出胞质均匀且外周包裹有 3 层以上卵丘细胞的卵丘-卵母细胞复合体(COCs),将 COCs 用采卵液和成熟液[TCM-199+10% (V/V) FBS+10 μg/mL FSH +10 μg/mL LH+1 μg/mL E2+0.1 mmol/L CYS+1% PS]分别清洗2次后放入成熟液滴中,在38.6 ℃、5% CO 95%空气、饱和湿度条件下体外成熟培养24 h。
1.3 体外受精和体外培养
将绵羊细管冷冻精液在39 ℃水浴解冻约1 min,将解冻精液在1.5 mL的EP管中混合均匀,取300 μL轻轻加入装有已平衡2 h以上700 μL受精液(mSOFaa液+ 2%发情绵羊血清 + 6 IU/mL肝素钠)的试管底部,置于培养箱中孵育上游40 min。然后,将中间层的精液转移到1.5 mL EP管中,在1 300 r/min转速下4 min离心洗涤2次,弃掉上清液,然后加入适量受精液轻轻吹打混匀,调整精子密度约2×106个/mL后用于受精。在精子孵育上游的同时,使用0.1%透明质酸酶将成熟的卵母细胞外周的卵丘颗粒细胞部分吹打去除,并转移到受精液培养滴中。将混合均匀的精子悬液加入受精液培养滴内与卵母细胞共同培养20 h。
将假定的受精卵用移液器反复吹吸,去除黏附在透明带外周的颗粒细胞。将受精卵用发育液(mSOFaa液+BSA 3 mg/mL)洗涤3次后,按照试验设计,部分受精卵用于显微注射,部分受精卵转移到四孔培养板内继续培养。培养条件如下:5%CO2、5%O2、90%N2、38.6 ℃饱和湿度。受精后48 h统计卵裂率,受精后7 d统计囊胚率。
1.4 早期胚胎内源性p66Shc敲减
为了减弱内源性p66Shc mRNA,将p66Shc的siRNA显微注射到绵羊合子阶段的细胞质中。靶向p66Shc特异的CH2结构域的siRNA序列如下:正向序列为5′-GCAGUCAUGCUGGACUCAGTT-3′,反向序列为5′-CUGAGUCCAGCAUGACUGCTT-3′。在含有7.5 μg/mL CB(细胞松弛素B)的T2(2% FBS的TCM-199)培养液中借助显微注射系统将大约10 pL siRNA溶液(25 μmol/L)显微注射到合子阶段的胚胎细胞质中,同时未注射组、注射溶剂组(阴性对照组)作为对照,顯微注射结束后各处理组的受精卵用发育液洗涤3次后,转移到Nunc四孔培养板内继续培养。培养条件如下:5% CO2、5% O2、90% N2、38.6 ℃饱和湿度。
1.5 qRT-PCR
为了检测绵羊胚胎中p66Shc mRNA的表达丰度,受精后48 h收集4~8细胞阶段的绵羊胚胎。按照RNeasy Mini kit微量样品总RNA提取试剂盒说明书提取胚胎的总RNA并合成cDNA,并将所得cDNA置于-80 ℃下保存备用。根据GenBank查找绵羊的p66Shc序列和β-actin序列,利用Primer 5.0设计引物,引物序列见表1。以反转录得到的cDNA作为模板,以SYBR为荧光染料进行荧光定量PCR扩增,每组试验重复3次。以β-actin为内参,根据2-ΔΔCt法计算p66Shc的相对表达量。
1.6 免疫荧光分析
收集不同处理组的胚胎,将胚胎用500 nmol/L MitoTracker Red CMX Ros在室温下染色30 min。然后,用4%多聚甲醛将胚胎固定15 min,并用0.1%Triton X-100透化30 min。将透化之后的胚胎在5% BSA的PBS中室温下封闭1 h。用p66Shc特异性一抗(1∶100)染色,4 ℃下孵育过夜。将胚胎用含有0.1% PVA的PBS洗涤3次后,在室温下将胚胎用Alexa Fluor 488山羊抗兔免疫球蛋白G(IgG)二抗(1∶200)孵育1 h。用含有0.1% PVA的PBS洗涤3次后,用1 μg/ mL DAPI溶液将胚胎复染10 min。将染色的胚胎用激光共聚焦显微镜检测p66Shc(Ex 578 nm,Em 598 nm),MitoTracker Red(Ex 578 nm,Em 598 nm)和DAPI(Ex 359 nm,Em 461 nm)。每组试验重复3次,使用FV10-ASW 4.2 Viewer软件进行图像分析。
1.7 ROS 检测
收集不同处理组的胚胎,使用终浓度为10 μmol/mL的荧光染料DCFH-DA孵育绵羊胚胎30 min,使用激光共聚焦显微镜(Ex 480nm, Em 525 nm)检测荧光信号,每组试验重复3次,使用FV10-ASW 4.2 Viewer软件进行图像分析。
1.8 8-OHdG检测
羟脱氧鸟苷(8-OHdG)是敏感的DNA氧化应激损害标志物,收集不同处理组的胚胎,使用4%的多聚甲醛室温固定胚胎20 min,将固定的胚胎在0.1% Triton X-100的PBS中透化20 min,随后在含5%山羊血清的PBS中室温封闭1 h,将胚胎在8-OHdG兔源一抗(1∶100)中4 ℃孵育过夜。将洗涤后的胚胎转入二抗(Alexa Fluor标记的山羊抗兔)孵育30 min,用1 μg/mL DAPI染色15 min。将染色的胚胎转移到35 min的共聚焦皿中,在激光共聚焦显微镜检测8-OHdG(Ex 557 nm,Em 572 nm)。每组试验重复3次,使用FV10-ASW 4.2 Viewer软件进行图像分析。
1.9 数据统计与分析 试验数据均以平均值±标准差表示。使用SPSS软件(SPSS Inc.,Chicago,IL)的ANOVA分析差异显著性,然后进行Student-Newman-Keuls检验。P<0.05表示差异显著。
2 结果与分析
2.1 不同质量早期胚胎的p66Shc表达
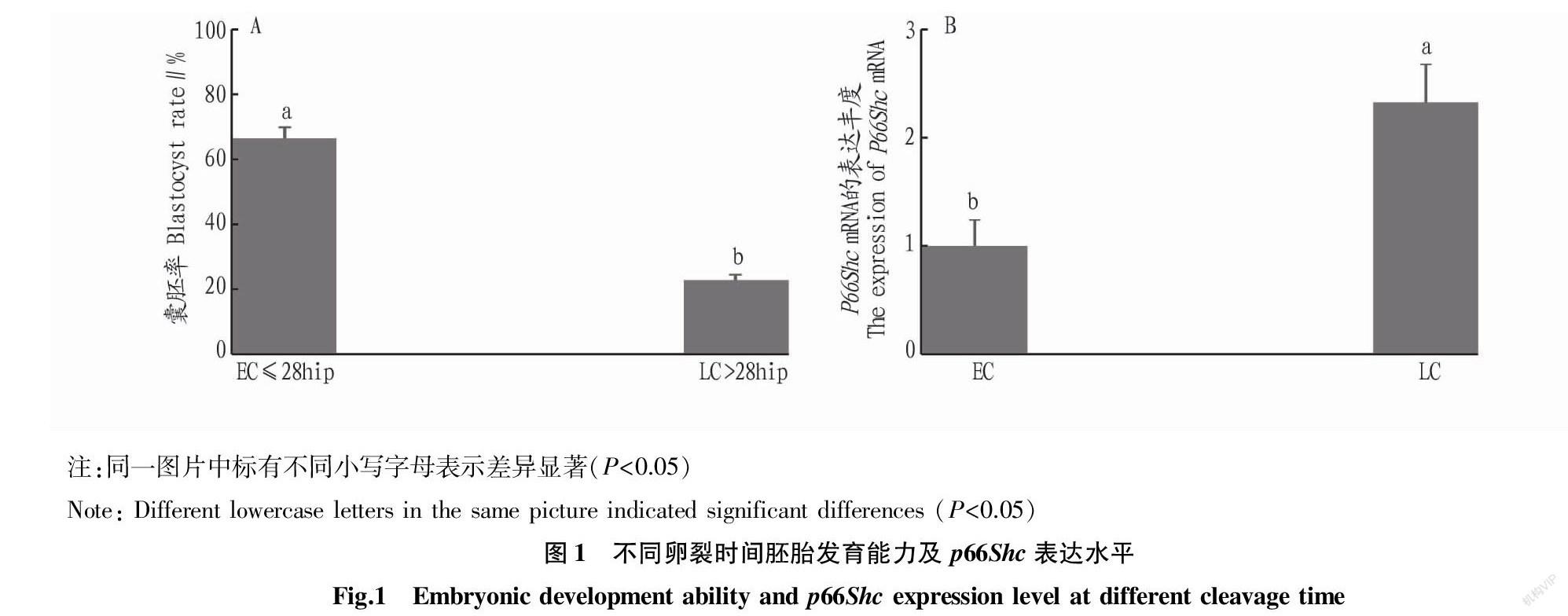
在受精后28 h统计胚胎的卵裂率。如图1A所示, 早卵裂(≤28hpi,early cleavage,EC)胚胎的囊胚形成率(66.67%)显著高于晚卵裂(>28hpi,late cleavage,LC)胚胎(22.93%,P<0.05)。qRT-PCR结果显示,LC胚胎的p66Shc mRNA水平显著高于EC胚胎(P<0.05)(图1B)。因此,绵羊早期胚胎的卵裂时间直接关系到后续胚胎的发育能力,且低质量的绵羊胚胎可能与p66Shc表达增加有关。
2.2 siRNA靶向干扰对早期胚胎p66Shc基因表达的影响
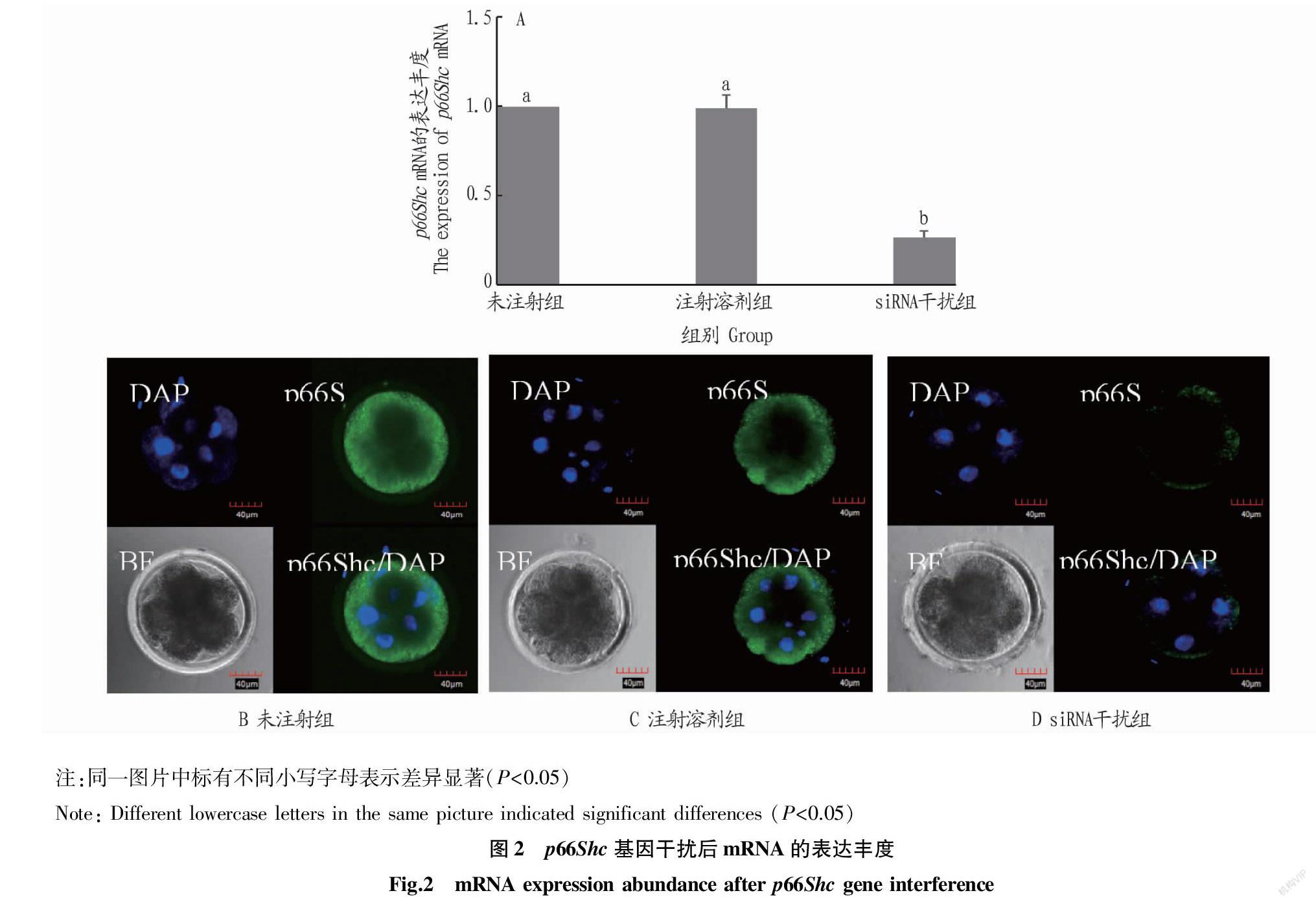
qRT-PCR和免疫荧光结果(图2)表明,siRNA干扰组p66Shc mRNA和蛋白水平在4-8细胞阶段显著低于未注射组、注射溶剂组(P<0.05),未注射组、注射溶剂组间没有显著差异(P>0.05)。
2.3 p66Shc基因干扰降低ROS的产生
利用DCFH-DA探针检测了敲除p66Shc基因对胚胎ROS的积累产生的影响。如图3所示,siRNA干扰组胚胎ROS的积累显著低于未注射组、注射溶剂组(P<0.05)。然而,未注射组和注射溶剂组之间没有显著差异(P>0.05)。
2.4 胚胎内p66Shc 基因干扰降低氧化应激标记物8-OHdG的产生 通过免疫荧光技术检测了干扰p66Shc基因对氧化应激标志物8-OHdG的水平产生的影响。如图4所示,显微注射siRNA干扰组8-OHdG的荧光强度在4-8 细胞阶段显著低于未注射组和注射溶剂组(P<0.05),而未注射组和注射溶剂组之间没有显著差异(P>0.05)。2.5 胚胎内p66Shc基因干扰提高绵羊胚胎的发育潜能
为了确定p66Shc基因干扰是否影响绵羊胚胎的发育潜能,统计了早期胚胎发育过程中的卵裂率、桑葚胚率和囊胚率,结果如表2所示。由表2可知,siRNA干扰组p66Shc基因后绵羊胚胎的卵裂率和囊胚率分别为63.00%和36.00%,与未注射组(分别为70.00%和34.00%)、注射溶剂组(分别为64.00%和33.45%)没有明显差异(P>0.05)。然而,siRNA干扰组的桑椹胚率(24.00%)显著高于其他组(未注射组13.56%,注射溶剂组13.08%,P<0.05)。
3 讨论
合子的第一次卵裂是哺乳动物胚胎质量和发育潜力的指标。该研究结果表明早期卵裂(≤28 h)胚胎的囊胚率显著高于晚卵裂(>28 h)胚胎,早卵裂胚胎的质量优于晚卵裂胚胎。这些结果表明,早卵裂胚胎比晚卵裂胚胎更有潜力发育至囊胚。近年来,有研究表明人类的早卵裂胚胎比晚卵裂胚胎囊胚率提高近30%,妊娠率提高20%以上[15-16]。因此,第一次卵裂分裂时间可以用作哺乳动物胚胎发育质量的内源性标志。
该试验研究了早卵裂胚胎和晚卵裂胚胎p66Shc基因的表达与线粒体的分布与活性。结果表明,与早卵裂胚胎相比,晚卵裂胚胎中的p66Shc mRNA表达丰度和蛋白质积累显著增加,这与牛早期胚胎的研究结果相似[3]。
RNA干扰技术是研究哺乳动物卵母细胞和早期胚胎中诱导序列特异性基因沉默的常用试验方法[17]。该研究中p66Shc特异性siRNA干扰分子被显微注射到绵羊受精卵合子阶段的细胞质中。p66Shc序列N-末端有一个额外的CH域,称为CH2結构域[1 18]。通过设计合成靶向绵羊p66Shc基因特异的CH2结构域的干扰分子。结果表明,与未注射组、注射溶剂组的胚胎相比, siRNA分子诱导胚胎中p66Shc mRNA和蛋白质的显著下调。
体外胚胎发育能力之所以不如体内胚胎,很大程度上与胚胎体外培养环境容易引起氧化应激有关。正常生理条件下,细胞内ROS水平处于平衡状态,而且适量ROS在多个信号通路中发挥着重要作用[19-20]。但是,当ROS代谢失衡就会引起氧化应激,进而影响胚胎的正常发育[21-22]。该研究中在绵羊合子阶段显微注射p66Shc siRNA导致胚胎细胞内p66Shc的mRNA和蛋白质水平显著降低,而且在胚胎随后的发育过程中,细胞的ROS水平降低,氧化应激标志物8-OHdG的减少。这也表明p66Shc在调节胚胎细胞内ROS水平发挥着重要作用,目前普遍认为p66Shc在介导线粒体ROS产生过程中起了关键作用[23]。
在胚胎体外发育过程中,发育阻滞的发生是影响胚胎发育能力的主要因素,不同动物胚胎的阻滞期也不同,绵羊发生于8-16细胞期[24]。该研究中显微注射p66Shc RNAi干扰分子组的桑椹胚率显著高于其他实验组,这表明早期绵羊胚胎内源p66Shc基因敲减后,胚胎通过阻滞期,并进一步发育为桑椹胚的能力提高。Betts等[14]通过向牛合子显微注射siRNA分子干扰p66Shc基因表达后,发现停滞在2-4细胞期胚胎比率明显降低。这表明早期胚胎内低水平的p66Shc有利于胚胎通过发育阻滞期,提高其进一步发育的能力。这种作用可能是低水平的p66Shc引起了胚胎抗氧化能力的提高,但本试验中RNAi干扰组的囊胚率与其他组之间没有显著差异。这可能是由于合子时期胞质显微注射干扰分子后改变了囊胚内细胞团中某些基因的转录[21],从而影响了囊腔的形成,其具体原因有待进一步研究。
4 结论
p66Shc参与了绵羊胚胎细胞内高水平ROS介导的氧化应激和氧化损伤,进而影响了胚胎体外发育潜力。
参考文献
[1] MONDAL S,MOR A,REDDY I J,et al.In vitro embryo production in sheep[J].Methods Mol Biol,2019,2006:131-140.
[2] 张通,栗瑞兰,范晓梅,等.p66Shc在绵羊卵母细胞中的表达及其与胞质氧化还原稳态的关系[J].中国农业科学,2019,52(12):2183-2192.
[3] FAVETTA L A,ROBERT C,ST JOHN E J,et al.p66shc,but not p53,is involved in early arrest of in vitro-produced bovine embryos[J].Mol Hum Reprod,2004,10(6):383-392.
[4] BETTS D H,MADAN P.Permanent embryo arrest: Molecular and cellular concepts [J].Mol Hum Reprod,2008,14(8):445-453.
[5] LOREN P,SNCHEZ R,ARIAS M E,et al.Melatonin scavenger properties against oxidative and nitrosative stress: Impact on gamete handling and in vitro embryo production in humans and other mammals[J].Int J Mol Sci,2017,18(6):1-17.
[6] LEE T H,LEE M S,LIU C H,et al.The association between microenvironmental reactive oxygen species and embryo development in assisted reproduction technology cycles[J]. Reprod Sci,201 19(7):725-732.
[7] BEDAIWY M A,MAHFOUZ R Z,GOLDBERG J M,et al.Relationship of reactive oxygen species levels in day 3 culture media to the outcome of in vitro fertilization/intracytoplasmic sperm injection cycles[J].Fertil Steril,2010,94(6):2037-2042.
[8] TRUONG T,GARDNER D K.Antioxidants improve IVF outcome and subsequent embryo development in the mouse[J].Hum Reprod,2017,32(12):2404-2413.
[9] TRUONG T T,SOH Y M,GARDNER D K.Antioxidants improve mouse preimplantation embryo development and viability[J].Hum Reprod,2016,31(7):1445-1454.
[10] EDWARDS N A,WATSON A J,BETTS D H.P66Shc,a key regulator of metabolism and mitochondrial ROS production,is dysregulated by mouse embryo culture[J].Mol Hum Reprod,2016,22(9):634-647.
[11] MIGLIACCIO E,GIORGIO M,MELE S,et al.The p66shc adaptor protein controls oxidative stress response and life span in mammals[J].Nature,1999,402(6759):309-313.
[12] FAVETTA L A,ST JOHN E J,KING W A,et al.High levels of p66shc and intracellular ROS in permanently arrested early embryos[J].Free Radic Biol Med,2007,42(8):1201-1210.
[13] FAVETTA L A,MADAN P,MASTROMONACO G F,et al.The oxidative stress adaptor p66Shc is required for permanent embryo arrest in vitro[J].BMC Dev Biol,2007,7(1):179-191.
[14] BETTS D H,BAIN N T,MADAN P.The p66Shc adaptor protein controls oxidative stress response in early bovine embryos[J].PLoS One,2014,9(1):1-18.
[15] FU J,WANG X J,WANG Y W,et al.The influence of early cleavage on embryo developmental potential and IVF/ICSI outcome[J].J Assist Reprod Genet,2009,26(8):437-441.
[16] 賈振伟.线粒体代谢功能对早期胚胎表观遗传组和发育的影响[J].中国细胞生物学学报,2020,42(4):733-740.
[17] 张美玲,郝鑫,周成杰,等.哺乳动物雌性生殖细胞及早期胚胎基因敲除或敲减的方法[J].生理学报, 2020,72(1):31-47.
[18] GERTZ M,STEEGBORN C.The Lifespan-regulator p66Shc in mitochondria:Redox enzyme or redox sensor?[J].Antioxid Redox Signal,2010,13(9):1417-1428.
[19] DUMBUYA H,HAFEZ S Y,OANCENA E.Cross talk between calcium and ROS regulate the UVA-induced melanin response in human melanocytes[J].FASEB J,2020,34(9):11605-11623.
[20] 邓龙生,卢太坤,陈进春,等.活性氧对精子功能影响研究进展[J].中国男科学杂志,2016,30(7):61-63,72.
[21] BHAT S S,ANAND D,KHANDAY F A.p66Shc as a switch in bringing about contrasting responses in cell growth:Implications on cell proliferation and apoptosis[J].Mol Cancer,2015,14(1):76-88.
[22] LIANG S,JIN Y X,YUAN B,et al.Melatonin enhances the developmental competence of porcine somatic cell nuclear transfer embryos by preventing DNA damage induced by oxidative stress[J].Sci Rep,2017,7(1):137-143.
[23] 顾闻,陈川.氧化应激下的p66Shc调控作用[J].中国生物化学与分子生物学报,2014,30(9):870-873.
[24] LI L,LU X K,DEAN J.The maternal to zygotic transition in mammals[J].Mol Aspects Med,2013,34(5):919-938.

