TLI筛选猪胚胎初次卵裂时间以预测早期胚胎发育
孙艳美,潘晓燕,曹诗雯,杨喆清,王立新
(吉林医药学院生殖医学中心,吉林 吉林 132013)
随着辅助生殖技术在临床广泛应用于治疗不孕不育症,一些母婴并发症的发生也越来越频繁[1-2]。由于在一个试管婴儿周期中通常会有几个胚胎产生,我国一般移植≥2枚胚胎以保证妊娠结局,这就导致我国近30年来多胎妊娠率高达30%~40%[3]。为避免多胎妊娠,实施单胚胎移植(single embryo transfer,SET)是目前生殖医学研究的重要方向,开展SET需要对发育周期内胚胎的发育状态进行全面的评估,挑选最具发育潜能的胚胎进行移植。传统的形态学评估无法全面评估胚胎发育潜能,缺少公认的量化指标,从而导致多胎妊娠等不良妊娠结局[4]。时差成像技术(time-lapse imaging,TLI)是非侵入性地评估胚胎在体外发育的手段,在临床体外受精过程中引入时差成像技术,可以在整个培养期间对胚胎培养微环境进行无干扰的监测,跟踪胚胎的发育过程,通过观察胚胎形态动力学和动力学参数来选择发育潜力最大的胚胎,有效的辅助单胚胎移植。
近年研究认为,受精胚胎早期卵裂是评估胚胎发育重要指标,有助于预测胚胎的发育潜能和植入能力[5-6]。由于猪与人具有相似的生理学特性,猪胚胎的体外生产已广泛应用于为畜牧业生产以及生物医学的研究,本研究以孤雌激活的猪胚胎为对象,通过TLI系统观察胚胎早期卵裂的情况,探讨初次卵裂时间对胚胎发育能力的影响,挑选出高质量的植入前胚胎,并阐明初次卵裂的影响机制,为临床辅助生殖技中实施SET的可行性提供理论和机制基础。
1 材料与方法
1.1 材 料
猪卵巢购自吉林市成祥屠宰场。
TCM-199、NaHCO3、NaCl、KCl、BSA、TBST、PBS、Hoechst33342、Tris均购自Sigma公司;HRP-Linked Antibody购自Abcam公司;SDS电泳液、ECL显色液均购自碧云天生物技术研究公司。
1.2 卵丘-卵母细胞复合体收集及体外成熟培养
用注射器从卵巢表面抽取2~6 mm卵泡的卵母细胞,在立体显微镜下捡出2层以上卵丘细胞的卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs)用于成熟培养。将符合要求的COCs挑选出,放入150 μL TCM-199微滴中,在38.5 ℃、100%湿度和5% CO2培养箱内培养44 h。
1.3 成熟猪卵母细胞的孤雌激活及体外胚胎培养
在0.1%透明质酸酶中吹打除去卵母细胞周围的颗粒细胞,在体视显微镜下挑选出具有第一极体的成熟卵母细胞,在5 μmol/L离子霉素中处理5 min后,在2.5 mmol/L二甲氨基嘌呤中孵育4 h,移到100 μL/滴的胚胎培养液中在38.5 ℃、100%湿度和5% CO2培养箱内培养。
1.4 Time-Lapse成像系统观察胚胎发育
将胚胎移入Time-Lapse成像系统的培养盒中,利用Time-Lapse成像软件连续拍摄胚胎的整个发育过程,确定其第一次卵裂的时间。有研究表明[7]猪卵母细胞孤雌激活后21 h已经开始了细胞的动力学变化,到48 h基本完成了二细胞分裂活动。以此为据,根据第一次卵裂速度的快慢将孤雌激活胚胎分为早期卵裂组(<24 h)、中期卵裂组(24~30 h)和晚期卵裂组(30~48 h)。胚胎分开培养并统计胚胎的桑葚胚率和囊胚率,以确定其对植入前胚胎发育率和发育质量的影响。
1.5 免疫荧光法检测凋亡相关蛋白
分别收集早期卵裂、中期卵裂、晚期卵裂组培养至囊胚期的胚胎,用PBS洗5min,洗3遍后,封闭液室温封闭1 h,然后分别用凋亡相关蛋白Bcl-2、Bax、P53的抗体4 ℃孵育过夜。第2天,弃去一抗孵育液,PBS洗3次,每次5 min。滴加荧光二抗避光湿盒中孵育1 h,每次5 min。滴加Hoechst33342避光染色5 min,PBS洗3次,每次5 min。封片液封片后共聚焦显微镜下立即观察。
1.6 Western-blot检测细胞周期蛋白
分别取早、中、晚期卵裂囊胚期胚胎,加入含1%PMSF的RIPA强裂解液提取蛋白。上样,电泳,将电压设置为80 V,约20 min样品通过浓缩胶进入分离胶,将电压调高到150 V,待溴酚兰跑到胶底部时终止电泳。300 mA转膜约45 min后,将转移后的膜放入15%(W/V)脱脂奶粉(15 g脱脂奶粉,100 mL TBST)中,室温摇床上缓慢摇动状态下封闭1h,最后PVDF膜用细胞周期蛋白B1(Cyclin B1)、细胞周期蛋白依赖激酶(Cyclin-dependent kinase1,Cdk)1、Cdk2的抗体孵育4 ℃过夜。次日,1×TBST室温轻摇洗涤PVDF膜3次(每次10 min),用HRP-抗体室温孵育PVDF膜1 h。最后,将显影液均匀覆在膜表面,Tanon 4600SF凝胶成像系统进行摄片。Image J软件对图片灰度值进行分析,最后对蛋白印迹结果作统计学分析。
1.7 统计学方法
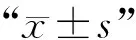
2 结 果
2.1 不同卵裂时间猪孤雌激活胚胎的桑葚胚率和囊胚率
孤雌激活,根据初次卵裂时间分为早、中、晚卵裂胚胎后,选出卵裂球形态均匀的2细胞胚胎进行体外培养,胚胎卵裂球大小均匀、透明带完整,形态符合胚胎的发育阶段被认为是正常发育的胚胎(图1)。结果表明,同一批孤雌激活猪卵母细胞,24 h内发生初次卵裂的胚胎数明显多于中期卵裂组和晚期卵裂组,早期卵裂组桑葚胚率、囊胚率明显高于中期卵裂组(P<0.05)和晚期卵裂组(P<0.01),中期卵裂组高于晚期卵裂组(表1),但差异不明显(P>0.05)。
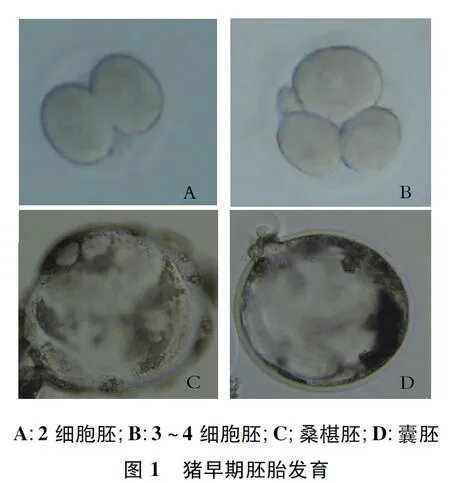

表 1 早、中、晚期卵裂猪孤雌激活胚胎的桑椹胚率和囊胚率
2.2 不同卵裂时间对囊胚中凋亡相关基因表达的影响
分别收集每个组发育的囊胚,免疫荧光法检测凋亡相关蛋白Bcl-2、Bax、P53的相对表达水平。结果显示(图2),早期卵裂组囊胚中凋亡基因Bax、P53表达显著低于中期和晚期卵裂组(P<0.01),而抗凋亡基因Bcl-2在早期卵裂组中的表达显著高于中期和晚期卵裂组(P<0.01),与中期和晚期卵裂组比较没有差异。

2.3 不同卵裂时间对囊胚蛋白表达的影响
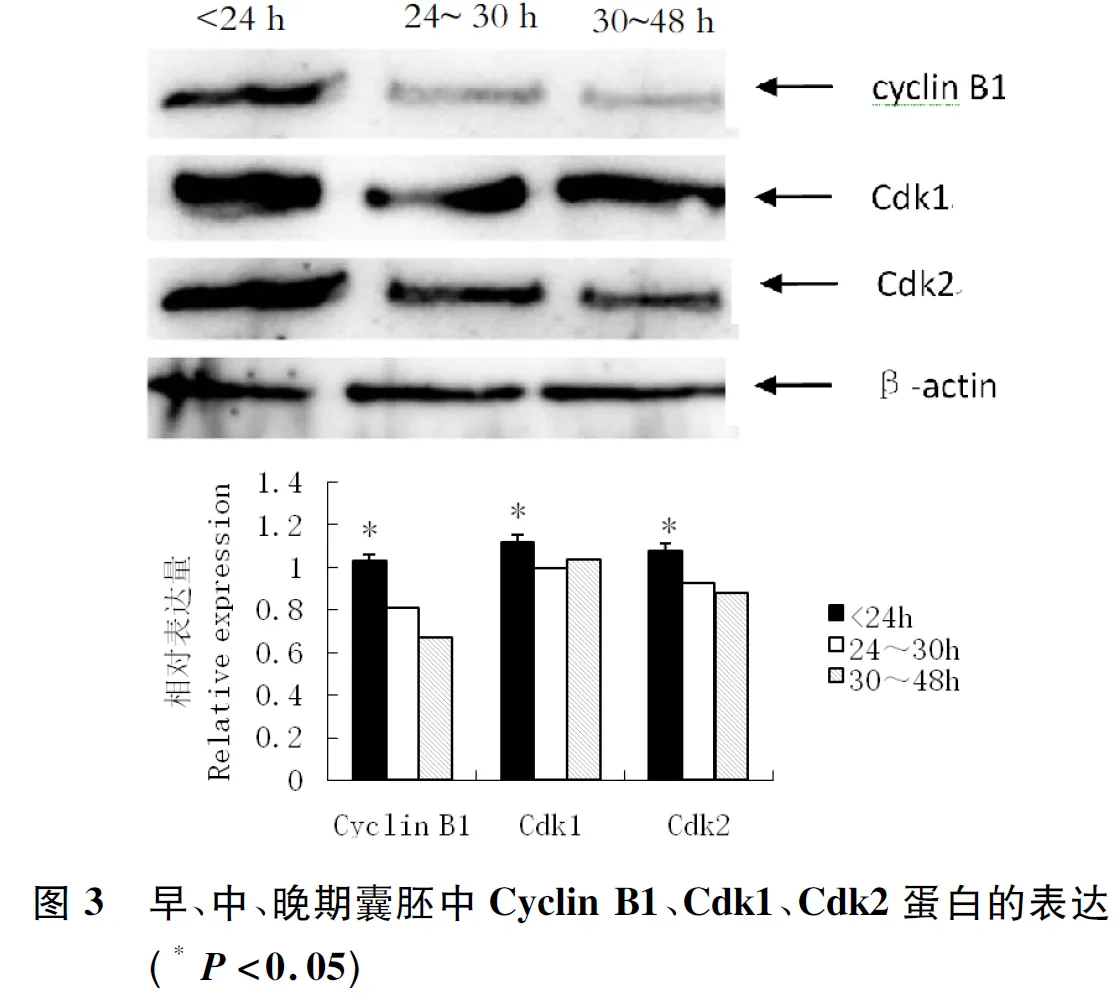
结果显示(图3),早期卵裂组囊胚Cyclin B1、Cdk1和Cdk2蛋白的表达明显高于中期和晚期卵裂组(P<0.05),中期与晚期相比差异不明显。
3 讨 论
体外繁殖技术(体外受精、体细胞核移植、孤雌生殖)中,人和牛的胚胎发育到囊胚的不到50%,猪胚胎体外囊胚发育率更低,只有20%~30%。与体内发育胚胎相比,体外繁殖技术胚胎的低发育率和胚胎质量低下是目前面临的主要挑战,着床前阶段的胚胎衰竭是在全世界范围内导致农业和科研生殖率低下的一个重要原因[8]。如何安全有效地筛选出最具发育潜能的胚胎是开展体外繁殖技术研究的重要方向。研究显示早期卵裂作为胚胎发育过程的重要环节,在预定时间段内发生卵裂的胚胎,其染色体异常率低,种植能力高,胚胎具有较高发育潜能和较好的种植能力,可以获得较好的妊娠结局[9],这些研究多集中在人和小鼠上,而且缺乏具体的机制研究。本研究以孤雌激活猪卵母细胞为研究对象,分析了早期卵裂、中期卵裂和晚期卵裂胚胎之间发育潜能的差异,发现相对早期发生卵裂的胚胎在体外培养过程中桑椹胚率和囊赔率更高,这一发现与以往早期卵裂与猪体细胞核移植胚胎发育相关性的研究相一致[10]。
通过对各组囊胚凋亡相关基因Bcl-2、Bax、P53进行检测发现,在早期卵裂组凋亡相关基因Bax、P53的表达水平显著低于中期和晚期卵裂组,而抗凋亡因子Bcl-2的表达更高,这表明早期卵裂组胚胎凋亡减少,胚胎的发育能力较高。Cyclin B1和Cdk作为细胞周期的重要调节因子参与细胞周期的调节,胚胎发育过程中必需Cyclin B1的参与,而胚胎早期分裂Cdk发挥重要的作用。在胚胎发育过程中Cyclin B1从细胞核转移到质膜上形成CyclinB1-Cdk1,以阻止细胞进行有丝分裂而过早成熟。在Cyclin B1缺失的情况下,DNA复制后细胞停滞在G2期的四细胞期[11]。在发育不全的卵母细胞和胚胎中,母体细胞Cyclin B1和Cdk2表达水平均降低[12]。通过抑制Cdk 2活性能够诱导胚胎DNA损伤,胚胎表现出延迟分裂并在囊胚期之前停止发育,所以Cdk 2通过直接或间接影响DNA修复相关基因的表达而发挥作用[13]。本研究结果表明,猪孤雌激活早期卵裂的胚胎囊胚中Cyclin B1、Cdk1 、Cdk2的表达水平更好,促使胚胎进入正常的有丝分裂,促进胚胎分裂和囊胚的形成,改善猪胚胎的早期发育。
胚胎发育过程是个复杂的、不断变换的过程,应用TLI观察胚胎的早期卵裂情况,确定早期卵裂的时间具有重要的意义。本次研究发现,孤雌激活猪卵母细胞初次卵裂较早的胚胎其发育潜能的更好,胚胎的桑椹胚率和囊胚率更高,能为辅助生殖技术选择单个优质囊胚提供依据,但对于临床妊娠结局的影响还有待于进一步研究。

