健脾促愈汤联合兰索拉唑片治疗脾胃湿热型慢性萎缩性胃炎的临床观察
武步涛,吴文凤
(河南省开封市第二中医院,河南 开封 475004)
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)以胃黏膜上皮和腺体萎缩、胃黏膜变薄或肠上皮化生为主要特征,临床表现为上腹部隐痛、胃灼热、食欲不振、大便异常等,常伴有胃出血、贫血、胃溃疡等并发症,严重影响患者的生活质量[1]。临床上经胃镜及实验室检查确诊为CAG的患者,在日常生活中须戒烟、忌酒,保持饮食规律,并在此基础上进行常规治疗,一般给予抑酸剂(如兰索拉唑片)口服治疗,但长期服用此药可能会导致肝功能损伤,也会引起头痛、嗜睡等不良反应,须及时调整用量。中医认为,CAG属于“胃痞”范畴,其病机为脾胃虚弱,日久成瘀或久病入络,益气健脾是治疗本病的关键。健脾促愈汤是我院自拟方剂,由黄芪、茯苓、党参等多味中药组成,具有健脾益胃的功效,临床常用于治疗胆汁反流性胃炎、溃疡性结肠炎等病。本研究主要探讨健脾促愈汤联合兰索拉唑片治疗CAG的临床疗效,现报道如下。
1 临床资料
1.1 一般资料 选取2020年2月至2021年3月开封市第二中医院收治的106例CAG患者,按照随机数字表法分为对照组和研究组,每组53例。对照组男28例,女25例;年龄36~70岁,平均(56.45±5.23)岁;病程2~15年,平均(9.29±3.15)年。研究组男29例,女24例;年龄35~70岁,平均(56.48±5.25)岁;病程1~16年,平均(9.53±3.36)年。两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究符合《赫尔辛基宣言》中相关伦理要求[2]。
1.2 诊断标准 ①西医诊断标准参考《全国慢性胃炎研讨会共识意见》中相关诊断标准:有不规则上腹痛、反酸、嗳气等症状,病理活检结果显示弥漫性胃黏膜表面黏液增多或固有腺体萎缩,即可诊断为CAG[3]。②中医诊断标准参考《慢性萎缩性胃炎中西医结合诊疗共识意见(2017年)》中脾胃湿热证的辨证标准:症见胃脘胀痛、灼热,嗳气频作,纳呆,肢体困重,大便溏薄,神疲乏力,尿黄,舌红,苔黄厚或腻,脉滑数[4]。
1.3 纳入标准 符合上述诊断标准;参与本研究前1个月内未接受其他相关治疗;无其他消化系统疾病;患者自愿参与本研究,并签署知情同意书。
1.4 排除标准 精神疾病者;伴有恶性肿瘤者;对本研究所用药物过敏者。
2 治疗方法
2.1 对照组 给予兰索拉唑片[重庆科瑞制药(集团)有限公司,国药准字H20066506,15 mg/片]口服治疗,每次30 mg,每日1次,治疗12周。
2.2 研究组 在对照组治疗基础上加用健脾促愈汤治疗,处方:黄芪、茯苓、党参片、半枝莲、莪术各15 g,法半夏、栀子各12 g,枳实、黄芩片、白术各10 g,甘草片6 g。随症加减:体内热盛者加白花蛇舌草、蒲公英各15 g;消化不良者加莱菔子、砂仁(后下)各15 g。每日1剂,加水煎至500 m L,分早晚两次服用,每次250 m L,治疗12周。
3 疗效观察
3.1 观察指标及疗效评定标准 ①胃黏膜病理评分。治疗前后对两组患者进行胃镜检查,对胃黏膜萎缩、肠上皮化生、异型增生进行打分,按照无、轻度、中度、重度分别计0、1、2、3分[5]。②中医证候积分。对两组患者治疗前后胃脘疼痛、胃中嘈杂、嗳气反酸、胀满、便溏、倦怠乏力进行评分,按照无、轻度、中度、重度分别计0、2、4、6分[6]。③胃泌素及胃动力检测。治疗前后分别采集两组患者空腹静脉血5 m L,分离血清(离心速率3 000 r/min,离心半径12 cm,离心时间10 min),采用放射免疫分析法检测血清胃泌素水平。采用胃镜检查胃窦收缩幅度(P)和胃窦收缩频率(F)。④炎症因子水平。采用放射免疫分析法检测血清中白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)、白细胞介素-17(IL-17)、白细胞介素-23(IL-23)水平。
3.2 统计学方法 采用SPSS 20.0统计软件分析数据。计量资料符合正态分布时以均数±标准差(±s)表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验;计数资料用百分率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
3.3 结果
(1)胃黏膜病理评分比较 治疗前,两组患者胃黏膜萎缩、肠上皮化生及异型增生评分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者胃黏膜萎缩、肠上皮化生及异型增生评分均较治疗前降低,且研究组均低于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组慢性萎缩性胃炎患者治疗前后胃黏膜病理评分比较(分,±s)
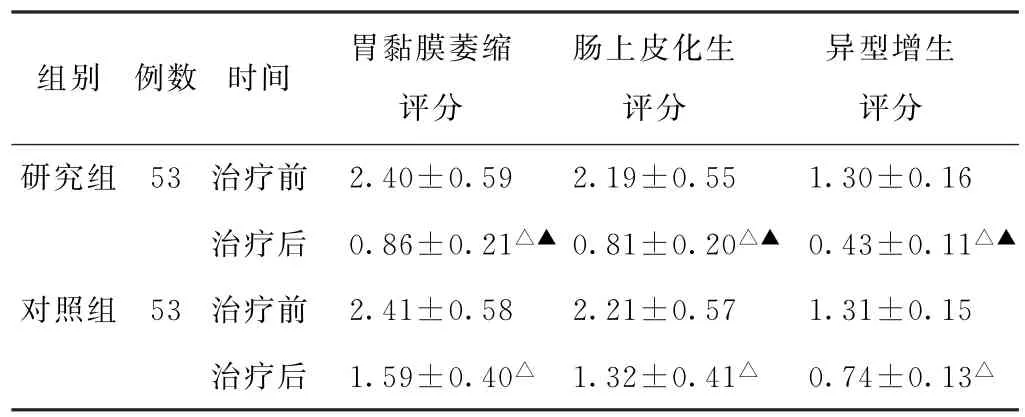
表1 两组慢性萎缩性胃炎患者治疗前后胃黏膜病理评分比较(分,±s)
注:与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
异型增生评分研究组 53 治疗前 2.40±0.59 2.19±0.55 1.30±0.16治疗后 0.86±0.21△▲0.81±0.20△▲ 0.43±0.11△▲对照组 53 治疗前 2.41±0.58 2.21±0.57 1.31±0.15治疗后 1.59±0.40△ 1.32±0.41△ 0.74±0.13△组别 例数 时间 胃黏膜萎缩评分肠上皮化生评分
(2)中医证候积分 治疗前,两组患者胃脘疼痛、胃中嘈杂、嗳气反酸、胀满、便溏、倦怠乏力积分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者胃脘疼痛、胃中嘈杂、嗳气反酸、胀满、便溏、倦怠乏力积分均较治疗前降低,且研究组上述6项积分均低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组慢性萎缩性胃炎患者治疗前后中医证候积分比较(分,±s)

表2 两组慢性萎缩性胃炎患者治疗前后中医证候积分比较(分,±s)
注:与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别 例数 时间 胃脘疼痛积分 胃中嘈杂积分 嗳气反酸积分研究组 53 治疗前 5.31±0.37 2.62±0.58 3.01±0.27治疗后 1.23±0.18△▲ 0.42±0.13△▲ 0.59±0.20△▲对照组 53 治疗前 5.28±0.34 2.59±0.61 3.02±0.35治疗后 2.01±10.89△ 1.46±0.17△ 1.52±0.26△组别 例数 时间 胀满积分 便溏积分 倦怠乏力积分研究组 53 治疗前 5.06±0.47 2.16±0.25 2.71±0.38治疗后 1.23±0.17△▲ 0.59±0.08△▲ 0.71±0.10△▲对照组 53 治疗前 5.03±0.52 2.19±0.21 2.73±0.41治疗后 2.14±0.28△ 1.38±0.16△ 1.54±0.18△
(3)胃泌素水平及胃动力指标比较 治疗前,两组患者胃泌素水平及胃动力指标比较,差异均无统计学意义(P>0.05)。治疗后,两组患者胃泌素水平及胃动力指标均较治疗前升高(P<0.05),且研究组胃泌素水平高于对照组(P<0.05);两组患者胃动力指标比较,差异均无统计学意义(P>0.05)。见表3。
表3 两组慢性萎缩性胃炎患者治疗前后胃泌素水平及胃动力指标比较(±s)

表3 两组慢性萎缩性胃炎患者治疗前后胃泌素水平及胃动力指标比较(±s)
注:1.与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。2.1 mm Hg≈0.133 kPa。
胃窦收缩频率(次/h)研究组 53 治疗前 113.73±19.15 20.71±12.12 46.23±15.18治疗后 136.36±23.35△▲ 51.14±15.24△ 69.32±16.77△对照组 53 治疗前 112.35±20.89 20.67±12.41 46.21±15.02治疗后 118.69±21.15△ 48.78±14.21△ 69.45±16.58△组别 例数 时间 胃泌素(pg/mL)胃窦收缩幅度(mm Hg)
(4)炎症因子水平比较 治疗前,两组患者IL-1β、IL-8、IL-17及IL-23水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-1β、IL-8、IL-17及IL-23水平均较治疗前降低,且研究组均低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组慢性萎缩性胃炎患者治疗前后炎症因子水平比较(±s)
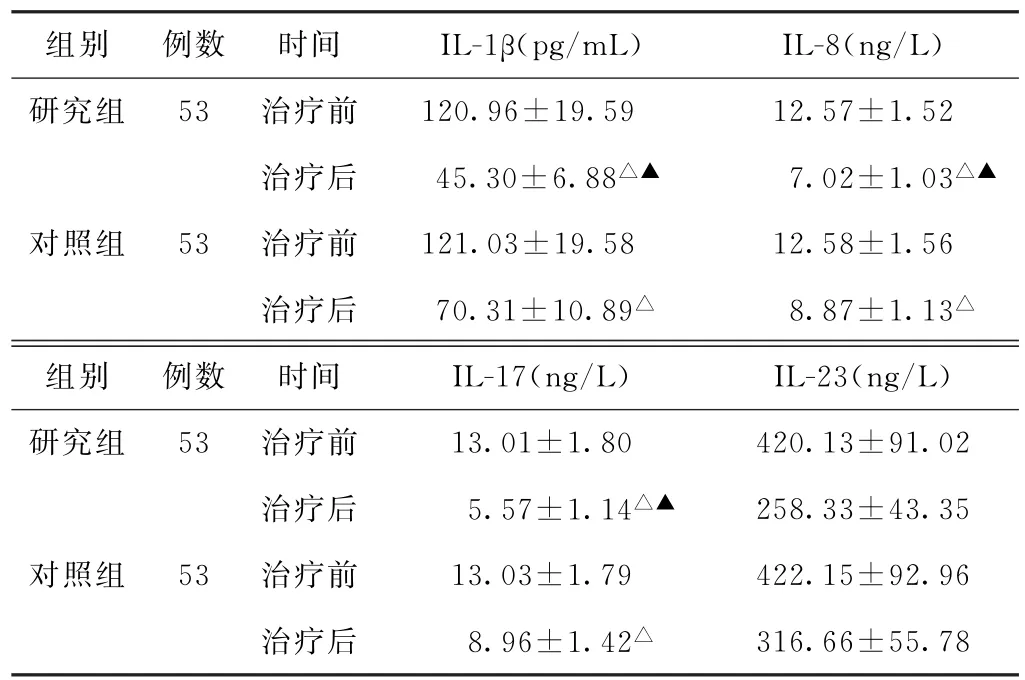
表4 两组慢性萎缩性胃炎患者治疗前后炎症因子水平比较(±s)
注:1.IL-1β,白细胞介素-1β;IL-8,白细胞介素-8;IL-17,白细胞介素-17;IL-23,白细胞介素-23。2.与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别 例数 时间 IL-1β(pg/m L) IL-8(ng/L)研究组 53 治疗前 120.96±19.59 12.57±1.52治疗后 45.30±6.88△▲ 7.02±1.03△▲对照组 53 治疗前 121.03±19.58 12.58±1.56治疗后 70.31±10.89△ 8.87±1.13△组别 例数 时间 IL-17(ng/L) IL-23(ng/L)研究组 53 治疗前 13.01±1.80 420.13±91.02治疗后 5.57±1.14△▲ 258.33±43.35对照组 53 治疗前 13.03±1.79 422.15±92.96治疗后 8.96±1.42△ 316.66±55.78
4 讨论
CAG是由Hp感染、饮食因素、幽门括约肌功能不全等引起,好发于中老年人群,随着病程延长,胃部固有腺体逐渐发生萎缩,最终丧失分泌能力。因此,CAG患者若不及时接受治疗,可进一步出现胃上皮或化生的肠上皮再生,导致胃癌发生。目前临床治疗CAG常以促进胃动力、抑酸等对症治疗为主,能促进胃黏膜修复,需长期用药,虽能改善病情,但长期服药存在不良反应,患者的整体预后不理想[7]。
中医认为,CAG是由于患者饮食不节、情志不畅、劳累过度等引起,脾胃虚弱是发病之本,胃络瘀阻是重要病机,邪毒久滞、毒损胃络是重要的病机转归,基本治法为健脾益胃、调畅气机,兼祛瘀通络。健脾促愈汤中,黄芪、白术益气健脾,为君药;茯苓、党参健脾利湿,莪术破气行血止痛,为臣药;法半夏、枳实、黄芩、栀子、半枝莲散瘀通络,燥湿化痰,为佐药;甘草益气和中,调和药性,为佐药;加用白花蛇舌草、蒲公英清热解毒,消肿散结;莱菔子、砂仁消食除胀,化湿开胃。诸药合用,有健脾益气、滋养脾胃、化湿祛瘀之功。药理研究表明,白术含有苍术醇、白术酮及维生素A等成分,可明显拮抗乙酰胆碱引起的肠痉挛,通过对抗胆碱作用抑制因胃酸分泌引起的胃黏膜损伤,促进胃黏膜细胞增殖,刺激胃蛋白酶分泌[8]。砂仁中的有效成分一方面可兴奋神经递质,促进胃液分泌,增加胃肠蠕动,另一方面又可减少胃酸分泌,对应激性溃疡具有明显的抑制作用[9]。党参中的提取物能通过增加胃、十二指肠黏膜组织中生长抑素的含量,提高前列腺素含量,拮抗胃泌素分泌胃酸的作用,刺激胃黏膜合成并释放表皮生长因子,达到保护胃黏膜的目的[10]。
本研究结果显示,研究组治疗后的胃黏膜萎缩、肠上皮化生、异型增生评分及中医证候积分均低于对照组(P<0.05),胃泌素水平高于对照组(P<0.05),说明健脾促愈汤辅助治疗CAG可改善患者的临床症状,调节胃泌素分泌。CAG的病理进展与炎症因子的长期刺激存在密切联系,其中IL-1β是由单核细胞和巨噬细胞产生,正常人血液中不含IL-1β或含量很低,其含量升高表明机体存在组织损伤或感染。IL-8升高常见于感染、创伤及自身免疫性疾病等,其生物学活性为吸引和激活中性粒细胞,中性粒细胞与IL-8接触可导致机体局部发生炎性反应。IL-17是T细胞诱导炎性反应的早期启动因子,可与肿瘤坏死因子-α、IL-1β相互作用,共同产生协同效应介导中性粒细胞与单核细胞在炎症部位聚集。IL-23主要由树突状细胞、单核细胞及巨噬细胞分泌,能通过刺激机体巨噬细胞分泌IL-17,使机体增强抵抗感染的能力,CAG中的Hp感染通常引起巨噬细胞及树突状细胞分泌IL-23增加,与IL-17协同在CAG患者Hp感染的免疫反应中发挥作用,其水平升高可提示炎性反应加剧,病情加重[11-12]。药理研究表明,黄芪具有双向调节人体免疫力的作用,黄芪中的黄芪甲苷可减少细胞外炎症细胞浸润,抑制促炎细胞因子合成和分泌[13]。党参可调节人体的免疫平衡,其中党参甲醇提取物能有效调节巨噬细胞的免疫反应,增强抗炎作用,而党参中的多糖能调节T细胞循环,增强巨噬细胞的吞噬能力,抑制炎症因子产生[14]。本研究结果显示,研究组治疗后的IL-1β、IL-8、IL-17、IL-23水平均低于对照组(P<0.05),说明健脾促愈汤辅助治疗CAG可有效降低炎症因子水平,与王丹等[15]研究结果基本一致。
综上所述,健脾促愈汤联合兰索拉唑片治疗脾胃湿热型CAG可有效改善胃黏膜病理评分和中医证候积分,促进胃泌素分泌,增强胃动力,降低炎症因子水平,可在临床推广。然而本研究样本量较少,后续应扩大样本量进行更深入的研究。

