基于PPAR-γ/NF-κB信号通路探究芍甘附子汤对胶原诱导性关节炎大鼠的干预作用及作用机制
董琳琳,丰晨然,赵一颖,石璐,吴师月,靖卫霞,贾占红,孙文燕*(.北京中医药大学中药学院,北京 0488;.北京中医药大学第三附属医院,北京 0009)
类风湿关节炎(rheumatoid arthritis,RA)是一种渐进性自身免疫性疾病,其特征在于关节滑膜慢性炎性细胞浸润,滑膜细胞增殖与凋亡异常及关节软骨与骨损害。RA 致残率较高,还易导致其他并发症,使得临床患者的治疗愈加困难[1]。RA 属中医“痹证”范畴,中医药在治疗“痹证”方面积累了丰富的经验。芍甘附子汤源于《伤寒论》,由芍药、炙甘草、附子组成,临床上运用该方或以该方为基础进行加减治疗RA 疗效确切,但尚缺乏系统的药效学及作用机制研究[2]。
NF-κB 信号通路是经典的炎症通路,该通路激活后可促进肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素-6(IL-6)、一氧化氮合酶(iNOS)、环氧合酶(COX-2)等炎性因子的转录,还可调节T、B 细胞的分化,促进RA 的发生发展[3]。PPAR-γ是一种重要的抗炎转录因子,其抗炎作用可能与抑制核因子κB(NF-κB)的活化有关[4]。网络药理学分析表明芍甘附子汤对RA 的干预作用可能与PPAR-γ/NF-κB 信号通路有关[5]。本研究在前期实验基础上,观察芍甘附子汤对胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠的干预作用并基于PPAR-γ/NF-κB 信号通路探讨其作用机制。
1 材料
1.1 动物
SPF 级Wistar 大鼠102 只, 体质量180 ~190 g,雄性[北京斯贝福生物技术有限公司,许可证号为SCXK(京)2016-0002]。
1.2 试药
芍甘附子汤配方颗粒(黑顺片3 g、白芍9 g、甘草9 g,北京中医药大学东方医院,由北京康仁堂药业制备)。给药时以生理盐水充分溶解,按照人日用量换算大鼠的等效剂量为2.1 g 生药·kg-1。雷公藤多苷片(得恩德制药股份有限公司,批号为2004114B,给药质量浓度为0.9 mg·mL-1)。
牛Ⅱ型胶原(美国Chondrex 公司);不完全弗氏佐剂(美国Sigma 公司);前列腺素E2(PGE2)试剂盒(北京华英生物技术研究所);一氧化氮(NO)试剂盒(南京建成生物工程研究所);大鼠TNF-α、IL-1β、IL-6 ELISA 试剂盒(北京瑞格博科技发展有限公司);鼠单抗PPAR-γ抗体、兔多抗NF-KB p65 抗体、兔多抗COX-2 抗体、兔单抗iNOS 抗体(英国Abcam 公司);兔单抗p-NF-κB p65 抗体(中国HUABIO 公司)。
1.3 仪器
YLS-7B 大鼠足跖容积测量仪(济南益延科技发展有限公司);TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);华卫德朗DR-200BS 酶标分析仪(无锡华卫德朗仪器有限公司);Thermo Multiskan MK3 酶标仪(美国Thermo 公司);DKZ-2B 恒温振荡水槽(上海一恒科学仪器有限公司);Tissue-TEK VIP6 生物组织脱水机、Tissue-TEK TEC 生物组织包埋机(日本樱花公司);Leica RM2235 组织切片机、Leica HI1210 捞片仪、Leica HI1220 烤片仪、Leica ST5020 自动染色机、Leica CV5030 自动封片仪、Olympus Bx53 显微镜、Path QC 病理质控和资料管理系统(德国莱卡公司)。
2 方法与结果
2.1 模型复制[6]
102 只Wistar 大鼠于实验前适应性饲养7 d。随机选取12 只,并将其作为正常组,其余90 只用于CIA 大鼠模型制作。实验第1日将牛Ⅱ型胶原与不完全弗氏佐剂充分等量混合,手持匀浆器充分乳化。准确抽取0.2 mL 乳化剂在大鼠的尾根部进行多点皮内注射。实验第7日再次进行免疫,乳化剂用量为0.1 mL。正常组采用等量的生理盐水进行皮内注射。实验第14日对造模大鼠进行关节炎指数(arthritis index,AI)评分[6],评分≥4 分为模型复制成功,造模成功率为83.33%(75 只)。
2.2 分组及给药
按照AI 评分结果,依据分层分配法进行分组:CIA 模型组,芍甘附子汤低剂量组(1.05 g·kg-1),芍甘附子汤中剂量组(2.1 g·kg-1),芍甘附子汤高剂量组(4.2 g·kg-1)以及雷公藤多苷片组(9 mg·kg-1),每组15 只。各组按照剂量灌胃,每日1 次,连续28 d。正常组及CIA模型组灌胃等量生理盐水。
2.3 关节炎指数评分
于实验第14、21、28、35、42日对模型组、芍甘附子汤组及雷公藤多苷片组大鼠进行AI 评分。
2.4 实验标本采集
于末次给药24 h 后,用1.5%戊巴比妥钠溶液腹腔注射麻醉大鼠,腹主动脉取血,4℃,4000 r·min-1,离心10 min,收集血清。取大鼠双侧踝关节,以4%多聚甲醛溶液中固定。
2.5 踝关节病理学及影像学观察
每组随机选取6 只大鼠踝关节脱钙,常规脱水处理并石蜡包埋,制片,常规HE 染色,于光学显微镜下观察病理变化,并根据滑膜上皮细胞、滑膜间质细胞及滑膜软骨组织病变程度进行踝关节病变评分。各组另取踝关节置于Inveon MM GANTRY 扫描仪上进行扫描。扫描仪设置参数为:分辨率48 μm,曝光时间800 ms,电压80 kV,电流400 mA,图像矩阵为4032×4032。扫描结束后,使用Inveon Research Workplace 分析软件进行各组大鼠的踝关节三维重建和分析。
2.6 血清PGE2、TNF-α、IL-1β、IL-6、NO 含量测定
取各组大鼠血清,采用ELISA 法检测血清中PGE2、TNF-α、IL-1β、IL-6 的含量,采用比色法检测血清中NO 的含量。
2.7 免疫组化法检测踝关节组织中PPAR-γ、NFκB p65、p-NF-κB p65、COX-2、iNOS 的表达
各组大鼠切片进行免疫组织化学染色,采用PBS 液代替一抗作阴性对照,细胞胞浆内出现棕黄色或棕褐色颗粒为阳性细胞,观察整张切片,使用Image-pro Plus 软件测量图片积分光密度值(IOD)。高倍镜下拍摄三个视野,将采集的图像应用Image-pro Plus 5.1 图像分析系统进行分析,所得数据作免疫组织化学染色阳性信号IOD,以IOD 值作为组织表达的定量标准,IOD =平均光密度(AOD)×阳性面积(A)。
2.8 统计方法
实验数据以均数±标准差表示(x±s),采用SAS 9.2 软件进行统计分析。若各组数据呈正态分布且方差齐,采用单因素方差分析,两组比较采用q检验;若数据不服从正态分布或方差不齐则采用非参数性检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 芍甘附子汤对CIA 大鼠关节炎指数的影响
在初次免疫后第14 ~35日,CIA 模型组大鼠AI 评分逐渐升高,第42日略有降低;相较于模型组,芍甘附子汤各剂量组及雷公藤多苷片组在给药2 周后(初次免疫后第28 ~42日)AI 评分均明显降低(P<0.05 或0.01)。结果见表1。

表1 芍甘附子汤对CIA 大鼠关节炎指数评分的影响(x±s,n =12 ~15)Tab 1 Effect of Shaogan Fuzi decoction on the AI score of CIA rats (x ±s,n =12 ~15)
3.2 芍甘附子汤对CIA 大鼠血清PGE2、NO、TNF-α、IL-1β、IL-6 含量的影响
与正常组比较,模型组血清中PGE2、NO、TNF-α、IL-1β、IL-6 含量升高(P<0.01)。与模型组比较,芍甘附子汤各剂量组PGE2含量,芍甘附子汤低剂量组与雷公藤多苷片组NO,芍甘附子汤低、中剂量组TNF-α、IL-1β、IL-6 含量及雷公藤多苷片组TNF-α含量均明显降低(P<0.05或P<0.01)。结果见表2。
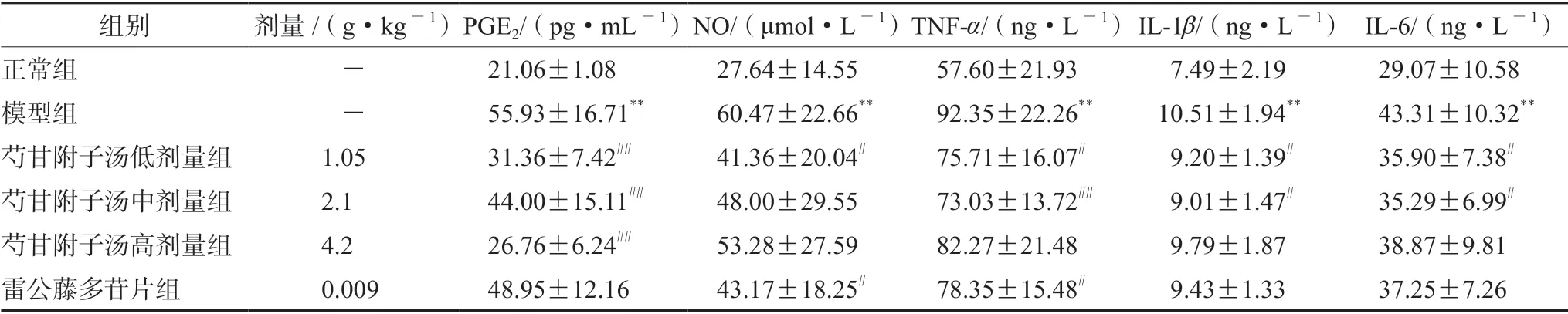
表2 芍甘附子汤对CIA 大鼠血清PGE2、TNF-α、IL-1β、IL-6、NO 含量的影响(x±s,n =12 ~15)Tab 2 Effect of Shaogan Fuzi decoction on the content of PGE2,TNF-α,IL-1β,IL-6,and NO in the serum of CIA rats (x ±s,n =12 ~15)
3.3 芍甘附子汤对CIA 大鼠踝关节病理学的影响
正常组中滑膜大多内衬单层上皮,个别两三层,细胞排列规则,滑膜内纤维间质排列疏松,无炎性细胞浸润;血管数量少,排列稀疏,为闭锁状态;软骨平滑光整,细胞数量正常,潮线完整。
模型组中滑膜内衬细胞层次增加,呈绒毛状、乳头状肥大,滑膜内可见淋巴细胞、浆细胞、中性粒细胞以及巨噬细胞等炎性细胞浸润,间质纤维组织增生;滑膜血管增生、扩张,血管壁周围炎性细胞浸润;软骨表面出现裂痕,细胞数量减少,潮线断裂现象明显。与正常组比较,模型组HE 病理评分显著升高(P<0.01)。
芍甘附子汤低、中剂量组中滑膜内衬细胞层次较模型组减少,呈绒毛或乳头状,滑膜内炎性细胞数目轻度减少,间质纤维组织增生;滑膜血管增生,少量扩张,血管壁周围中等量炎性细胞浸润;软骨表面不光滑,细胞变性,数量轻度减少,潮线模糊。芍甘附子汤高剂量组中滑膜内衬细胞约为3 ~5 层,呈微小绒毛状,滑膜内炎性细胞数目明显减少,间质纤维组织轻度增生;滑膜血管轻度增生,偶见扩张,血管壁周围少量炎性细胞浸润;软骨表面不光滑,细胞数量轻度减少,潮线较清晰,有不延续现象。与模型组比较,芍甘附子汤中、高剂量组HE病理评分显著降低(P<0.05 或0.01)。
雷公藤多苷片组中滑膜内衬细胞层次较模型组减少,呈小绒毛状,滑膜内炎性细胞数目减少,间质纤维组织轻度增生;滑膜血管数目减少,血管壁周围少量炎性细胞浸润;软骨表面不光滑,细胞数量轻度减少,潮线较为模糊。与模型组比较,雷公藤多苷片组HE 病理评分显著降低(P<0.05)。结果见表3 及图1。
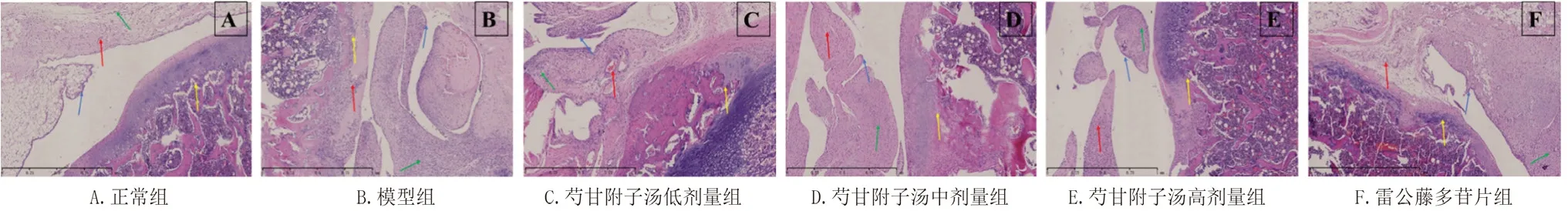
图1 芍甘附子汤对CIA 模型大鼠踝关节病理变化的影响(HE,×50,n =6)Fig 1 Effect of Shaogan Fuzi decoction on the ankle joint pathological changes of CIA model rats(HE,×50,n =6)
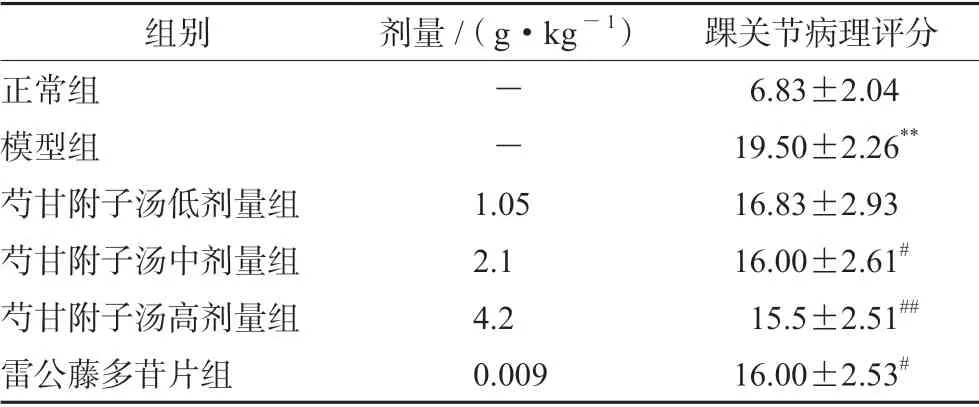
表3 芍甘附子汤对CIA 大鼠踝关节病理评分的影响(x±s,n =6)Tab 3 Effect of Shaogan Fuzi decoction on the pathological score of ankle joint in CIA rats (x±s,n =6)
3.4 芍甘附子汤对CIA 大鼠踝关节影像学的影响
踝关节Micro CT 扫描发现,正常组大鼠未出现关节肿胀情况,皮质骨光滑完整,骨态正常,骨质均匀。模型组大鼠踝关节中重度肿胀,皮质骨侵蚀破坏严重,出现骨质疏松,关节面缺失,出现大量滑膜增生情况;趾关节肿胀严重甚至变形,关节面缺失与大量增生,关节之间的间隙有所变窄。芍甘附子汤低剂量组踝关节轻中度肿胀,皮质骨见轻度不规则侵蚀破坏现象,关节间隙出现轻度变窄。芍甘附子汤中剂量组踝关节皮质骨轻度侵蚀,表面轻度增生,关节之间的间隙变窄,胫骨远端松质骨轻度疏松。芍甘附子汤高剂量组踝关节轻度肿胀,表面少量增生,关节轻度肿胀,关节之间的间隙轻度变窄,胫骨远端松质骨轻度疏松。雷公藤多苷片组胫骨关节面出现轻度破坏,踝关节皮质骨轻度破坏,边缘毛刺,有少量增生,关节轻度肿胀,关节之间的间隙出现变窄现象(见图2)。

图2 芍甘附子汤对CIA 模型大鼠踝关节影像学的影响(CT 扫描,n =1)Fig 2 Effect of Shaogan Fuzi decoction on the ankle joint imaging changes of CIA model rats(CT scan,n =1)
3.5 芍甘附子汤对CIA 大鼠踝关节滑膜PPAR-γ、NF-κB p65、p-NF-κB p65、COX-2、iNOS 蛋白表达的影响
大鼠滑膜组织免疫组化结果显示,PPAR-γ位于胞浆及胞核内,呈黄色至棕黄色颗粒状;COX-2 蛋白表达多位于细胞浆内,iNOS 多位于细胞膜及细胞浆中,阳性表达呈棕黄色、棕褐色;NF-κB p65 位于细胞质和细胞核内,细胞核内较多,且细胞核内较细胞质内染色深且阳性细胞数较多;p-NF-κB p65 多位于细胞核内,阳性状态表现为黄色或棕黄色颗粒。正常组PPAR-γ可见其组织中的阳性细胞分布十分密集,主要呈现出棕黄色状态;模型组可见阳性细胞数量较少,且分布稀疏,颜色较浅呈淡黄色;芍甘附子汤各剂量组及雷公藤多苷片组阳性细胞分布较为密集,颜色较深,呈棕黄色。相比于正常组,模型组PPAR-γ蛋白的IOD 值降低(P<0.01);与模型组比较,芍甘附子汤各剂量及雷公藤多苷片可明显升高滑膜组织中PPAR-γ蛋白IOD 值(P<0.05)。
正常组NF-κB p65、p-NF-κB p65、COX-2、iNOS 蛋白阳性细胞普遍分布较为稀疏,呈浅黄色且细胞数量较少;模型组可见阳性细胞分布密集,呈棕黄色,颜色较深,胞体较大;芍甘附子汤各剂量组及雷公藤多苷片组颜色变浅,细胞分布较稀疏。与正常组比较,模型组组大鼠NF-κB p65、p-NF-κB p65、COX-2、iNOS 蛋白IOD 值显著增高(P<0.01);与模型组比较,芍甘附子汤各剂量和雷公藤多苷片均可明显降低滑膜组织中NF-κB p65、COX-2、iNOS 蛋白的IOD 值(P<0.05);芍甘附子汤高剂量组及雷公藤多苷片可降低滑膜组织中p-NF-κB p65 的IOD 值(P<0.05)。结果见表4 及图3。
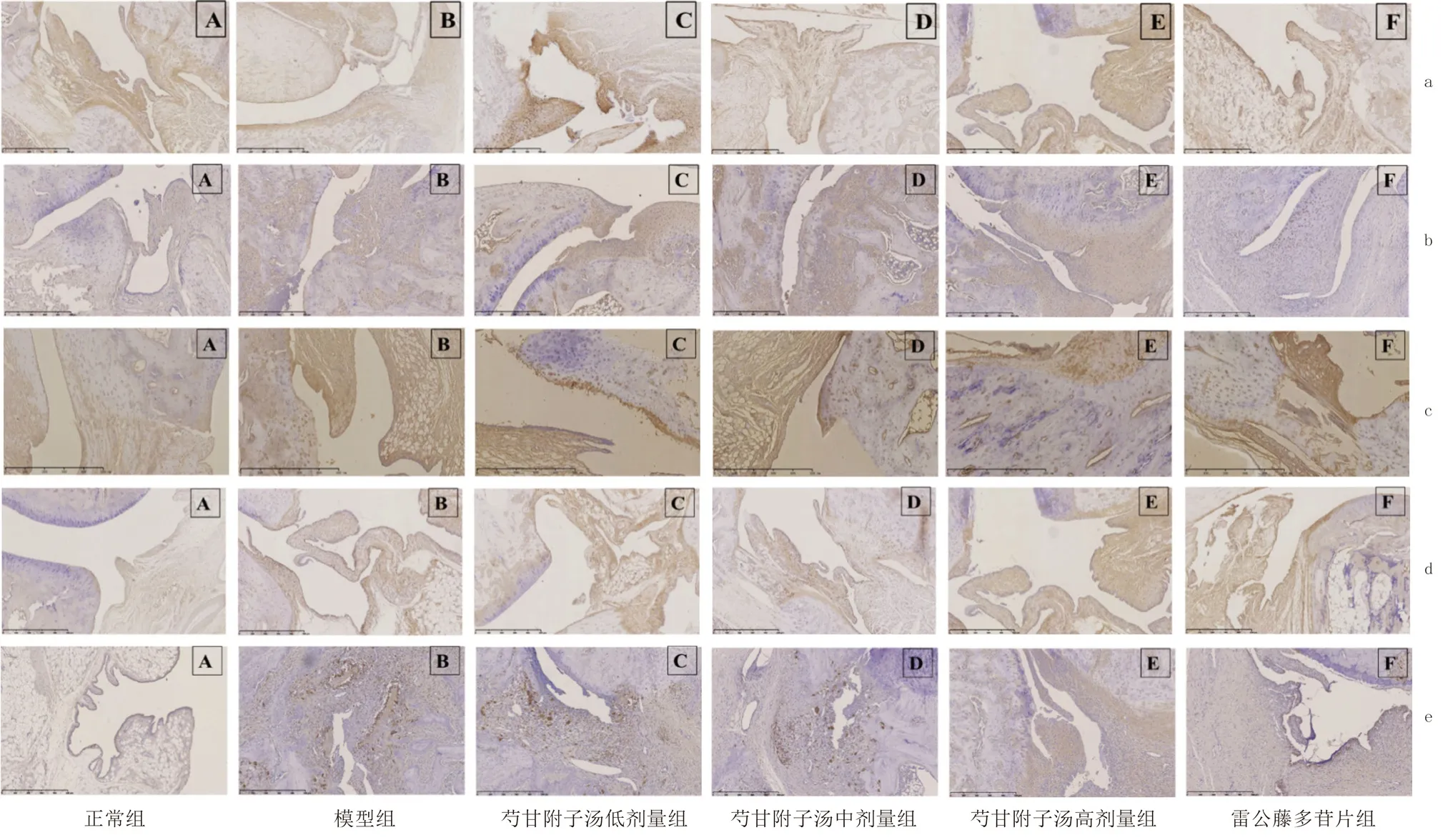
图3 芍甘附子汤对CIA 模型大鼠踝关节PPAR-γ(a),NF-κB p65(b),p-NF-κB p65(c),COX-2(d)及INOS(e)表达的影响(免疫组化,×100,n =6)Fig 3 Effect of Shaogan Fuzi decoction on the expression of PPAR-γ(a),NF-κB p65(b),p-NF-κB p65(c),COX-2(d),and INOS(e)in the ankle joint of CIA model rats(Immunohistochemistry,×100,n =6)
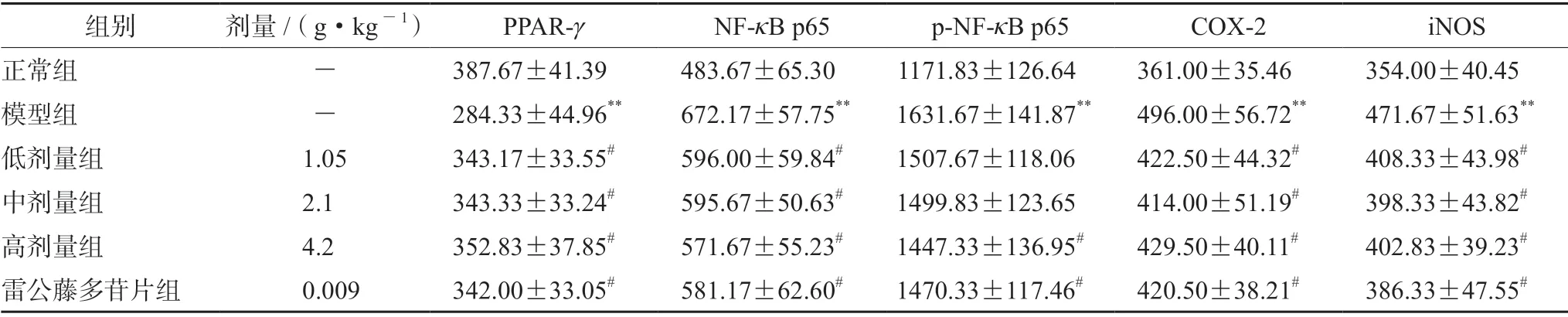
表4 芍甘附子汤对CIA 大鼠滑膜PPAR-γ、NF-κB p65、p-NF-κB p65、COX-2、iNOS 蛋白表达的影响(x±s,n =6,IOD)Tab 4 Effect of Shaogan Fuzi decoction on the protein expression of PPAR-γ,NF-κB p65,p-NF-κB p65,COX-2,and iNOS in the ankle joint synovium of CIA rats (x±s,n =6,IOD)
4 讨论
近年来,PPAR-γ/NF-κB p65 信号通路在RA发病机制中的作用受到许多学者关注。NF-κB 还作为多条通路的重要下游蛋白参与通路的激活,在氧化应激、免疫炎症以及细胞凋亡中起着重要作用,与RA 的严重程度密切相关。NF-κB p65是NF-κB 亚基中最关键的亚基,其经典激活途径为在体内由外界刺激或炎症反应等激活后,催化多种亚基和调节亚基形成多亚基激酶(inhibitor of nuclear factor kappa-B kinase,IKK)复合物,多聚体复合物首先发生磷酸化,使得NF-κB 的抑制蛋白(inhibitor of NF-κB,IκB)活化,继而泛素化后被降解,导致NF-κB 的二聚体复合物游离出细胞质,进入细胞核与核内特定的DNA 序列结合,调节参与免疫应答的细胞因子、趋化因子及黏附因子的转录与表达,进而使病情加重[7-8]。临床及动物实验研究表明,RA 患者及多种动物模型如CIA、佐剂诱导型关节炎等模型中的关节滑膜内存在NF-κB 的高度表达,与本研究中模型组的结果一致[9-12]。有学者通过建立CIA 大鼠模型,发现虎杖可通过对PPAR-γ/NF-κB 信号通路进行干预,升高PPAR-γ并降低NF-κB p65 含量,降低通路中下游炎性因子的含量,减轻炎症反应,达到治疗RA 的目的[13]。本研究结果表明,芍甘附子汤可降低NF-κB p65 及其磷酸化水平,与文献相关研究一致。
PPAR-γ在许多慢性炎症性疾病及自身免疫性疾病中可通过竞争性的减少NF-κB 的激活,抑制炎症反应,还可通过抑制多种促炎细胞因子的产生减轻滑膜炎症及骨侵蚀情况,发挥其抗炎活性。已有研究发现,PPAR-γ激动剂可显著增加PPAR-γ蛋白的表达,降低细胞因子及C-反应蛋白水平,达到治疗目的[14]。PPAR-γ对RA 的治疗作用还与抑制滑膜细胞增殖及调节巨噬细胞的表型分化有关。临床研究表明,PPAR-γ在人滑膜细胞中表达。并且,PPAR-γ激动剂可抑制RA 滑膜细胞中相关炎性细胞因子的表达,减少骨吸收,促进骨形成,还可调节滑膜细胞的增殖与凋亡过程[15]。经PPAR-γ激动剂刺激后可抑制成纤维样滑膜细胞中NF-κB 的表达[16]。PPAR-γ对RA 的影响还体现在可以调节巨噬细胞的表型,通过抑制M1 巨噬细胞的极化,达到抗炎的目的。临床数据显示,RA 患者在接受常用药物治疗后,血清中PPAR-γ的表达显著上升,表明其含量的高低与治疗效果有关[17]。本研究中,PPAR-γ在模型组中为低表达,而进行药物干预后,其表达显著升高,与文献报道相一致。
iNOS 与COX-2 是NF-κB 信号通路重要的下游炎性介质,NF-κB 被激活后会快速进入细胞核与两者的启动子区域的NF-κB 结合位点结合,促进iNOS 及COX-2 的生成。COX-2 是促进花生四烯酸转化为前列腺素等具有生理活性的类花生酸的重要催化物质,在炎症状态下高表达,从而促进血管内皮生长因子等物质的生成,导致新血管生成。本研究中,模型组中COX-2 及iNOS 蛋白的表达显著升高,提示模型组大鼠存在明显炎症,而芍甘附子汤可显著降低COX-2 及iNOS 蛋白的表达,表明芍甘附子汤具有一定的减轻炎症反应的作用。
PGE2是由多种免疫细胞分泌的促炎物质,作为重要的炎性介质在RA 的病情进程中发挥重要的致炎作用,研究表明,COX-2 促进新血管生成作用与PGE2有关。PGE2的过表达会促进软骨损伤,通过促进滑膜组织软骨细胞中胶原蛋白酶的产生,造成糖蛋白的合成与降解失衡,最终导致关节软骨破坏[18]。PGE2可调节IL-17 和TNF-α的表达,并调节TNF/IL-1 介导成纤维样滑膜细胞活化,造成血管通透性的增强,炎症因子释放增多,最终导致促炎性级联反应,并放大增强炎症反应。PGE2与其受体结合后还可增强RANKL的表达进而促进破骨细胞的活化。本研究中芍甘附子汤可显著降低PGE2的表达,表明芍甘附子汤可能对RA 有治疗作用。
综上,芍甘附子汤可改善CIA 大鼠关节肿胀及病理损害,其作用机制可能是通过调节PPAR-γ/NF-κB 信号通路,降低其下游COX-2、iNOS、PGE2、NO、TNF-α、IL-1β、IL-6 的表达水平,从而达到治疗RA 的目的,但具体作用环节和靶点尚待进一步明确。

