黄芩茎叶-桑白皮配伍对脂多糖致急性肺炎大鼠TRPV1信号蛋白的影响
赵博,段广靖,屈新亮,卫培峰,王斌,李敏(陕西中医药大学药学院,陕西 咸阳 712046)
急性肺炎(acute pneumonia)是婴幼儿多发的呼吸系统疾病,具有致病因素复杂、发病迅速、治疗难度大和易引起机体呼吸功能衰竭等特点。急性肺炎与感染后难以控制的炎症反应关系密切,预后极差,病理表现为肺组织炎症、氧化损伤和细胞凋亡等,病死率高,占发病率半数以上,可发展为重症肺炎,严重威胁患儿生命安全[1]。目前,国内外临床上治疗急性肺炎还是以抗菌药物和激素为主,而长期滥用上述药物会产生耐药性,治疗效果降低,且会产生不良反应[2]。因此,研究出安全系数高、不良反应少及临床疗效显著的药物是临床治疗的迫切需求。
中医药在急性肺炎治疗方面优势突出、疗效确切。炎症反应在急性肺炎的治疗中备受重视,近年来有研究证实瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)受体通道激活是诱发炎症导致疼痛、咳嗽敏感性增高的重要机制之一[3]。本研究从急性肺炎的证型出发,基于中医整体观念和辨证论治的思想,选用黄芩茎叶-桑白皮配伍来考察对脂多糖(LPS)致急性肺炎大鼠的抗炎作用、量效关系和对TRPV1 热敏感蛋白的影响。
黄芩茎叶味苦、性寒,主要成分为黄酮类,具有较好的抗炎、抗菌、抗病毒和解热镇痛的药理作用;桑白皮味甘、性寒,具有宣肺平喘、利水消肿和止痛的功效,临床上常以两者配伍来增强黄芩清肺、泻肺和平喘止咳的功效,用于肺热壅盛、气逆咳喘、咯痰黄稠等症。现代药物研究采用傅里叶中红外光谱法、粉末X 射线衍射等方法对比了黄芩茎叶和桑白皮配伍前后主要药效物质黄芩苷和双香豆素的含量变化,并结合黄芩苷、双香豆素及两者结合物的溶解曲线,说明通过等比例混煎的方式,黄芩苷和双香豆素可实现更高效地提取,药效能够充分发挥,阐述了两者配伍的合理性[4]。目前尚无关于黄芩茎叶-桑白皮配伍治疗急性肺炎的研究报道,故本研究选用已经成熟且易复制的LPS 诱导建立大鼠急性肺炎模型,探究不同剂量组黄芩茎叶-桑白皮配伍对大鼠急性肺炎的保护作用的可行性、量效关系和作用机制,为临床急性肺炎提供新的治疗方案和理论依据。
1 材料
1.1 实验动物
健康SPF 级SD 雄性大鼠60 只,4 ~6 周龄,雄性,体质量(130±20)g [成都达硕实验动物有限公司,许可证号:SCXK(川)2020-030]。
1.2 试药
黄芩茎叶、桑白皮(亳州市京皖中药饮片厂,批号:201102,经陕西中医药大学中药鉴定教研室王继涛教授鉴定为唇形科黄芩属植物黄芩Scutellaria baicalensisGeorgi.的干燥茎叶和桑科植物桑Morus albaL.的干燥根皮)。LPS(美国Sigma 公司,批号:078M4040V);肿瘤坏死因子(TNF-α)试剂盒(批号:20210215)、白介素1β(IL-1β)试剂盒(批号:20210114)(上海酶联生物科技有限公司);TRPV1 抗体(武汉博士德生物科技有限公司,批号:CX0125);BCA 蛋白浓度测定试剂盒(批号:WB0123)、ECL 超敏发光试剂盒(批号:WB0164)、SDS-PAGE 凝胶配置试剂盒(批号:WB0130)、一抗稀释液(批号:WB0158)、二抗稀释液(批号:WB0159)(上海威奥生物科技有限公司)。
1.3 仪器
ELX808 全自动酶标仪、电泳仪和转膜仪(美国Bio-Tek 公司);高速台式离心机(上海安亭科学仪器厂,型号:TGL-16B);小型垂直电泳槽(Bio-Rad 伯乐公司,型号:165-8001);电子分析天平(日本岛津公司,型号:TE124S);FRESCO 21 高速冷冻离心机(美国Thermo Fisher Scientific公司);BX51 光学显微镜(日本OLYMPUS 公司);全波长酶标仪(ThermoFisher 公司,型号:Mutiskan GO);荧光定量PCR 仪(Roche 公司,型号:Roche480II);组织匀浆机(北京鼎昊源公司,型号:TL-1010S)。
2 方法
2.1 药物制备
称取干燥黄芩茎叶、桑白皮各50 g,混匀后加入1000 mL 纯净水浸泡30 min,武火加热沸腾后,文火煎煮40 min,过滤后再加800 mL 纯净水文火煎煮30 min,合并两次滤液,旋转蒸发仪70℃浓缩至100 mL,过滤,制成含生药量1 g·mL-1的浓缩液,4℃冷藏备用[5]。
2.2 分组、给药及造模
大鼠适应性饲养4 d [饲养环境室温(24±2)℃,自由摄食和饮水,相对湿度40%~50%,昼夜交替]后,按体质量随机分为6 组:空白组,模型组,阳性组(阿莫西林克拉维酸钾片,85 mg·kg-1),黄芩茎叶-桑白皮配伍高、中、低剂量组(16、8、4 g·kg-1,给药浓度1 g·mL-1),每组10 只。空白组和模型组灌胃生理盐水(10 mL·kg-1),连续灌胃10 d,1 次·d-1。末次给药2 h 后,除空白组外其余各组均于大鼠尾静脉注射LPS(6 mg·kg-1)建立急性肺炎模型[6]。
2.3 动物处理
造模6 h 后采用乙醚麻醉,仰卧位固定大鼠,分离腹主动脉取血,3000 r·min-1离心15 min后,用移液枪吸取血清于-20℃冷藏保存;剪开颈部暴露气管,剪开胸腔用止血钳夹住右主支气管,用5 mL 注射器吸取3 mL 磷酸盐缓冲液(PBS)进行左支气管肺泡灌洗,灌洗两次,每次停留30 s,合并两次肺泡灌洗液(BALF),3000 r·min-1离心10 min 后分离上清液和沉淀物待测;灌洗结束后,断离右肺,计算湿/干质量比值;采集大鼠肺组织进行后续检测。
2.4 大鼠右肺组织湿/干质量(W/D)比值测定
将断离的右肺清除表面粘连组织,用生理盐水漂洗,滤纸吸干肺表面液体,称湿质量,后置于60 ℃烘箱72 h 至恒重,取出称干质量,计算湿/干质量(W/D)比值,判断肺组织水肿程度。
2.5 大鼠BALF 中蛋白含量和中性粒细胞数测定
将BALF 离心后,分离上清液并取0.5 mL,按BCA 蛋白浓度测定试剂盒说明书操作进行蛋白含量测定;沉淀物用生理盐水稀释至3 mL,4℃1500 r·min-1离心10 min,用移液枪吸取45 μL细胞悬浮液于涂片上固定,干燥后瑞氏染色[7],置200 倍倒置显微镜下进行中性粒细胞计数。
2.6 酶联免疫吸附法(ELISA)法测定BALF 中IL-1β、TNF-α 炎症因子水平
取离心后的BALF 上清液,用ELISA 法按照试剂盒说明书操作步骤进行IL-1β、TNF-α含量的测定。
2.7 ELISA 法测定血清中IL-1β、TNF-α 炎症因子水平
取离心后的血清,用ELISA 法按照试剂盒说明书操作步骤进行IL-1β、TNF-α含量的测定。
2.8 肺组织病理半定量分析
大鼠剪开胸腔,取肺组织,于4%多聚甲醛中固定48 h,脱水,石蜡包埋,切片(片厚4 μm),经HE 染色,中性树胶封片后在光学显微镜下观察肺组织周围炎症细胞浸润状况、腔内有无渗出物和肺间质炎症等病理改变。参考文献[8]的肺组织评分指标(肺泡充血程度、出血、肺间质中性粒细胞浸润、肺泡细胞壁增厚)进行评分(0 分:极轻度损伤;1 分:轻度损伤;2 分:中度损伤;3:重度损伤;4 分:严重损伤)。将4项指标的5 个等级得分加和作为总分。由3 名病理科医师分别对每组肺组织损伤程度进行评分,取其平均值。
2.9 RT-PCR 法检测肺组织中TRPV1 的mRNA表达水平
加入1 mL Trizol 试剂提取大鼠肺组织总RNA,反转录进行cDNA 合成,以β-actin 为内参,检测大鼠TRPV1 的mRNA 表达水平。引物由NCBI Primer-blast 公司设计,苏州金唯智生物科技有限公司合成,引物序列:TRPV1 上游:5'-AGCGAGTTCAAAGACCCAGA-3',下游:5'-GTGTCATTCTGCCCATTGTG-3';β-actin 上游:5'-CTAAGGCCAACCGTGAAAAG-3',下游:5'-TACATGGCTGGGGTGTTGA-3';反应条件:95℃预变性2 min;95℃变性5 s,60℃退火10 s,共45 个循环。扩增完毕后进行溶解曲线分析,按2-△△Ct法计算TRPV1基因的相对表达量。
2.10 Western blot 法检测肺组织中TRPV1 的蛋白表达
取大鼠肺组织加入RIPA 组织裂解液,充分研磨制备匀浆后(12 000 r·min-1,4℃)离心5 min,分离上清液,按BCA 蛋白浓度测定试剂盒说明书操作步骤测定蛋白含量。配制10%分离胶10 mL 和5%浓缩胶5 mL,上样后进行SDS 聚丙烯酰胺凝胶电泳,先用70 V 恒压电泳,约30 min后当指示剂溴酚蓝进入分离胶后改用90 V 恒压电泳。电泳结束后,将电泳仪置于冰水条件下200 mA 恒流转膜70 min,将蛋白转至PVDF 膜上,放入5% BSA 室温封闭2 h,TBST 润洗3 次后,与一抗结合,4℃孵育过夜,洗膜,加入二抗室温孵育2 h,洗膜后采用增强型ECL 化学发光法显色,扫描灰度值,计算TRPV1 蛋白相对表达量。
2.11 统计学处理
采用SPSS 24.0 软件包进行统计学处理,实验数据以x±s表示,用单因素方差分析进行组间比较检验,LSD 法进行检验后多重比较,P<0.05 表示差异具有统计学意义。
3 结果
3.1 对大鼠右肺组织W/D 比值的影响
结果如表1 所示,与空白组相比,模型组大鼠的右肺组织W/D 比值显著升高(P<0.01),表明急性肺炎造模成功,肺水肿程度加剧。与模型组相比,阳性组W/D 显著性降低(P<0.01),预给药黄芩茎叶-桑白皮配伍不同剂量组能不同程度改善肺水肿状态,其中高、中剂量组降低更为明显(P<0.01),且表现出对急性肺炎的保护作用呈剂量依赖性关系。
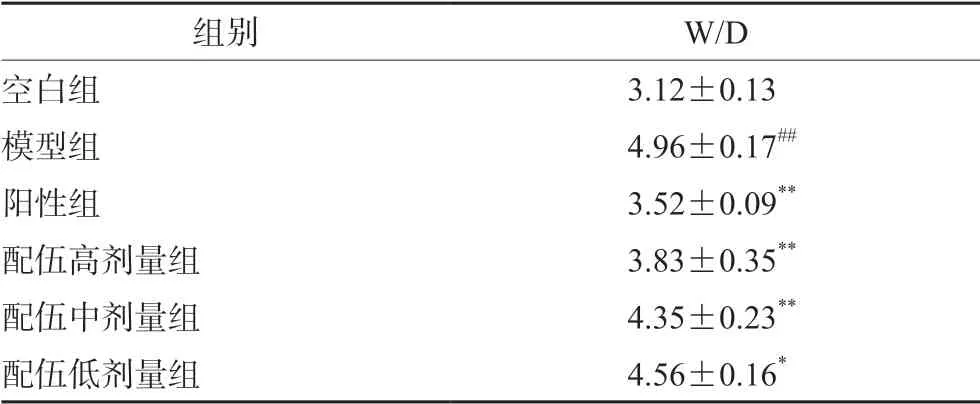
表1 大鼠右肺组织的W/D 比值 (n =10,x±s)Tab 1 W/D value of the right lung tissue in rats (n =10,x±s)
3.2 对大鼠BALF 中蛋白含量与中性粒细胞数的影响
结果见表2,与空白组相比,模型组大鼠静脉注射LPS 后BALF 中的蛋白含量和中性粒细胞数显著增加(P<0.01),表现出急性炎症反应,说明造模理想;与模型组相比,阳性组能显著降低BALF 中蛋白含量和中性粒细胞数(P<0.01),黄芩茎叶-桑白皮配伍各剂量组均能不同程度降低BALF 中的蛋白含量和中性粒细胞数,其中高、中剂量组效果显著(P<0.01 或P<0.05)。

表2 BALF 中蛋白含量和中性粒细胞数(n =10,x±s)Tab 2 Protein content and neutrophil count in BALF (n =10,x±s)
3.3 对BALF 中IL-1β、TNF-α 炎症因子水平的影响
如表3所示,与空白组相比,模型组BALF 中IL-1β、TNF-α炎症因子含量显著增加(P<0.01)。与模型组相比,黄芩茎叶-桑白皮配伍各剂量组TNF-α含量均不同程度降低(P<0.01),黄芩茎叶配伍高、中剂量组IL-1β含量显著降低,且表现出对急性肺炎的保护作用呈剂量依赖性关系;阳性组IL-1β、TNF-α炎症因子水平显著降低(P<0.01)。

表3 BALF 中IL-1β、TNF-α 炎症因子水平(n =10,x±s)Tab 3 IL-1β and TNF-α inflammatory factors in BALF (n =10,x±s)
3.4 对血清中IL-1β、TNF-α 炎症因子含量的影响
如表4 所示,与空白组相比,模型组血清中IL-1β、TNF-α炎症因子含量显著升高(P<0.01);与模型组相比,阳性组和黄芩茎叶-桑白皮配伍高、中剂量组IL-1β和TNF-α含量显著降低(P<0.01)。

表4 血清中IL-1β、TNF-α 炎症因子水平 (n =10,x±s)Tab 4 IL-1β and TNF-α inflammation factor levels in the serum(n =10,x±s)
3.5 肺组织病理变化
空白组大鼠肺组织结构完整,肺泡腔清晰可见,无炎性细胞渗出和肺泡壁增厚等病理变化。相较于空白组,LPS 诱导的急性肺炎模型组大鼠肺泡腔结构不清晰,腔内有大量红细胞、中性粒细胞渗出、肺间质水肿明显和肺泡壁明显增厚等病理学变化。与模型组相比,阳性组明显改善肺组织病变程度,中性粒细胞等炎性细胞渗出减少、肺间质水肿明显减轻。预给药黄芩茎叶-桑白皮配伍各剂量组对大鼠肺组织的病理损伤均有不同程度的改善,高剂量组肺泡腔结构清晰、腔内基本无红细胞和中性粒细胞渗出,肺泡间质水肿、增生明显改善;中剂量组对肺组织损伤有改善作用,肺组织结构完整,腔内无红细胞和中性粒细胞渗出,肺泡间质水肿减轻;低剂量组肺组织肺泡腔中可见少许中性粒细胞和红细胞渗出,肺间质水肿、增生略有减轻[9]。肺组织病理变化见图1,各组肺组织病理半定量评分见图2。

图1 大鼠肺组织病理形态学变化(HE,×400)Fig 1 Pathomorphological changes in the lung tissue of rats(HE,×400)
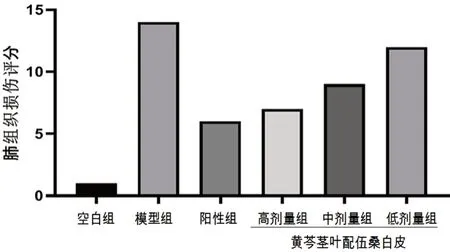
图2 各组大鼠肺组织病理评分Fig 2 Pathological scores of lung tissues of rats in each group
3.6 大鼠肺组织TRPV1 mRNA 表达的影响
如图3 所示,与空白组相比,LPS 致急性肺炎模型组大鼠肺组织中TRPV1 mRNA 的含量差异具有统计学意义(P<0.01);与模型组相比,阳性组肺组织中的TRPV1 mRNA 表达受到抑制,各剂量黄芩茎叶-桑白皮配伍给药组大鼠肺组织TRPV1 mRNA 表达不同程度得到抑制,含量差异具有统计学意义(P<0.01 和P<0.05)。

图3 大鼠肺组织中TRPV1 mRNA 表达的影响Fig 3 TRPV1 mRNA expression in the lung tissue of rats
3.7 大鼠肺组织中TRPV1 蛋白表达水平的影响
如图4所示,相较于空白组,LPS 致急性肺炎大鼠肺组织中TRPV1 蛋白表达水平升高(P<0.01)。与模型组相比,阳性组能显著降低TRPV1 蛋白的表达(P<0.01),黄芩茎叶-桑白皮配伍各剂量组均能不同程度抑制TRPV1 的表达,其中高、中剂量组降低TRPV1 蛋白具有显著性(P<0.01)。
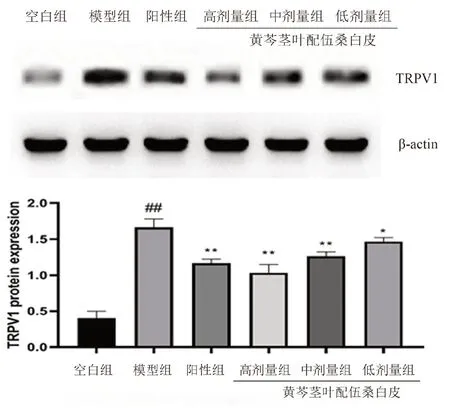
图4 大鼠肺组织中TRPV1 的蛋白表达Fig 4 Protein expression of TRPV1 in the lung tissue of rats
4 讨论
急性肺炎是小儿时期常见的一种呼吸道疾病,治疗不及时转为重症肺炎在婴幼儿死亡中占有很大比例。LPS 是革兰氏阴性菌细胞壁的主要成分,用LPS 尾静脉注射诱导建立的急性肺炎大鼠模型能够诱发机体炎性细胞浸润、炎性因子释放和肺组织正常生理结构改变等病理变化,引起肺组织急性炎症损伤。研究表明IL-1β、TNF-α炎性因子是巨噬细胞活化的生物标志物,作为急性炎症反应过程中的重要因子,在LPS 诱导的急性肺炎发病机制中起着重要作用[10]。IL-1β是一种关键的促炎细胞因子,广泛参与自身免疫性炎症反应和多种细胞活动,在病毒、细菌、真菌和寄生虫感染的患者体内含量激增,可以促进β防御素-4 的生成,是炎症和宿主对感染反应最重要的介质之一[11];TNF-α是一种多向性的促炎细胞因子,主要由巨噬细胞、NK 细胞和T 细胞产生,参与局部炎症并通过TNFR1 和TNFR2 两种受体传递信号[12]。临床上包括糖皮质激素在内的多种治疗手段对于急性肺炎的治疗中都未能显现出较强优势,从而凸显了确定新的药物靶点和开发新的治疗药物的必要性[13]。TRPV1 是瞬时受体电位家族(TRP)的重要成员之一,在呼吸系统的下气道、肺实质和气道上皮细胞间隙或气道黏膜基底均有分布,外源性刺激因素和内源性炎症因子可直接或间接导致TRPV1 的激活[14]。研究还表明TRPV1 激活是急性肺炎临床表现的关键调节因子,抑制TRPV1蛋白有助于控制大鼠急性肺炎的发病进程[15]。现代研究证实,TRPV1 蛋白在急性炎症中的保护作用机制可能涉及多条通路,在介导炎症性热敏感中发挥核心作用[16]。目前广泛认同的机制有两种:一是TRPV1 激活后可能直接作用于炎性介质,TRPV1基因敲除会使炎性反应失控[17];二是TRPV1 的激活会促进降钙素基因相关肽(CGRP)和P 物质等与炎症反应相关的神经肽的释放,而炎症反应的持续是由神经递质介导释放的,从而起到抑制炎症的作用[18]。急性肺炎模型中存在TRPV1 的激活,这一假说在实验中也得到证实。近些年研究证实TRPV1蛋白中的Ser-502 和Ser-800 是蛋白激酶C(protein kinase C,PKC)特异性磷酸化位点[19],PKC 对TRPV1 的特异性磷酸化表现在既能促进辣椒素引起的反应,也能降低炎症热刺激导致TRPV1 激活的阈值[20]。实验中尾静脉注射LPS 后,肺组织易受炎症损伤产生促炎细胞因子IL-1β通过G 蛋白偶联受体引发细胞内级联反应,激活PKC 进而使Ser-800 特异性磷酸化,磷酸化后的TRPV1 受体被激活,细胞Ca2+内流产生去极化进而导致炎性反应引起的热痛觉过敏[21]。为进一步研究TRPV1 对LPS 诱导的急性肺炎大鼠炎症作用及可能的作用方式,本文采用RT-PCR 和Western blot 分别从基因和蛋白层面检测了各组大鼠肺组织中的TRPV1 mRNA 相对表达量和TRPV1 蛋白表达的变化。结果显示正常组大鼠肺组织中的TRPV1 mRNA 和蛋白表达不明显,表明TRPV1 在正常情况下可能不参与机体炎性反应调节。LPS 致急性肺炎引起肺组织中TRPV1 mRNA和蛋白表达量显著升高,黄芩茎叶-桑白皮配伍各剂量组能不同程度抑制TRPV1 信号通道,使神经元所受刺激信号减少,进而使TRPV1 mRNA 和蛋白表达量减少[22]。本研究结果还显示黄芩茎叶-桑白皮配伍可以降低BALF 和血清中促炎因子IL-1β、TNF-α的水平,减少巨噬细胞、中性粒细胞数等炎性细胞数量,这有力表明了黄芩茎叶-桑白皮配伍对急性肺炎具有保护作用。
综上所述,TRPV1 通过调节促炎因子的表达,在急性肺炎的发病机制中发挥重要作用。此外,课题组还发现黄芩茎叶-桑白皮配伍可通过抑制TRPV1 对LPS 诱导的急性肺炎具有保护作用。在下一步研究中,将通过对急性肺炎中TRPV1 调控的下游分子进行鉴定[23],会有助于更好地理解TRPV1 调控急性炎症反应的准确机制,抑制TRPV1 或下游重要靶点将会为急性肺炎提供新的、有效治疗途径。

