羟基红花红色素A抑制氧化应激和细胞凋亡改善OGD/R诱导的HT22细胞损伤
袁美玲,张云,王艳,汪宁*(1.安徽中医药大学药学院,合肥 230012;2.安徽省中药研究与开发重点实验室,合肥 230012;3.安徽省中医科学院中药药效与安全性评价研究所,合肥 230012)
脑卒中又称中风,是一种急性脑血管疾病,主要包括缺血性卒中和出血性卒中,其中缺血性卒中约占所有卒中发病率的80%以上。缺血性卒中是指脑部血管阻塞或破裂,脑组织血流量减少,致使神经功能受损,引起脑部病变,常见于中老年人群中,具有高致残、高复发、高致死的特点,且近年来发病率逐年提升[1]。目前,组织型纤溶酶原激活剂(tPA)进行溶栓治疗效果显著,但由于治疗时间窗的存在,使得及时进行溶栓治疗受到限制[2]。在现代研究中,缺血性脑损伤涉及的病理机制十分复杂,涉及多种生物活性分子及细胞内信号转导通路,如大量神经细胞程序性死亡、脑组织能量代谢障碍、细胞内钙超载,活性氧大爆发、氧化应激等[3]。因此,抑制神经细胞凋亡、抗氧化应激对于防治缺血性卒中具有重要意义。
缺血性卒中属于中医“中风”范畴,“脑脉”阻塞,血凝脉内之瘀血是缺血性中风的主要病机之一,故究其本质仍属血瘀证。活血化瘀是血瘀证的特有治法。运用活血化瘀药祛除瘀血、疏通血脉、畅通血流,可改善血液循环、止血和促进血液吸收及改善神经营养等作用;促进血肿吸收和侧支循环建立,减轻及恢复损伤的神经功能,对缺血性中风的治疗有极其重要的意义。中药红花被用于治疗心脑血管疾病100 多年,并且正式列入《中国药典》。羟基红花黄色素A(HSYA)既是中药红花药理功效的最有效水溶性部位,也是红花活血化瘀的有效成分,具有活血化瘀,改善血液循环的功效。已有研究表明,HSYA 的神经保护作用与减轻氧化应激有关[4]。课题组前期研究表明,HSYA 能够透过血脑屏障进入脑脊液中,并且对氧糖剥夺/复糖复氧(OGD/R)损伤的脑微血管内皮细胞具有一定的保护作用[5]。目前公认的模拟体内缺血缺氧模型为对细胞进行OGD/R 处理[6],因此在缺血性卒中发病机制的研究中多采用HT22 细胞的体外OGD/R 模型,从而为缺血性卒中的治疗提供一定的理论依据。
1 材料
1.1 试药
小鼠海马神经元HT22 细胞(中科院上海细胞生物所),HSYA(成都德斯特,纯度≥98%,结构式见图1);LDH 毒性检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、总谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒(Beyotime);增强型细胞增殖毒性检测(CCK-8)试剂盒、一氧化氮(NO)试剂盒、活性氧(ROS)(碧云天);小鼠细胞色素C(CytC)酶联免疫分析试剂盒(江莱生物,JL13261),Hoechst 33258 染色试剂(美国Sigma 公司,B2833);FITC Annexin V 细胞凋亡检测试剂盒(美国 BD Biosciences 公司,7312712);cleaved-caspase3、Bax、Bcl-2(ZENBIO);HRP 标记山羊抗小鼠 IgG、HRP 标记山羊抗兔IgG(Spark-Jade);DMEM 培养基(Gibco,8121278);胎牛血清(FBS,BI,04-001-1ACS);青霉素和链霉素(Beyotime,C0222);TRIZOL 试剂(Thermo Fisher,15596026);ReverTra Ace Q-PCRT Master Mix、SYBR Green Realtime PCR Master Mix(TOYOBO)。
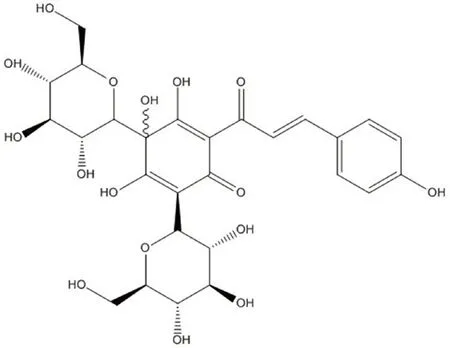
图1 HSYA 分子结构式Fig 1 Molecular formula of HSYA
1.2 仪器
371 型CO2培养箱、Heracell VIOS160i 型CO2培养箱、1500 型全波长酶标仪(美国 Thermo Scientific 公司);TDL-5 型飞鸽台式离心机(上海安亭科学仪器厂);Countstar 型细胞计数仪(艾利特国际有限公司);倒置显微镜(日本Olympus 公司);荧光显微镜(德国Leica 公司);电泳仪和转膜仪(美国 Bio-Rad 公司);凝胶成像系统(美国General Electric 公司);流式细胞仪(美国Beckman 公司)。
2 方法
2.1 HT22 细胞的培养
采用常规细胞培养方法复苏HT22 细胞,后用含10%胎牛血清的DMEM 高糖培养基将细胞稀释至一定密度后置于37 ℃、5%CO2恒温培养箱中培养。约2 ~3 d 传代一次,取对数生长期细胞进行后续实验。
2.2 OGD/R 损伤HT22 模型的建立[7]
胰酶消化正常状态的HT22 细胞种板,细胞贴壁后,吸出培养液,用PBS 轻轻摇晃润洗细胞3 次,加入无糖培养液,将细胞转移到缺氧小室(95%N2和5%CO2)中氧糖剥夺6 h,弃去无糖培养液,用PBS 洗3 次后加入完全培养液,于常规培养箱(37 ℃、5% CO2)中培养12 h。
2.3 HSYA 对OGD/R 损伤HT22 的浓度筛选
取正常状态的HT22 细胞接种于96 孔板中,密度为1×105个·mL-1,细胞贴壁后,吸出培养液,PBS 润洗3 次,随机分组,正常组加入新的完全培养液,常规培养;OGD/R 组和给药组加入无糖培养液,氧糖剥夺6 h,吸出无糖培养液,OGD/R 组加入完全培养液,给药组分别加入不同浓度的HSYA(5、10、20、40、60、80、100、120、140 μmol·L-1),在37℃、5%CO2培养箱中培养12 h 后,加入10 μL CCK-8 溶液,继续培养1 h,避光下,用酶标仪测定450 nm 处各孔吸光度值,计算细胞增殖活力。
2.4 分组及给药
将细胞随机分为5 组:正常组,模型组(OGD/R),HSYA 低、中、高剂量(40、60、80 μmol·L-1)组,模型组造模6 h 后加入完全培养液培养12 h,给药组造模6 h 后分别加入不同浓度的HSYA(40、60、80 μmol·L-1)培养12 h,正常组在常规培养箱培养相同时间后加入相应培养液。
2.5 倒置显微镜观察HT22 细胞形态学变化
将细胞以每孔3×105个细胞接种到6孔板中,根据分组分别造模和给药后,用倒置显微镜观察各组细胞形态。
2.6 HT22 细胞上清液中LDH、NO 含量的检测
将细胞以每孔1×105个接种到96 孔板中,根据分组分别造模和给药后,收集细胞上清液,根据LDH、NO 试剂盒说明,检测细胞上清液中LDH、NO 的含量。
2.7 SOD 活性、GSH 活性、MDA 水平
将细胞以每孔1×105个接种到96 孔板中,根据分组分别造模和给药后,吸弃各孔细胞上清液。根据各试剂盒说明,检测SOD 活性、GSH活性、MDA 水平。
2.8 荧光倒置显微镜观察细胞内ROS 荧光强度
将细胞以每孔3×105个接种到6 孔板中,根据分组分别造模和给药后,吸弃各孔细胞上清液。加入适量DCFH-DA 10 μmol·L-1覆盖各孔细胞的体积,常规孵育20 min 后PBS 漂洗细胞2次,充分洗净未与细胞结合的DCFH-DA 后,采用荧光倒置显微镜观察各组细胞荧光强弱。
2.9 Hoechst33258 染色检测细胞凋亡
将细胞以每孔3×105个接种到6 孔板中,根据分组分别造模和给药后,室温下加入多聚甲醛固定20 min,移去多聚甲醛后PBS 润洗3 次后加入Hoechst 33258 染液孵育15 min,最后用荧光倒置显微镜观察细胞。
2.10 流式细胞术检测细胞凋亡率
将细胞以每孔1×106个接种到6 孔板中,根据分组分别造模和给药后,根据Annexin V-FITC细胞凋亡检测说明书进行操作,用流式细胞仪上机测定,并通过Flow Jo7.6 计算各组细胞凋亡率。
2.11 ELISA 法检测细胞胞浆中CytC 的释放
细胞前处理同“2.7”项下。依据酶联免疫试剂盒,450 nm 波长下测各孔吸光度值,通过标准曲线计算CytC 的含量。
2.12 Western blot 检测Bax、Bcl-2 和cleavedcaspase-3 的蛋白表达
根据实验分组分别处理细胞后,采用 BCA 法定量并调整各组细胞蛋白浓度。随后通过 SDSPAGE 电泳,并转移到PVDF 膜上。5%脱脂奶粉在室温下封闭2 h 后,分别与对应的一抗孵育过夜,次日将膜漂洗并与 HRP 标记的二抗(1∶10 000)在室温下孵育2 h。最后TBST 漂洗3次,使用凝胶成像系统,用显影液进行信号检测,并通过AlphaVIEW SA 软件分析蛋白质条带。
2.13 qRT-PCR 检测Bax 和Bcl-2 的mRNA 含量
用Trizol 试剂处理HT22 细胞,提取总RNA。使用ReverTra Ace Q-PCRT Master Mix 试剂盒将RNA 反转录成cDNA,再根据SYBR Green Realtime PCR Master Mix 使用PCR 仪器(Stratagene,San Diego,CA,USA,MX3000P)定量mRNA含量。用2-ΔΔCt法计算相对基因表达水平。
Bax:Forward,GTCGCCCTTTTCTACTTCGC;Reverse,ATGGTGAGTGAGACGGTGAG;
Bcl-2:Forward,TCGCAGAGATGTCCAGTCAG;Reverse,ATCTCCCTGTTGACGCTCTC;
β-actin:Forward,AACAGTCCGCCTAGACC;Reverse,CGTTGACATCCGTAAAGACC.
2.14 统计学分析
实验结果以均数±标准差(±s)表示,采用单因素方差分析(ANOVA)进行组间均数比较,所有数据分析采用SPSS 23.0 处理,P<0.05表明差异有统计学意义。
3 结果
3.1 OGD/R 不同时间点对HT22 细胞增殖活力的影响
为观察OGD/R 损伤HT22 细胞模型的具体效应,实验选取OGD 处理6 h 复糖复氧3、6、12、24、48 h 5 个时间点,采用CCK8 法检测细胞存活率。结果如图2 所示,OGD 处理6 h 后,细胞存活率下降。复糖复氧0 ~48 h,OGD/R 组细胞存活率显著降低(P<0.01),在0 ~12 h 呈下降趋势,并于12 h 达到最低。所以后续实验选择复糖复氧12 h。
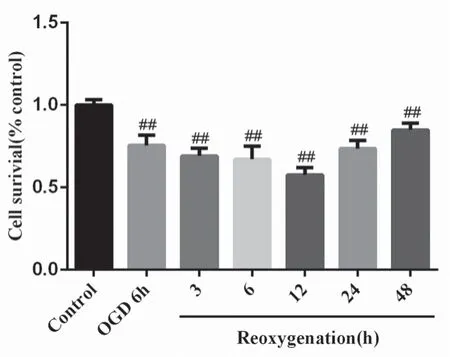
图2 OGD/R 最佳造模时间筛选(x ±s,n =6)Fig 2 Optimal molding time of OGD/R(x ±s,n =6)
3.2 HSYA 对OGD/R 损伤HT22 细胞的有效浓度筛选
结果如图3 所示,与正常组相比,OGD/R 组细胞存活率显著降低(P<0.01);与OGD/R 组相比,HSYA 各浓度组(20、40、60、80、100 μmol·L-1)可提升细胞存活率(P<0.05,P<0.01)。综合结果,选择40、60、80 μmol·L-1分别作为HSYA的低、中、高剂量组。
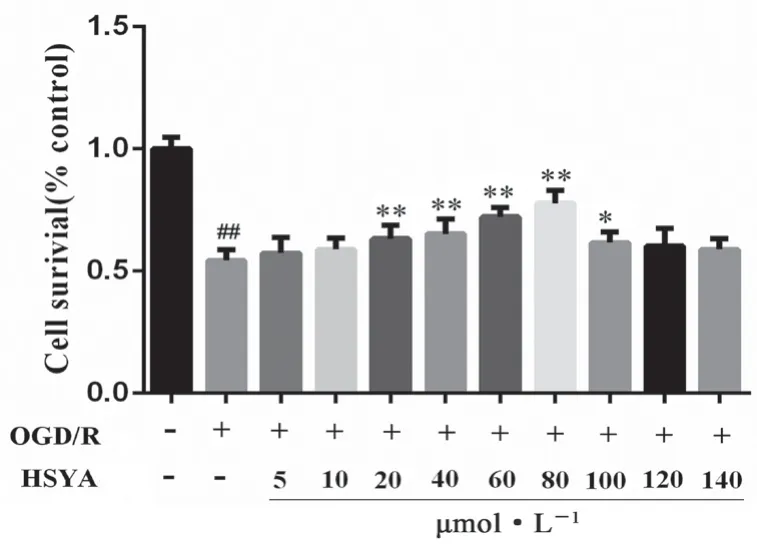
图3 HSYA 有效浓度筛选(x±s,n =6)Fig 3 Effective concentration screening of HSYA( x ±s,n =6)
3.3 HSYA 对OGD/R 损伤HT22 细胞LDH 释放的影响
结果如图4 所示,与正常组相比,OGD/R 组LDH 的释放量显著增加(P<0.01);HSYA 各剂量组细胞上清液中的LDH 释放量均低于OGD/R 组(P<0.01)。
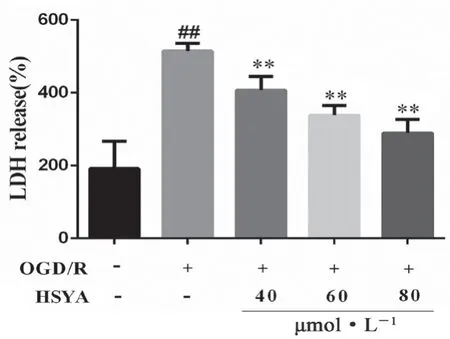
图4 HSYA 对OGD/R 损伤HT22中LDH 释放的影响(x± s,n=6)Fig 4 Effect of HSYA on LDH release in HT22 cells after OGD/R injury(x ±s,n =6)
3.4 HSYA 对OGD/R 诱导的 HT22 细胞形态的影响
正常组HT22 细胞呈长梭形,较为饱满,贴壁状态较好;OGD/R 组细胞变圆、皱缩,稀疏脱落;HSYA 作用后HT22 细胞贴壁数目增多,折光性增强,见图5。
3.5 HSYA 对OGD/R 损伤HT22 细胞NO、MDA、SOD、GSH 含量的影响
与正常组相比,OGD/R 组HT22 细胞NO、MDA含量显著增多,GSH、SOD 活性降低(P<0.01);而与OGD/R 组相比,HSYA 各剂量组中NO、MDA的含量显著降低,GSH、SOD 活性升高(P<0.05,P<0.01),提示HSYA 可有效改善细胞氧化应激损伤,如图6 所示。
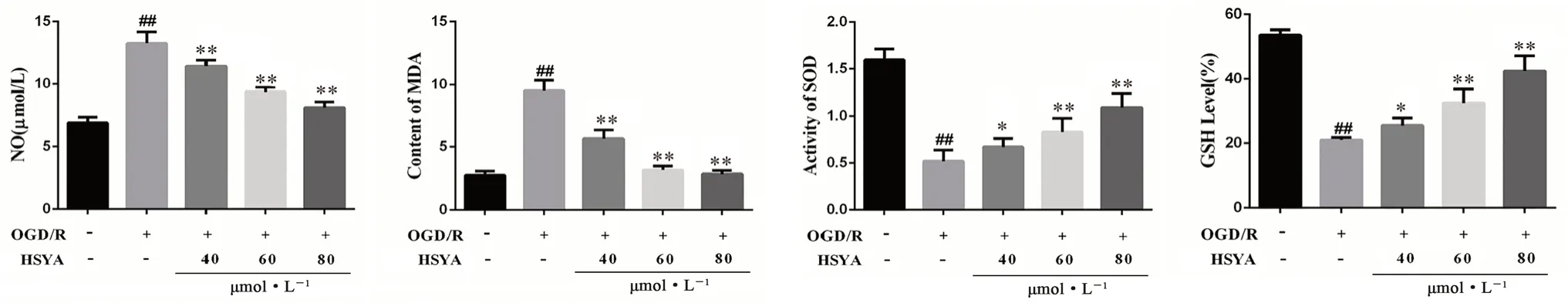
图6 HSYA 对OGD/R 损伤HT22 细胞中NO、MDA、SOD 及GSH 含量的影响(x ±s,n =6)Fig 6 Effect of HSYA on the content of NO,MDA,SOD and GSH in HT22 cells damaged by OGD/R(x ±s,n =6)
3.6 HSYA 对OGD/R 损伤HT22 细胞ROS 荧光强度的影响
如图7 所示,与正常组相比,OGD/R 组细胞产生较强的绿色荧光,说明造模后HT22 细胞内ROS 的水平升高;与OGD/R 组相比,HSYA 各剂量组细胞荧光强度逐渐减弱,由此可知HSYA可有效的降低细胞内ROS 的水平。

图7 HSYA 对OGD/R 损伤HT22 细胞ROS 荧光强度的影响(×400)Fig 7 Effect of HSYA on ROS fluorescence intensity of OGD/R damaged HT22 cells(×400)
3.7 HSYA 对OGD/R 损伤HT22 细胞胞浆CytC释放的影响
如图8 所示,与正常组相比,OGD/R 组细胞胞浆CytC 含量显著性升高(P<0.01);与OGD/R 组相比,HSYA 各剂量组细胞胞浆CytC显著性降低(P<0.01),表明HSYA 抑制了CytC 从线粒体到胞浆中的释放。
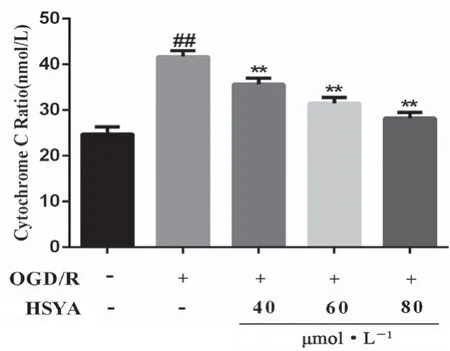
图8 HSYA 对OGD/R 损伤HT22 细胞胞浆CytC 释放的影响(x ±s,n =6)Fig 8 Effect of HSYA on the cytoplasmic CytC release of OGD/R damaged HT22 cells(x ±s,n =6)
3.8 HSYA 对OGD/R 损伤HT22 细胞凋亡的影响
如图9 所示,正常组细胞形态较为饱满,可见微弱蓝色荧光,OGD/R 组细胞核固缩,呈亮蓝色荧光。HSYA 各剂量组与OGD/R 组相比,核变圆变大,细胞核蓝色荧光强度明显减弱。随后定量检测HSYA 给药组对OGD/R 损伤HT22 细胞凋亡影响,结果显示,与正常组相比,OGD/R 组细胞的凋亡率为44.81%;HSYA 低、中、高给药组可显著降低细胞凋亡率至26.23%、17.78%、8.67%(P<0.01)。
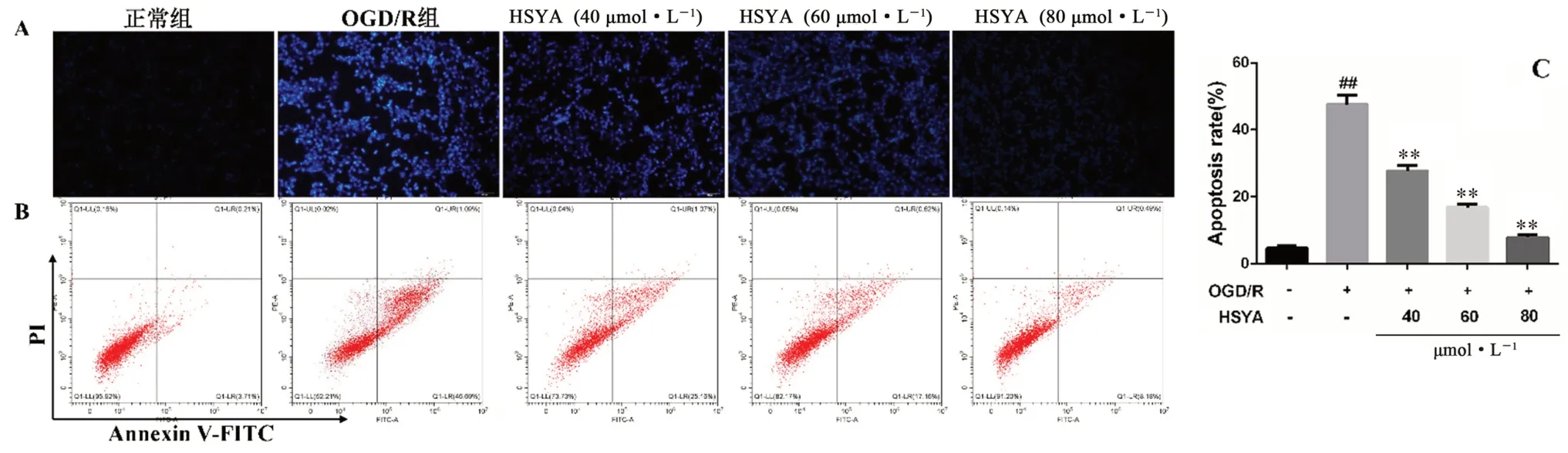
图9 HSYA 对OGD/R 损伤HT22 细胞凋亡的影响(x ±s,n =3)Fig 9 Effect of HSYA on the apoptosis of OGD/R damaged HT22 cells(x ±s,n =3)
3.9 HSYA 对OGD/R 损伤HT22 细胞中Bax、Bcl-2和cleaved-caspase-3 蛋白表达的影响
如图10 所示,与正常组相比,OGD/R 组Bax/Bcl-2 和cleaved-caspase-3 蛋白表达量显著增加(P<0.01)。而相对于OGD/R 组,经HSYA处理后,Bax/Bcl-2 和cleaved-caspase-3 蛋白表达量显著降低(P<0.05,P<0.01)。

图10 HSYA 对OGD/R 损伤HT22 细胞中Bax、Bcl-2 和cleaved-caspase3 蛋白表达的影响(x ±s,n =3)Fig 10 Effect of HSYA on the expression of Bax,Bcl-2 and cleaved-caspase3 in OGD/R damaged HT22 cells(x ±s,n =3)
3.10 HSYA 对OGD/R 损伤HT22 细胞中Bax 和Bcl-2 mRNA 含量的影响
如图11 所示,与正常组相比,OGD/R 组Bax 的mRNA 表达量显著增加,Bcl-2 mRNA 表达量显著降低(P<0.01)。而相对于OGD/R 组,经HSYA 处理后,Bax 的mRNA 表达量显著降低,Bcl-2 mRNA 表达量显著增加(P<0.01)。
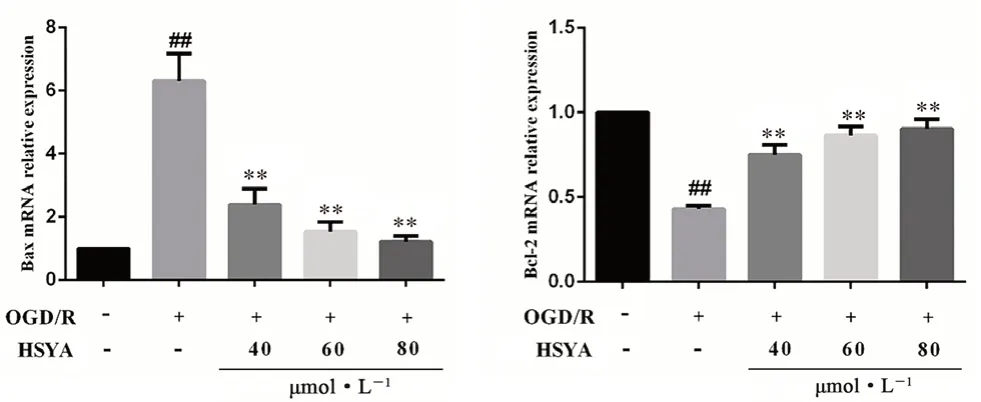
图11 HSYA 对OGD/R 损伤HT22 细胞中Bax 和Bcl-2 mRNA 含量的影响(x ±s,n =3)Fig 11 Effect of HSYA on the mRNA content of Bax and Bcl-2 in OGD/ R-damaged HT22 cells(x ±s,n =3)
4 讨论
缺血性卒中致死率很高。目前,主要治疗药物是治疗靶点单一的神经保护性药物,中药以其多途径、多靶点、不良反应少的特点在缺血性卒中的康复治疗中展现出巨大优势。因此,探讨中药治疗缺血性卒中的潜在机制,对其康复治疗具有重大意义。HT22 细胞体外脑缺血模型(氧糖剥夺,OGD)与在体实验模型具相似的生理学特性,且相比于在体实验,体外实验能够更好地模拟和确定在体脑缺血的治疗靶点和策略[8]。
细胞凋亡是缺血性卒中发病过程中神经元损伤的一种形式。缺血缺氧后,脑梗死病灶中同时存在细胞坏死与细胞凋亡,缺血中心区域以细胞坏死为主,而梗死灶周围缺血半暗带中细胞死亡的一种主要形式则为细胞凋亡[9]。脑缺血时有多种caspase 表达,caspase3 在缺血性神经元细胞凋亡过程中起重要作用[10]。研究显示,缺血时能量代谢出现障碍,线粒体跨膜电位消失,其通透性转变孔(mPTP)开放,CytC 可与凋亡蛋白酶活化因子1(Apaf-1)形成凋亡体,激活下游的caspase 通路诱导细胞凋亡[11]。另一方面,Bax和Bcl-2 是线粒体内源性途径凋亡过程中的关键调节蛋白,Bax 和Bcl-2 的比值升高可以进一步诱导细胞发生凋亡[12]。本研究结果显示缺血性卒中发生过程中Bax/Bcl-2、cleaved-caspase3 的蛋白表达和mRNA 含量都增强,而HSYA 治疗可以逆转这一趋势。CytC 释放至胞浆是线粒体介导的细胞凋亡途径的关键步骤[13],ELISA 结果显示HSYA 抑制了CytC 从线粒体到胞浆中的释放。Hoechst 染色和AV-PI 流式细胞术染色是检测细胞凋亡的金指标,本研究结果表明,HSYA 各给药组细胞凋亡率降低,表明HSYA 抑制神经细胞凋亡减轻OGD/R 诱导的HT22 细胞损伤。
氧化应激是指细胞或机体收到刺激后自由基的产生和抗氧化防御严重失衡,从而引起的一系列细胞毒性反应。缺血性卒中的主要发病机制包括氧化应激在内的缺血级联反应,一般情况下,SOD 和GSH 等都具有清除自由基的作用。除此之外,ROS 是氧化应激中至关重要的调节因子,在氧化应激和细胞生长过程中起着举足轻重的作用[14]。本研究结果表明,当缺血性卒中发生时细胞内NO、LDH、MDA 及ROS 水平显著升高,SOD 和GSH 水平显著降低,而给予HSYA 治疗后,可以显著改善这一现象,提示HSYA 可通过抑制氧化应激减轻OGD/R 诱导的HT22 细胞损伤。
综上所述,HSYA 对OGD/R 诱导的HT22 细胞具有保护作用,这种保护作用可能与抑制氧化应激和神经元细胞凋亡有关。

