血浆色素上皮衍生因子与初发2型糖尿病患者骨密度的相关性
钱万斌 蒋晓红 卜瑞芳
1.苏州大学附属第三医院内分泌代谢科,江苏 常州 213004 2.南京医科大学附属无锡人民医院内分泌代谢科,江苏 无锡 214023
最新流调显示中国成人糖尿病患病率为11.2%[1],目前我国糖尿病以2型糖尿病(type 2 diabetes mellitus,T2DM)为主。研究显示糖尿病与骨密度变化密切相关,其中1型糖尿病(type 1 diabetes mellitus,T1DM)患者骨密度常降低[2],而 T2DM患者骨密度多在正常范围内甚至升高[3],目前机制并不明确。
色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是属于丝氨酸蛋白酶抑制剂家族的糖蛋白,具有抗血管生成、抗肿瘤、抗氧化以及神经营养等功能[4]。研究表明PEDF与胰岛素抵抗[5]、肥胖[6]、糖尿病[7]等代谢功能紊乱疾病密切相关,且在这些疾病中血PEDF水平多增高。研究还发现PEDF与Ⅵ型成骨发育不全[8]等骨骼系统疾病相关。以上研究提示PEDF同时参与了糖代谢与骨代谢,因此笔者推测PEDF可能影响T2DM患者骨密度变化。但目前关于PEDF与初发T2DM患者骨密度关系的研究较少,因此笔者对其展开相关研究。
1 材料与方法
1.1 研究对象
纳入2017年9月至2018年3月在无锡市人民医院内分泌科住院的初发T2DM患者。纳入标准:均符合1999年世界卫生组织 2型糖尿病诊断标准。排除标准:(1)糖尿病急性并发症;(2)严重脏器功能衰竭;(3)患有甲状腺疾病、肾脏疾病及免疫风湿等与继发性骨质疏松相关的疾病。所有受试者均签署知情同意书,该研究通过了无锡市人民医院伦理委员会审批。
1.2 资料采集
1.2.1一般资料获取:以问诊的方式获取患者年龄、性别、用药情况、病史等;并测量患者身高、体重、腰围。
1.2.2一般临床检验及骨代谢相关指标的测定:抽取患者空腹血测量其空腹血糖(FBG)、总蛋白、总胆红素、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血尿酸(UA)、血肌酐(Cr)、血尿素氮(BUN)、血钙、血磷、糖化血红蛋白(HbA1c)、甲状旁腺素(PTH)、Ⅰ型前胶原氨基末端前肽(PINP)、Ⅰ型胶原羧基末端肽交联(β-CTX)、骨钙素、25羟维生素D(25-OH-VD)。
1.2.3骨密度的测定:应用双能X线骨密度仪测定第1至第4腰椎(L1~4)、左侧股骨颈、左侧全髋的骨密度。
1.3 血浆PEDF浓度检测
空腹抽取患者外周静脉血5 mL,标本离心后取上清置于EP管中,密封保存-80 ℃冰箱中,检测时充分解冻后采用酶联免疫吸附法测定血浆PEDF水平,试剂盒购自上海酶联生物(MLBIO)科技有限公司(灵敏度1.0 μg/mL,检测范围5~160 μg/mL,板内变异系数<10%,板间变异系数<15%)。
1.4 统计学分析
连续性变量先进行Kolmogorov-Smirnov正态性检验,符合正态分布的变量使用平均值±标准差表示,组间比较使用独立样本t检验;不符合正态分布的变量使用中位数(四分位间距)表示,组间比较使用非参数Mann-Whitney U检验。分类变量的组间比较使用卡方检验。Pearson相关分析被用于分析BMD与一般资料、临床检验资料及骨代谢相关指标间的相关性。将单因素线性回归分析中P<0.1的变量纳入多因素线性回归分析(输入法)以确定BMD的独立危险因素。以上统计分析均采用SPSS 23.0软件,检验水平P<0.05被认定为差异有统计学意义。运用GraphPad 8.4.3及Photoshop CS5绘制PEDF与BMD的相关图。
2 结果
2.1 一般资料、临床检验及骨代谢相关指标比较
共有50例初发T2DM患者纳入研究,患者平均年龄(50.34±12.33)岁。如表1所示,骨量减少与骨量正常两组间的一般资料无明显差异。在临床检验资料方面,骨量减少组的UA水平显著低于骨量正常组。

表1 初发T2DM患者骨量正常组及骨质减少组的一般资料及临床检验比较Table.1 General clinical data of patients with newly diagnosed T2DM, stratified by BMD
2.2 骨代谢相关指标及BMD的比较
如表2所示,骨量减少组患者的PEDF水平比骨量正常组低,差异性具有边缘显著性,而骨量减少组患者骨钙素水平较骨量正常组显著增高。在BMD方面,骨量减少组患者L1~4、股骨颈及全髋的BMD均较骨量正常组下降,其中股骨颈及全髋BMD的差异具有显著性。

表2 初发T2DM患者骨量正常组及骨质减少组的骨代谢相关指标及骨密度比较Table.2 Bone turnover markers and BMD of patients with newly diagnosed T2DM, stratified by BMD
2.3 PEDF与BMD的相关性
如图1所示,PEDF与初发T2DM患者L1~4BMD呈正相关(r=0.331,P=0.019),同时也与初发T2DM患者股骨颈BMD呈正相关(r=0.309,P=0.029)。PEDF与初发T2DM患者全髋BMD具有边缘显著性(r=0.256,P=0.073)。
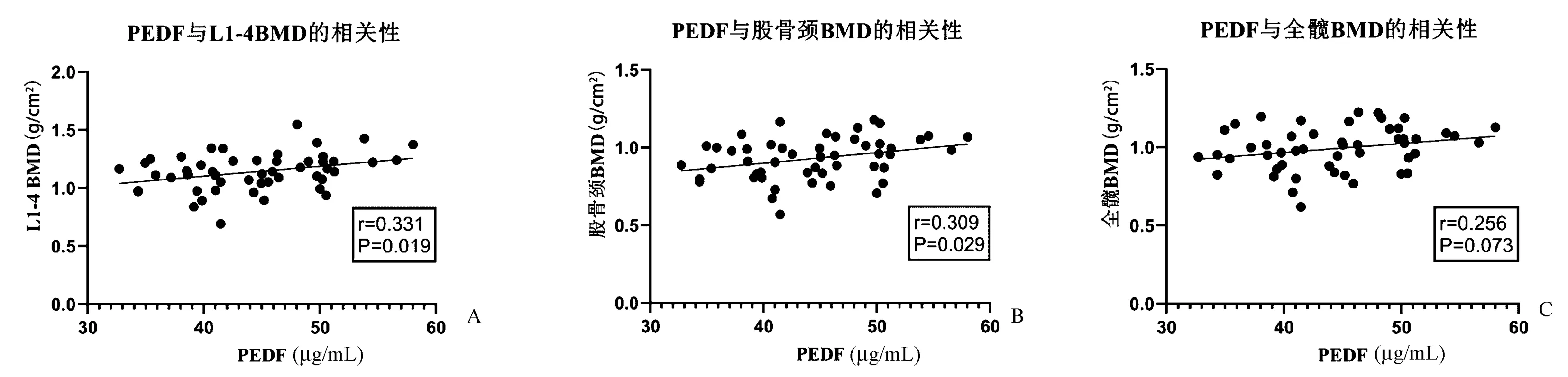
图1 PEDF与初发T2DM患者BMD的相关性A:PEDF与初发T2DM患者L1~4 BMD呈正相关(r=0.331,P=0.019);B:PEDF与初发T2DM患者股骨颈BMD呈正相关(r=0.309,P=0.029);C:PEDF与初发T2DM患者全髋BMD具有边缘显著性(r=0.256,P=0.073)Fig.1 Correlation analyses between PEDF and BMD in patients with newly diagnosed T2DMA: PEDF was positively correlated with L1-4BMD (r=0.331, P=0.019); B: PEDF was positively correlated with femoral neck BMD (r=0.309, P=0.029); C: PEDF was marginally positively correlated with total hip BMD (r=0.256, P=0.073).
2.4 多元线性回归
如表3所示,在校正了年龄、身高、体重及腰围后,PEDF与L1~4BMD独立正相关(r=0.315,P=0.015),同时UA及总胆红素增高也与L1-4BMD增加呈正相关。在校正了年龄、性别、身高、体重及腰围后,PEDF与股骨颈BMD独立正相关(r=0.372,P=0.004),也与全髋BMD独立正相关(r=0.320,P=0.018);另外,年龄增大和总蛋白降低也是股骨颈及全髋骨密度减少的独立危险因素(表4、5)。
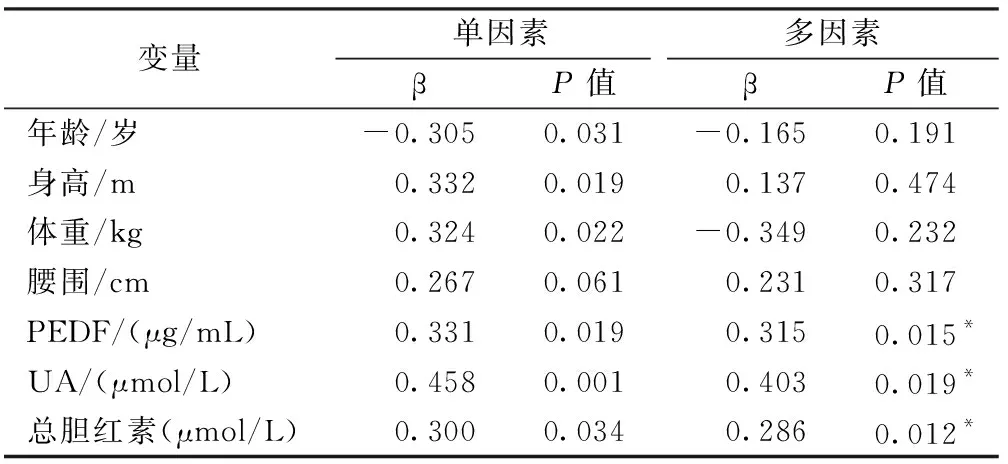
表3 初发T2DM患者L1~4 BMD影响因素的单因素线性回归及多因素线性回归分析Table.3 Univariate and multivariate linear regression for risk factors of L1-4 BMD in patients with newly diagnosed T2DM
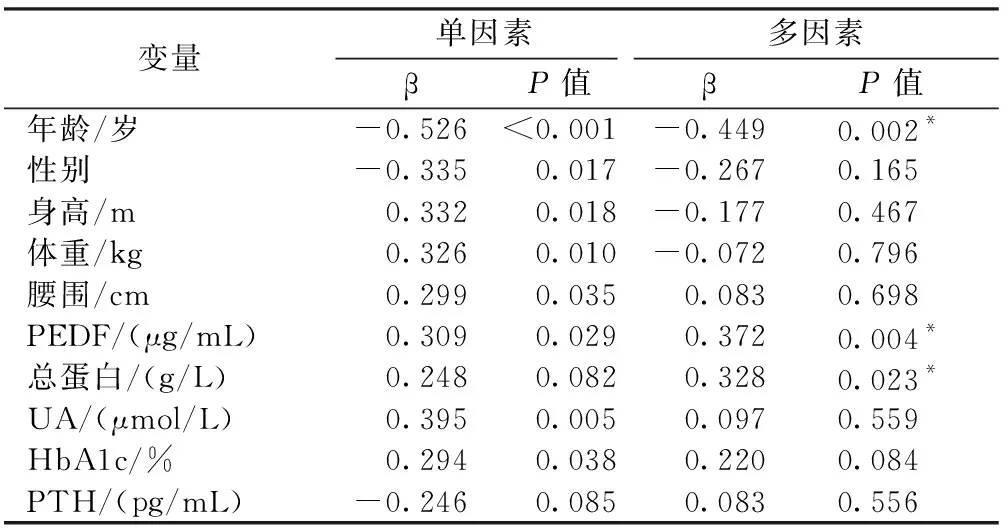
表4 初发T2DM患者股骨颈BMD影响因素的单因素线性回归及多因素线性回归分析Table.4 Univariate and multivariate linear regression for risk factors of femoral neck BMD in patients with newly diagnosed T2DM

表5 初发T2DM患者全髋BMD影响因素的单因素线性回归及多因素线性回归分析Table.5 Univariate and multivariate linear regression for risk factors of total hip BMD in patients with newly diagnosed T2DM
3 讨论
本研究发现初发T2DM患者骨量减少组较骨量正常组血浆PEDF水平更低,且血浆PEDF水平与骨密度正相关。研究表明血PEDF在糖尿病患者中水平多增高,Ogata等[9]和Jenkins等[10]研究显示T2DM患者血PEDF水平高于正常对照组约50%,陈海冰等[11]研究显示合并不同程度蛋白尿的T2DM患者血PEDF水平均显著高于正常对照组。血糖血脂代谢异常与胰岛素抵抗密切相关,Nakamura等[7]发现在合并腹型肥胖的T2DM患者中,PEDF与腰围、甘油三脂等独立显著相关,Sabater等[6]研究显示在包括T2DM的糖耐量异常人群中,PEDF与BMI以及HbA1c显著相关,这些结果提示胰岛素抵抗可能与T2DM患者循环PEDF水平增高有关。脂肪组织是PEDF的来源之一,因此PEDF也被认为是一种脂肪因子[10,12],PEDF可以分解甘油三脂,使游离脂肪酸进入血液循环并引起肝脏肌肉等异位脂质沉积,从而加重胰岛素抵抗[13],Wang等[14]和Crowe等[15]研究均显示肥胖患者PEDF水平升高,当体重减轻时PEDF水平降低,并伴有胰岛素抵抗减轻。
本研究还发现,初发T2DM患者血浆PEDF与L1~4、股骨颈、全髋骨密度均正相关,血浆PEDF是初发T2DM患者骨密度的独立影响因素。正常人体中成骨细胞主导的骨形成作用与破骨细胞主导的骨吸收作用处于动态平衡,骨代谢平衡异常将引起骨密度的变化[16]。研究显示,成骨细胞、破骨细胞[17]以及软骨细胞[18]均可产生PEDF,PEDF与骨稳态和骨再生密切相关[13],提示PEDF可能参与骨代谢。Quan等[19]和Tombran-Tink等[17]研究均显示PEDF主要集中分布在骺软骨静息区、增生区、上层肥大区的骨基质中,这部分区域是骨形成的活跃区域,提示PEDF在骨形成过程中扮演着重要角色。PEDF促成骨作用可能与以下机制有关:(1)Gattu等[20]发现PEDF可以抑制PPARγ和PGC1α以及激活Wnt/β-catenin信号通路,从而抑制间充质干细胞(mesenchymal stem cells,MSCs)向脂肪细胞分化,促进其向成骨细胞分化,PEDF基因敲除小鼠表现出脂肪含量增加,骨密度减少,进一步表明PEDF可以增加骨密度,对骨质疏松具有保护作用。除了直接诱导MSCs分化,PEDF还可以在缺少MSCs的情况下,诱导附近脂肪细胞向成骨细胞转分化从而促进成骨[21]。(2)骨硬化蛋白是Wnt/β-catenin信号通路以及骨形成的负调节因子[22],临床研究显示使用骨硬化蛋白的单克隆抗体可以增加人体骨密度以及骨强度[23],细胞实验表明使用外源性PEDF可以抑制骨硬化蛋白的表达[24],提示PEDF可以通过抑制骨硬化蛋白从而促进骨形成增加骨密度。(3)碱性磷酸酶(alkaline phosphatase,ALP)是成骨细胞分化和矿化的关键酶,PEDF可以通过提高ALP活性的表达来促进骨形成[20,25],Li等[25]研究显示抑制PEDF合成可导致ALP活性减低,从而抑制骨矿化过程。除了促进骨形成,PEDF还具有抑制骨吸收的功能。RANK-RANKL-OPG通路是与骨吸收密切联系的信号通路,RANKL可由成骨细胞分泌,其与破骨细胞表面受体RNAK结合从而活化破骨细胞,增强骨吸收作用,骨保护素(osteoprotegerin,OPG)是由成骨细胞分泌的作为RANKL的诱饵受体,它可以阻止RANKL与RANK结合从而抑制骨吸收[26]。Akiyama等[27]发现PEDF可以通过促进OPG表达并抑制RANKL表达来抑制骨吸收。
尽管多数研究提示T2DM患者骨密度多正常或增高[28],仍有部分研究显示T2DM患者骨密度降低[29],这些骨密度降低的T2DM患者多年龄偏大且糖尿病病程偏长,T2DM后期骨密度减少是否与PEDF水平减低有关需要未来进一步研究。本研究结果提示PEDF可能是初发T2DM患者骨密度增加的影响因子之一,但是本研究为横断面研究,且样本量较少,需要未来进一步完善。
综上,本研究显示血浆PEDF水平是初发T2DM患者骨密度增加的独立影响因素,PEDF是未来研究T2DM患者骨代谢变化的新靶点,有望成为治疗糖尿病性骨质疏松的新因子。

