丹参及其活性单体成分调控骨质疏松症相关信号通路的研究进展
王伟伟 欧志学 章晓云 李时斌 周毅 李统
1.广西中医药大学附属瑞康医院,广西 南宁 530000 2.桂林市中医医院,广西 桂林 541002
骨质疏松症(osteoporosis,OP)是一种临床上比较常见的骨科疾病,其特征是每单位体积的骨量减少,导致骨强度受损,多见于老年男性和绝经后女性[1]。根据相关流行病学研究显示,预计2050年将有599万例患者因骨质疏松而发生骨折,其医疗支出将超1 745亿元,无论是对个人、家庭还是社会,都将是一个巨大的负担[2]。目前临床上治疗OP多以西药为主,但往往存在费用高等问题。因此,开发低毒安全、价格低廉的药物就成为了目前骨质疏松症研究的一大热点。
丹参又名红根,味苦、微寒、无毒,入心肝血分,是唇形科植物丹参的根及根茎。根据现代研究显示,丹参具有改善微循环、抗氧化、防止血栓等功效[3]。近年来随着中药药理学研究的不断深入,相关人员发现,丹参在促进骨骼生长、愈合的同时,还能有效降低绝经期妇女或老年骨质疏松患者血液中骨吸收生物相关指标[4]。此外,相关基础研究[5-6]也证实,丹参及其活性单体可调节相关骨性细胞增殖、凋亡以及分化。但目前临床治疗上,丹参往往是以复方形式存在,鲜有以单味中药或活性单体形式治疗骨质疏松症,因此,本文欲通过总结近些年来,丹参及其活性成分在治疗骨质疏松症的相关性研究,从而为其基础研究和临床应用提供一些帮助。
1 丹参及其活性成分治疗骨质疏松症的相关性研究
相关研究显示,目前丹参共分离出50余种活性成分,包含水溶性成分:丹参素、丹酚酸、紫草酸等,脂溶性成分:丹参酮Ⅰ、丹参酮ⅡA,丹参酮ⅡB、隐丹参酮等,以及三萜类、黄酮类等其他成分[7]。其中以丹参素、丹酚酸B、丹参酮ⅡA和隐丹参酮为主,因此阐明丹参及其活性成分参与抗OP的机制研究,将更有利于其相关研究的开展,从而推动中医药的现代化研究。
1.1 丹参素
丹参素是一种来自中药丹参的多酚类活性成分,具有抑制细胞凋亡、抗氧化等多种功能[8-9]。目前研究表明[10],丹参素对于去势大鼠的骨质量有着明显的提升作用,是目前OP药物防治领域的一大热点。其中,申健等[11]通过研究发现,丹参素可显著增加大鼠骨形成指标和减小骨吸收指标,从而达到防治OP的作用。机制研究方面,王秉义等[12]通过实验发现,丹参素能激活MC3T3-E1细胞中磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路,从而拮抗成骨细胞凋亡。沙鑫等[13]研究观察到,丹参素可下调磷酸化AKT的表达水平,从而抑制核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)诱导的破骨细胞分化,这可能与不同细胞中丹参素的靶基因不相同有关,而其具体作用机制则有待后续研究进一步探讨。由此可见,笔者认为无论是在促进骨形成还是抑制骨吸收方面,丹参素都能发挥一定作用,值得深入研究,从而为其临床应用提供一些帮助。
1.2 丹酚酸B
丹酚酸B是丹参中一种水溶性单体,其显著的抗氧化作用是丹参药用功效的主要贡献来源[14]。相关研究表明,骨质疏松症患者机体的氧化应激水平要明显高于正常人[15],因此相关学者纷纷将研究重心转移至丹酚酸B减轻细胞氧化损伤的机制研究上。荣彩丽等[16]研究发现,丹酚酸B可恢复因氧化应激所致的成骨特异性转录因子(runt-related transcription factor 2,RUNX2)表达水平下降,从而恢复成骨细胞相关活性。另外,张海龙等[17]研究发现,丹酚酸B可通过激活介导AKT/转录因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)信号通路,增强牙周膜干细胞的抗氧化能力,从而减轻其对后者增殖和成骨分化的损害。
除了抗氧化应激作用,丹酚酸B还可通过其他途径起到抗骨质疏松作用。其中,Zhang 等[18]研究证实,丹酚酸B可通过一氧化氮途径诱导大鼠骨髓间充质干细胞的成骨分化;而刘钰瑜等[19]研究则表明,在地塞米松引起的MC3T3-E1细胞中,丹酚酸B可抑制其Dickkopf Wnt信号通路抑制剂1(dickkopf wnt signaling pathway inhibitor 1,DKK1)mRNA的表达,从而促进骨形成。由此可见,笔者认为丹酚酸B可通过调节相关信号通路,减轻骨性细胞的氧化损伤,并同时促进成骨分化,从而起到治疗骨质疏松的作用。
1.3 丹参酮ⅡA
丹参酮ⅡA是中药丹参中有效的脂溶性成分,具有舒张血管、改善微循环以及抗炎等作用[20]。近些年其在骨质疏松领域的防治作用也逐渐引起相关学者的关注。王玺等[21]研究发现,丹参酮ⅡA可通过促进骨形成和抑制骨吸收,增加废用性骨质疏松症模型大鼠的骨密度。
其中在抑制骨吸收方面,Kim等[22]发现,丹参酮ⅡA能抑制RANKL诱导破骨前体细胞的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、AKT和核转录因子(nuclear factor-κ-gene binding,NF-κB)信号转导通路,从而降低整合素b3和降钙素受体的mRNA表达水平。另外,丹参酮ⅡA还可通过调节成骨细胞增殖与分化,起到防治作用。莫朝论等[23]通过体外实验发现,在一定时间内,适宜浓度的丹参酮ⅡA可促进大鼠成骨细胞增殖,其通过上调骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)的mRNA表达来促进成骨分化。由此可见,无论是在骨形成还是骨吸收过程中,丹参酮ⅡA都有一定的研究价值。
1.4 隐丹参酮
隐丹参酮是一种脂溶性蒽醌类衍生物,具有祛瘀止痛、抗菌抗炎和抗氧化等作用[24]。其在抗骨质疏松领域的作用目前也在被不断挖掘。Lee等[25]通过实验证实,0.5~2.5 μg/mL的隐丹参酮可有效抑制破骨细胞的增殖分化。Wang等[26]在研究中同样发现,炎性环境下,隐丹参酮可通过阻断NF-κB信号通路来抑制破骨细胞生成。
而随着机制研究的不断深入,相关研究发现,NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在隐丹参酮调控破骨细胞过程中发挥着重要作用。张翕等[27]研究发现,隐丹参酮可下调即早基因(c-fos)、组织蛋白酶 K(Cathepsin K)和活化T-细胞核因子(recombinant nuclear factor of activated T-cell cytoplasmic 1,NFATc1)等破骨细胞特异性基因的表达,从而抑制MAPK信号通路诱导破骨细胞生成作用。Wang等[28]研究同样发现,在骨髓源性巨噬细胞中,隐丹参酮可抑制骨髓源性巨噬细胞中破骨形成相关标记蛋白的表达。另外,他们还发现隐丹参酮可减弱RANKL诱导的ERK磷酸化和NF-κB激活。这些结果皆表明,隐丹参酮通过抑制ERK磷酸化和NF-κB激活,抑制RANKL诱导的破骨细胞发生。由此可见,隐丹参酮主要是通过抑制NF-κB和MAPK信号通路来抑制破骨细胞生成,进而抑制骨吸收,最终起到防治作用。
2 丹参及其活性成分治疗骨质疏松症的相关机制
2.1 Wnt/β-catenin信号通路
Wnt/β-连环蛋白(β-catenin)通路是Wnt信号通路中公认的经典通路,可诱导一系列骨代谢和骨发育的重要调节因子表达,以此起到防治骨质疏松的作用。Wnt蛋白与低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein,LRP)/Frizzled受体结合后,通路被激活,其胞质内散乱的蛋白也被相应激活,糖原合成激酶3β(Glycogen synthase kinase-3β,GSK-3β)活性被抑制,从而阻碍β-catenin与细胞支架蛋白(Axin)、GSK-3β以及大肠腺瘤样息肉蛋白(APC)结合形成β-catenin降解复合物,而后β-catenin进一步磷酸化,导致胞内游离β-catenin增多,其达到阈值后会向核内转移并与TCF/LEF转录复合物结合,激活相关靶基因,从而促进成骨细胞增殖分化及抑制其凋亡。
其中,丹参素和丹酚酸B皆已被证实,可通过调节Wnt/β-catenin信号通路来促进成骨细胞分化。Cui等[29]研究表明,丹酚酸B和丹参素可抵抗糖皮质激素诱导的间充质干细胞中DKK1表达和促进β-catenin表达。另外,闫小飞等[30]研究通过丹参素干预成骨细胞发现,后者细胞核内β-catenin表达量要明显高于对照组,并通过抑制该通路,进一步证实丹参素能通过调节Wnt/β-catenin通路来促进成骨细胞分化。由此可见,Wnt/β-catenin信号通路促进成骨细胞增殖分化的调控机理,在丹参及其活性单体治疗骨质疏松症的过程中发挥着重要作用。但由于目前有关文献仍较为欠缺,因此还需后续研究进一步补充及深入探讨(图1)。
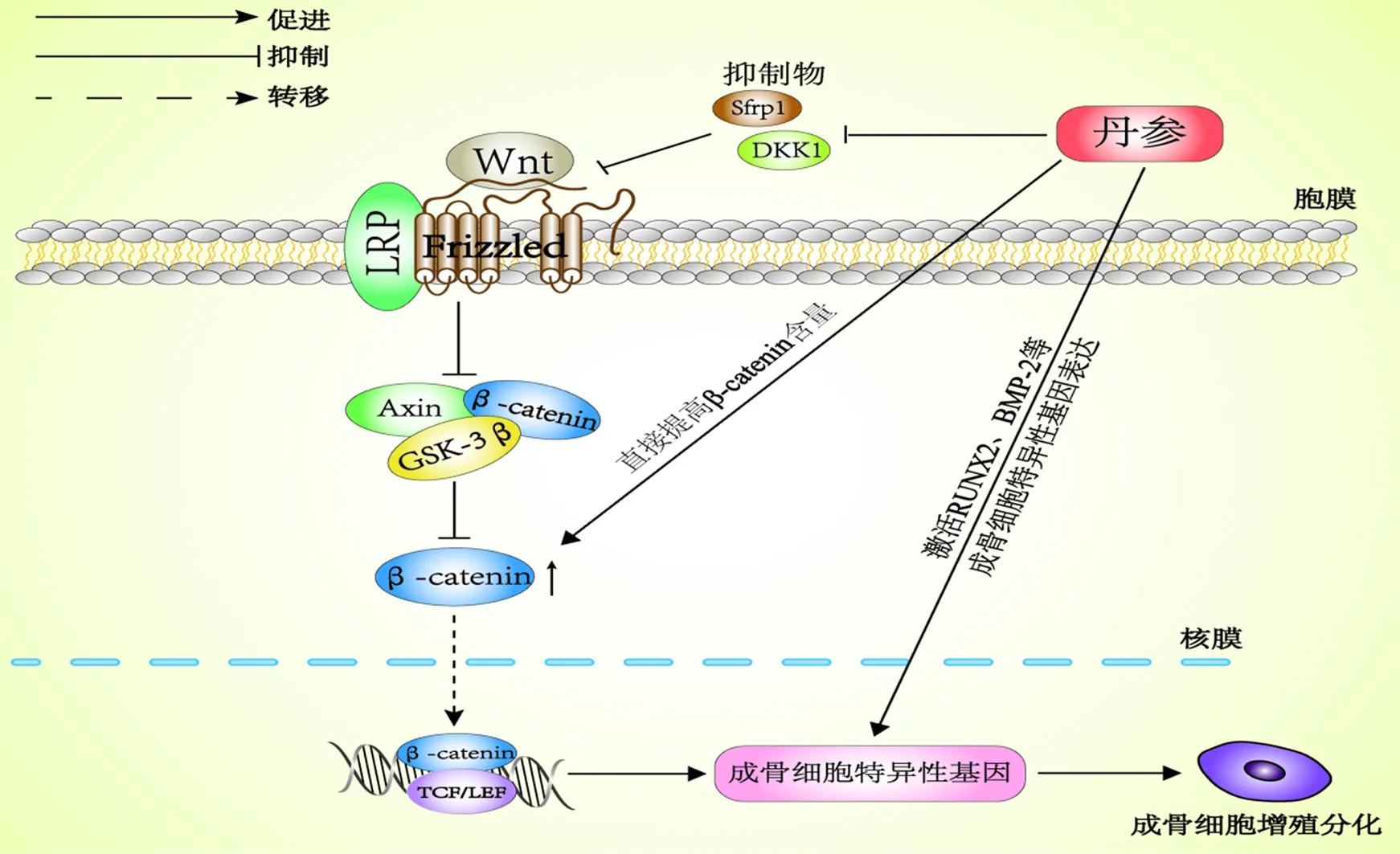
图1 丹参及其活性单体介导Wnt信号通路抗骨质疏松的作用机制Fig.1 Anti osteoporosis mechanism of Wnt signaling pathway mediated by salvia miltiorrhiza and its active monomers
2.2 OPG/RANKL/RANK轴
骨保护素(osteoprotegerin,OPG)/RANKL/核因子κB受体激活因子(receptor activator of nuclear factor Kappa B,RANK)轴是近年来破骨细胞领域中研究较为广泛的一种传导机制。RANKL是诱导破骨前体细胞分化的重要细胞因子,由骨基质细胞和成骨细胞产生,与RANK相结合后,可增强破骨细胞活性从而促进骨吸收[31]。而RANK是RANKL的最主要受体,常见于破骨细胞的胞膜上。OPG则为RANKL的另一种受体,可竞争性结合RANKL来阻断RANK/RANKL信号通路的传递[32]。而肿瘤坏死因子受体相关蛋白6(tumer necrosis factor receptor-associated factor 6,TRAF6)、NF-κB以及MAPK是RANKL/RANK轴的中下游信号位点,当RANKL与RANK结合后,刺激信号会以级联反应方式沿着这些信号位点传递至NFATc1,而在破骨细胞分化的最后阶段,NFATc1与c-Fos/c-Jun二聚体结合共同转录破骨细胞特异性基因,最终调节破骨细胞分化。
Wang等[33]通过实验发现,在脂多糖诱导的破骨细胞中,丹酚酸B镁可抑制RANKL、c-Src等表达,表明丹酚酸B通过抑制RANKL/RANK传导途径,抑制破骨细胞生成。张晓燕等[34]研究则发现,丹参素能够通过调控OPG-RANKL-RANK轴,抑制破骨细胞活性;并在后续研究中发现,丹参素可同时增加OPGmRNA和蛋白的表达,从而促进成骨细胞增殖[35]。由此可见,丹参及其活性单体可通过调控OPG-RANKL-RANK轴,抑制RANKL在破骨细胞中的信号传导来抑制破骨细胞生成,最终起到治疗骨质疏松症的作用(图2)。
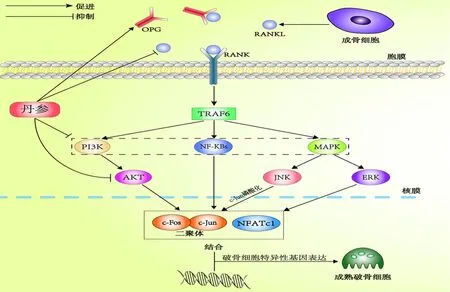
图2 丹参及其活性单体介导OPG/RANKL/RANK轴抗骨质疏松的作用机制Fig.2 Mechanism of anti osteoporosis of OPG/RANKL/rank axis mediated by salvia miltiorrhiza and its active monomers
2.3 MAPK信号通路
MAPK是一类丝裂原活化蛋白激酶,可将细胞外的刺激信号转导至细胞内,从而引起不同的细胞反应。其主要有4条分支路线,其中与防治OP联系密切的主要为ERK、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)及p38/MAPK三条分支[36-37]。而目前已有研究证实,丹参及其活性单体可通过调控MAPK信号通路来防止骨量流失。
夏庆泉等[38]发现,丹参注射液可通过激活ERK1/2传导途径,促进成骨细胞增殖分化。Xu等[39]研究则显示,丹酚酸B对骨髓间充质干细胞无明显毒性作用,并且可显著提高骨髓间充质干细胞碱性磷酸酶(alkaline phosphatase,ALT)活性、骨桥蛋白(osteopontin,OPN)和RUNX2表达,从而证实了丹酚酸B可通过激活ERK信号通路促进骨髓间充质干细胞成骨分化。除此之外,Cheng等[40]通过实验发现,丹参酮ⅡA还能抑制RANKL诱导MAPK通路激活,导致破骨相关标志物cathepsin K、TRAF6、基质金属蛋白酶9(matrix metallopeptidase9,MMP9)和NFATc1的表达降低,从而抑制破骨细胞分化和生成。由此可见,丹参及其活性单体可通过调控MAPK信号通路的ERK分支,来保护骨髓间充质干细胞及促进其成骨分化,并同时促进成骨细胞分化和抑制破骨细胞生成,最终起到防治OP的作用(图3)。
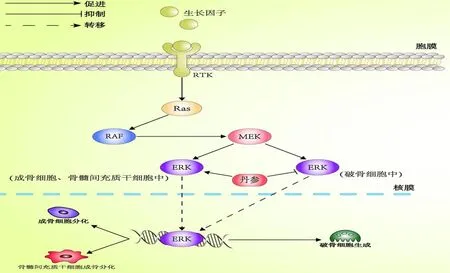
图3 丹参及其活性单体介导MAPK信号通路抗骨质疏松的作用机制Fig.3 Anti osteoporosis mechanism of MAPK signaling pathway mediated by salvia miltiorrhiza and its active monomers
2.4 NF-κB信号通路
NF-κB信号通路可通过影响破骨细胞生成及活化,从而在骨质疏松症的防治过程中发挥重要作用。静息状态下,p50或者p65以与核因子κB抑制因子A(recombinant inhibitory subunit of NF Kappa B Alpha,IκBα)形成共聚体的形式存在于胞质内,而在外界相关信号如脂多糖、RANKL等刺激下,IκBα磷酸化并进行降解,使得p50或者p65进入细胞核内,从而促进破骨细胞生成以及活化相关因子的转录[41]。而目前相关研究已证实,丹参及其活性单体可通过调控NF-κB信号通路来调节骨性细胞的生物活性。王丽丽等[42]研究通过丹酚酸B干预小鼠后发现,丹酚酸B可有效降低NF-κB-p65和Cathepsin K的表达,改善干预组小鼠牙槽骨骨密度下降,并且发现丹酚酸B可有效改善高脂饮食所导致的氧化应激,最终防止小鼠牙槽骨骨质流失。洪瑛等[43]研究则表明,丹参酮ⅡA可抑制重组人白介素1(IL-1beta protein,IL-1β)诱导的软骨细胞中TRAF6、p65以及p-p65的表达,通过抑制NF-κB信号通路,从而改善IL-1β对软骨细胞的炎性损伤。由此可见,丹参及其活性抗体可通过调控NF-κB信号通路,改善机体氧化应激损伤以及软骨细胞的炎性损伤,并同时抑制破骨细胞生成,从而防止机体的骨质流失。但目前在抗骨质疏松领域中,丹参及其活性单体调控NF-κB通路的相关性研究较少,这有待后续研究进一步探讨(图4)。
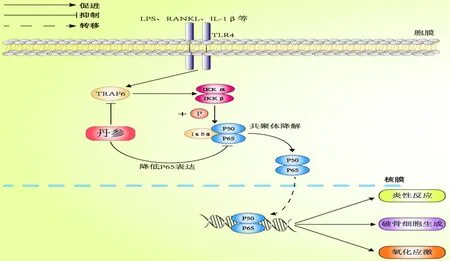
图4 丹参及其活性单体介导NF-κB信号通路抗骨质疏松的作用机制Fig.4 The anti-osteoporosis mechanism of NF-κB signal pathway mediated by salvia miltiorrhiza and its active monomers
2.5 PI3K/AKT信号通路
PI3K/AKT作为机体内关键的信号转导途径,已被证实在多种生物学过程中发挥着重要作用[44]。PI3K在受到上游激活信号后,其胞膜上的磷脂酰肌醇4,5(phosphatidylinositol-4,5-bisphos-phate,PIP2)会转化成第二信使磷脂酰肌醇3,4,5-三磷酸(phosphatidylinositol-3,4,5-bisphosphate,PIP3),并作用于靶基因AKT,PIP3与AKT相结合,活化AKT[45],传递信号至下游效应分子,进而调节下游多种激酶,影响细胞的分化和代谢效果,最终对骨质疏松起到防治作用。
其中,李汪洋等[46]研究发现,紫草酸能通过上调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和p-Akt,下调Bax,从而缓解H2O2诱导的骨髓间充质干细胞凋亡。曹慧敏等[47]研究则发现,丹参酮ⅡA可降低内皮细胞中丙二醛的含量,增强超氧化物歧化酶的活性,促进其自噬,并同时检测细胞中PI3K、AKT以及p-雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)的表达,从而表明丹参酮ⅡA可通过调节PI3K/AKT促进自噬,对内皮细胞氧化应激损伤起到一定的保护作用。孟如丹等[48]亦通过实验证实,丹参酮ⅡA可通过抑制PI3K/AKT信号通路,抑制软骨细胞的炎症反应,从而对IL-1β诱导的软骨细胞起到保护作用。除此之外,林院等[49]研究发现,丹酚酸B可通过激活PI3K/AKT信号通路,上调 OPN、ALP和骨钙蛋白(osteocalcin,OCN)表达,从而刺激MC3T3-E1细胞成骨分化。由此可见,丹参及其活性单体可通过调控PI3K/AKT信号通路,影响相关骨性细胞的增殖、凋亡、自噬、抗氧化以及炎症反应,从而起到防治骨质疏松的作用(图5)。

图5 丹参及其活性单体介导PI3K/AKT信号通路抗骨质疏松的作用机制Fig.5 Anti osteoporosis mechanism of PI3K/Akt signaling pathway mediated by salvia miltiorrhiza and its active monomers
3 总结与展望
目前有关丹参防治OP的研究较为零散,多数仅仅局限于某个活性单体在某种骨性细胞上的作用,而中医治疗具有多靶点、多途径的特点,因此本文通过总结近年来丹参及其活性单体在该领域的相关研究,从整体方面来对丹参的抗骨质疏松机制进行探讨。并通过总结发现,丹参及其活性单体相对西药毒性较小,其主要通过调控Wnt/β-catenin、OPG/RANKL/RANK、NF-κB、PI3K/AKT信号通路以及MAPK信号通路的ERK分支,促进骨形成、抑制骨吸收,从而发挥抗骨质疏松的作用。并且还发现,丹参及其活性单体调控骨性细胞氧化应激反应是其抗骨质疏松的另外一种重要方式。
相关研究表明[50],氧化应激会导致成骨细胞体内产生过多的活性氧,进而抑制其分化,成骨细胞数量减少使得骨质流失加速;同时,氧化应激与前体破骨细胞内抗氧化酶、谷胱甘肽水平降低以及NADPH氧化酶的激活有关,激活前体破骨细胞分化,从而增强骨吸收[51]。由此可见,进一步深化丹参抗氧化与骨代谢平衡之间的机制研究,将对今后中医药抗骨质疏松具有重要意义。除此之外,本文还发现该领域的研究现状存在如下问题,目前有关研究多集中于丹参素、丹酚酸B 、丹参酮ⅡA、隐丹参酮等几种活性单体,其余成分研究较少,且目前调控机制研究的有关验证也略显不足,这都有待后续研究进一步探讨与完善。
但总体来说,在促进骨形成和抑制骨吸收,尤其是在改善骨性细胞氧化应激损伤方面,丹参及其活性单体具有一定的研究前景,相关中药通过改善骨性细胞氧化应激损伤也将是今后中医药抗骨质疏松研究的一种新思路。

