补骨脂盐炙前后对去卵巢大鼠的骨保护作用及其机制
许妍 吴育,2 谢辉 华政颖 颜翠萍 殷放宙 李伟东*
1.教育部中药炮制规范化及标准化工程研究中心,南京中医药大学,江苏 南京 210023 2.南通市中医院,江苏 南通 226000 3.泰州市药品检验所,江苏 泰州 225300
骨质疏松症是一种系统性骨骼疾病,其特征为骨密度降低和骨微结构破坏[1]。临床上常用的抗骨质疏松药主要有基本补充剂、抑制骨吸收药和促进骨形成药这几大类。然而目前这些药物疗效有限,同时伴有许多不良反应[2]。
补骨脂(PsoraleacorylifoliaL.)有补肾壮阳、温脾止泻之效,临床常用于治疗骨性疾病和白癜风等皮肤病,在中国和亚洲其他国家已有数百年的使用历史[3]。中医临床常将补骨脂盐炙后入药,根据传统的中药炮制“盐炙入肾”理论,盐炙可以引药下行,促进中药成分进入“肾经”,增强其温肾作用[4],而“肾主骨”“肾充则髓实”。因此,“补肾益髓”的基本治则在中医骨科临床上得到广泛应用[5]。
实验从补骨脂临床实际用药出发,采用传统水煎剂给药,比较补骨脂生品、盐品抗骨质疏松作用的同时,分析补骨脂盐炙前后化学成分在体内外的变化,探究其炮制机理。
1 材料与方法
1.1 样品准备
补骨脂购于北京同仁堂(产地:四川,批号:180501)。补骨脂盐品按照《中华人民共和国药典》(2015版 Ⅳ部) 的指导原则进行加工。
生品和盐品打粉,过筛。分别称取粉末500 g,加入5 000 mL蒸馏水提取1 h,过滤,浓缩,补骨脂调整最终浓度为0.2 g/mL。
1.2 动物
SPF级雌性SD大鼠(合格证:20180004033817;伦理审查编号:201903A011),体重220~260 g,由南京中医药大学实验动物中心提供。
1.3 去卵巢大鼠模型的建立
40只大鼠随机分为4组:假手术组(Sham)、去卵巢(OVX)组、生品组和盐品组。
大鼠麻醉,于脊柱两侧做纵向切口,切去双侧卵巢。假手术组:打开腹腔后仅切除卵巢附近大小相近的一团脂肪组织,保留完整卵巢。
1.4 给药及样本采集
术后4周,给药组每天分别以0.4 g/200 g体重(约人临床用药剂量的2倍)补骨脂生、盐品灌胃,其余两组给予生理盐水。12周后记录大鼠体重,采集血液、子宫、股骨和胫骨。
1.5 血清生化标志物的检测
ALP、Ca、P采用生化试剂盒检测(Beyotime,上海,中国);OC、E2用ELISA试剂盒检测(南京建成生物工程研究所,南京,中国)。
1.6 生物力学强度的测试
每组随机抽取右侧的股骨和胫骨样本(n=5)进行三点弯曲实验(Instron 5566;Instron Corp., USA)。
1.7 骨密度测量
每组随机抽取左侧股骨和胫骨样本(n=5),用小动物骨密度测试软件(Region High Resolution,Version 4076;HOGIC)测定左侧骨远端的骨密度。
1.8 Micro-CT 骨微结构分析
每组随机抽取左侧股骨样本(n=5)进行CT扫描(CT-Sharp,ZKKS-MCT,中国,ZKKS-MCT)。
1.9 补骨脂含药血清的制备
30只大鼠随机分为3组:对照组、补骨脂生品、盐品组。给药组每天分别以0.4 g/200 g体重灌胃,对照组给予生理盐水。第7天给药2 h后,取血。血样于室温静置1 h,3 600 r/min,10 min,取上清。将收集到的血清于56 ℃,灭活30 min,保存于-80 ℃。
1.10 成骨细胞增殖及代谢的血清生化标志物测定
从刚出生的Wistar大鼠颅骨上提取成骨细胞并培养。种板24 h后,分别加入5%、10%、20%的补骨脂生、盐品的含药血清和空白血清,继续孵育12、24、48 h后检测细胞增殖率和培养液中ALP活性。每个实验独立进行3次。
1.11 补骨脂生、盐品主要有效成分的体内外含量测定
1.11.1体外水煎液含量测定:取生、盐品粉末各0.5 g,加50 mL水提取1 h。过滤并蒸发溶剂,甲醇复溶,转移至10 mL容量瓶中,定容。平行3份。
用高效液相色谱(HPLC)测254 nm处成分含量 (Waters e2695 2998 UV,USA)。色谱柱:Hypersil ODS2 (250 mm×4.6 mm,5 μm);流动相:水(A),甲醇(B) and 乙腈(C)。
1.11.2大鼠体内含药血清测定:每组随机抽取5份血清,加入甲醇和内标,涡旋3 min,12 000 r/min,5 min,取上清,氮气吹干,加甲醇复溶,混匀3 min,12 000 r/min,5 min,取上清用UPLC-Triple Quad 5500进行分析。
正离子模式的电喷雾电离源;色谱柱:Extend C18 (Agilent,USA,2.1 mm×100 mm,1.8 μm);流动相:0.1%甲酸(A)和乙腈(B)。
1.12 统计学处理
使用SPSS 25.0软件(SPSS Inc., Chicago, USA)进行统计分析。
2 结果
2.1 体重和子宫指数的测定
如图1A所示,OVX组的体重明显高于假手术组(P<0.01);给药后大鼠体重明显下降,生、盐品之间没有显著性差异(P>0.05)。图1B显示,OVX组子宫指数[子宫重量(mg)/体重(g)]远低于假手术组(P<0.01),给予补骨脂生品后,子宫指数上升(P<0.05),盐品组的子宫指数有上升趋势,但差异无统计学意义(P>0.05)。

图1 各组大鼠体重(A)和子宫指数(B)的变化(*P<0.05,**P<0.01)Fig.1 Changes on body weight (A) and uterus index (B) of rats (*P<0.05, **P<0.01)
实验结果提示,去卵巢之后,大鼠体内激素紊乱,机体负反馈调节,导致食欲增大,体重代偿性增加,而补骨脂抑制了去卵巢引起的体重代偿性增加,生、盐品作用相当。同时由于雌激素减少,子宫功能受到影响,子宫萎缩甚至功能消失,子宫指数降低,补骨脂生品可以刺激子宫,明显增加子宫重量,而盐品也有同样的作用趋势,但趋势不明显。
2.2 补骨脂对OVX大鼠血清生化标志物的影响
如表1所示,OVX组血清生化指标均有显著变化(P<0.01),而补骨脂在一定程度上逆转了OVX诱导的各种病理性变化。生、盐品对各生化指标的影响相同,无显著性差异(P>0.05)。
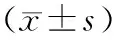
表1 各组大鼠血清生化指标变化Table.1 Changes in serum biochemical indexes of the rats in each group
2.3 补骨脂对OVX大鼠骨密度的影响
如图2所示,OVX大鼠的股骨和胫骨的骨密度均明显低于假手术组(P<0.01),给药后大鼠的骨密度显著增加,且补骨脂生、盐品对骨密度的影响相似,无显著差异(P>0.05)。

图2 各组大鼠股骨(A)和胫骨(B)骨密度变化(*P<0.05, **P<0.01)Fig.2 Changes on BMD of femur (A) and tibia (B) of rats (*P<0.05, **P<0.01)
2.4 补骨脂对OVX大鼠生物力学强度的影响
如表2所示,与假手术大鼠相比,OVX组的股骨和胫骨的最大载荷和杨氏模量显著降低。补骨脂盐品能显著增加股骨和胫骨的最大载荷(P<0.01),而生品有增加骨最大载荷的趋势,但作用不明显(P>0.05)。补骨脂生、盐品均可以增加股骨和胫骨的杨氏模量,两者对胫骨的影响作用相同,没有显著差异(P>0.05),但对股骨的影响有差异,盐品对股骨的作用优于生品(P<0.05)。
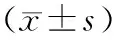
表2 各组大鼠的骨生物力学强度变化Table.2 Changes in biomechanical strength of bone of the rats in each group
2.5 补骨脂对OVX大鼠骨小梁微结构的影响
各组股骨干骺端骨小梁的3 D结构图像如图3所示。结果显示,补骨脂给药后,小梁微结构明显改善。与假手术组相比,OVX组骨小梁较薄,断裂较多。生品组和盐品组骨小梁网比OVX组多,断裂减少。
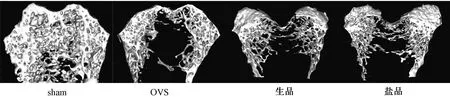
图3 各组大鼠的骨小梁微结构Fig.3 Bone trabecular microstructure of the rats in each group
2.6 补骨脂含药血清对大鼠成骨细胞增殖和分化的影响
补骨脂含药血清孵育12 h和24 h对细胞增殖无明显影响(数据未显示)。在图4A中,各浓度含药血清作用48 h后均显示出明显的细胞增殖活性,在相同浓度下,补骨脂盐品的含药血清对成骨细胞的增殖作用优于生品(P<0.05)。随着含药血清浓度的增加,成骨细胞增殖率有上升的趋势,但趋势不明显,无显著差异(P>0.05)。
如图4B所示,5%、10%和20%的补骨脂盐品含药血清均可显著增加ALP活性,促进成骨细胞分化,而补骨脂生品含药血清仅在中、高浓度时才对ALP活性有影响,低浓度时无明显作用(P>0.05)。生、盐品含药血清对ALP活性的影响与其浓度呈正相关(P<0.01),含药血清浓度越高,ALP活性越大。
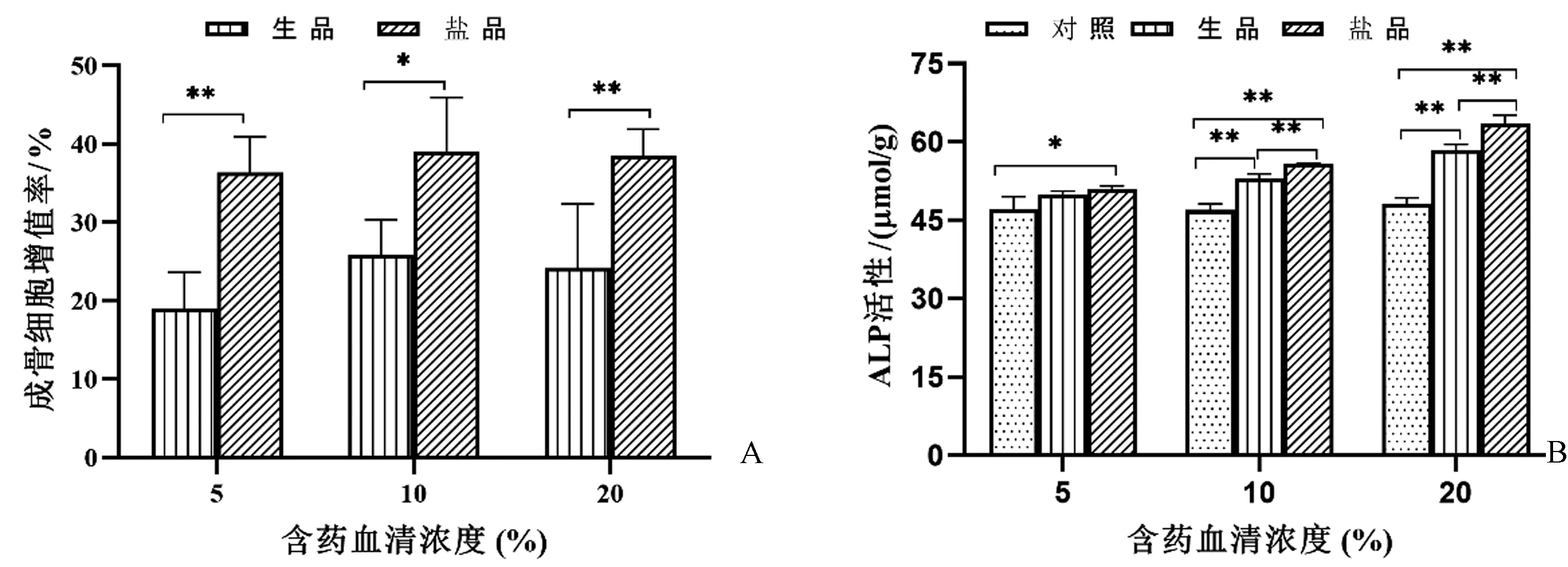
图4 补骨脂含药血清对成骨细胞增殖(A)和ALP活性(B)的影响(*P<0.05, **P<0.01)Fig.4 Effect of drug-containing serum on proliferation (A) and ALP activity (B) of osteoblasts (*P<0.05, **P<0.01)
2.7 补骨脂中主要有效成分体内外含量测定
补骨脂中主要有效成分补骨脂素、异补骨脂素及其苷类成分的体内外含量测定结果见表3。盐炙后,补骨脂水煎液中苷类成分含量高于生品(P<0.01),而相应的苷元含量减少(P<0.01),而且补骨脂盐品水煎液中的苷和苷元的含量总和大于补骨脂生品。补骨脂盐品含药血清中补骨脂素和异补骨脂素含量显著高于补骨脂生品(P<0.01)。
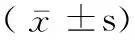
表3 补骨脂中主要有效成分体内外含量测定结果Table.3 Contents of main active components in psoralea corylifolia L. in vitro and in vivo
3 讨论
本实验中,OVX大鼠体重增加,子宫萎缩,BMD降低、骨骼变脆、结构受损,雌激素下降以及血清生化指标水平紊乱等一系列变化均与临床绝经期妇女骨质疏松的症状一致[6]。而补骨脂生、盐品均可在不同程度上逆转由去卵巢引起的大鼠体内外各种生化指标及骨骼的变化,降低去卵巢对大鼠的影响,表现出一定的抗骨质疏松作用,且补骨脂生、盐品的含药血清均可以促进成骨细胞增殖和分化,促进骨基质的分泌,加速骨形成。
盐炙前后的补骨脂治疗骨质疏松的效果和机制均很相似,但总体而言,补骨脂盐品在诸多指标上的作用均优于生品。补骨脂盐品增加骨硬度和骨韧性的效果显著,促进成骨细胞增殖和分化的作用也明显优于生品。绝经期骨质疏松症的主要原因就是体内雌激素减少,不足以抑制破骨细胞活动,骨合成减少,最终导致骨量减少,骨脆性增加,骨折风险也随之增加[7]。这意味补骨脂盐品在促进成骨细胞增殖和分化,从根源上治疗骨质疏松的同时,还可以增加骨硬度和骨韧性,降低骨折风险,在“对症”和“对因”两个方面均优于生品。
补骨脂盐炙前后的主要有效成分的煎出含量存在差异,吸收入血的有效成分含量也存在差异。补骨脂盐炙增效,增加其抗骨质疏松作用的机制可能有:(1)盐炙过程杀酶保苷,破坏了酶的活性,从而保留了补骨脂苷、异补骨脂苷等苷类成分[8-9]。而苷类成分易于煎出,吸收入血后又可被代谢成为相应的补骨脂素、异补骨脂素等苷元[10],导致含药血清中药效成分含量的高于生品,从而提高了疗效;(2)盐炙促进补骨脂中有效成分吸收和代谢,增加其生物利用度[11];(3)“盐炙入肾”,即盐炙可以引药下行,专入肾经,促进补骨脂中药效成分吸收入肾[12],而“肾主骨”“肾充则髓实”,骨的生成、发育和强弱与肾息息相关,从而达到盐炙增效的目的[13]。
然而,补骨脂在临床使用也存在较多的不良反应报道[14],不能忽略其临床毒性,如肝、肾和光毒性。补骨脂的毒性作用与剂量具有一定相关性,试验中补骨脂剂量越大,毒性程度越明显[15]。炮制[16]和配伍[17]在一定程度上也可以降低补骨脂的毒性。中医临床用药讲究的是君、臣、佐、使相辅相成,对中药毒性的研究应综合、科学地进行整体评判[18]。
综上所述,补骨脂生、盐品均可促进大鼠成骨细胞增殖和分化,加速骨形成,具有较好的抗骨质疏松作用。而盐炙可以增加补骨脂有效成分补骨脂苷、异补骨脂苷等苷类成分的煎出和补骨脂素、异补骨脂素等苷元成分的吸收入血,增强了补骨脂盐品抗骨质疏松的疗效。

