非同步校准QCT测量腰椎骨密度的长期体内可重复性评估
杨洁 温磊 张玉巧 程晓光 王玲 高波 宋玲玲 冉利梅 黄曌殊 朱霞 焦俊 杜霞*
1.贵州医科大学附属医院影像科,贵州 贵阳 550004 2.贵州医科大学,贵州 贵阳 550025 3.北京积水潭医院放射科,北京 100035 4.贵州医科大学附属医院妇科,贵州 贵阳 550004
骨质疏松症是一种常见疾病,以骨密度(bone mineral density,BMD)减低和骨组织微结构退化为特征,随之带来高骨折风险、高发病率、高死亡率和巨大的医疗经济负担,威害人民健康[1-2]。骨质疏松症的早期诊断主要依赖BMD检查,其中,定量计算机断层扫描(quantitative computed tomography,QCT)能分别测量皮质骨和小梁骨,不受测量部位退行性改变、椎体畸形、周围软组织钙化的影响,具有明显优势[3]。非同步校准QCT(asynchronous calibration QCT)是基于传统QCT新开发的一种BMD测量工具,其也利用了同步QCT所用的体模标准质量保证(quality assurance,QA)扫描。因其校准方程从QA扫描中获得,故不需要在患者进行CT扫描的同时扫描体模,对常规腹部和(或)肺部CT扫描的图像也能进行BMD评估,使BMD检查实现机会性筛查,减少不必要的电离辐射,也有助于识别有骨折风险的患者,在我国应用前景广阔[4-6]。精密度是指诊断技术的可重复性或再现性,临床上,对BMD连续变化的监测是决策骨质疏松病人治疗时机及疗效评估的主要指标,确定其实际精密度至关重要[7-8]。目前,针对QCT短期精密度误差( precision error,PE)的研究在国内外已有较多报道,大部分研究[9-11]结果显示,QCT测量BMD的短期精密度误差值较小,可重复性好。然而,与其他医学参数相比,BMD随时间的可量化变化很小,临床随访监测间隔时间较长,BMD测量系统必须在长时间间隔内保持稳定,其结果才更适合反映临床实践中的真实情况[9,12]。然而国内外针对QCT长期体内可重复性及其长期随访价值的研究较少,故本研究旨在通过比较526名患者在大约1年的时间间隔内进行两次非同步校准QCT检查的腰椎BMD值,以评估非同步校准QCT测量腰椎BMD的长期体内可重复性,并探讨其临床意义。
1 材料与方法
1.1 样本资料
共有526名来自贵州医科大学附属医院体检中心的健康体检者(其中女性225名,男性301名)纳入本研究,年龄29~59岁,平均年龄(50.6±5.4)岁。从2018年6月至2019年12月约1年的时间内,所有受试者均自愿接受了2次腰椎QCT骨密度检查,并签署知情同意书,仅对受试者的CT图像数据进行分析。纳入标准:①年龄小于60岁的成年人;②在同一台CT机上接受了2次非同步校准QCT骨密度检查,时间间隔≥1年。排除标准:①暴力创伤或骨质疏松所致椎体骨折者;②患有可能影响BMD及代谢的慢性疾病者;③服用过可能影响BMD及代谢的药物或激素者;④有内固定手术史者。根据国际临床骨密度学会(International Society for Clinical Densitometry,ISCD)及美国放射学会(American College of Radiology,ACR)QCT骨质疏松诊断标准[13],按BMD绝对值>120 mg/cm3、80~120 mg/cm3、< 80 mg/cm3将受试者分为3组,即骨量正常组、低骨量组、骨质疏松组,两次测量BMD值分组不一致时按其平均值分组。
1.2 方法
1.2.1扫描方法及设备:采用日本日立32排Supria螺旋CT扫描仪,在扫描床中心位置放置美国Mindways公司的QCT Model 4非同步校准体模,开机扫描前使用校准体模在扫描仪定位线引导下调整QCT体模位置并由此确定床高,扫描体模为参照;因非同步QCT扫描与胸部CT扫描同时进行,故扫描条件遵守胸部CT扫描协议。被检查者除去所有金属异物及高密度物体,仰卧于扫描床正中间、双手抬高放置于额头,扫描参数及模式一致,扫描范围为肺尖至第三腰椎(L3)上缘,采取吸气末单次屏气扫描。扫描参数:管电压120 kV,mAs自动,像素0.78 mm2,FOV400 mm,螺距0.8 mm,矩阵512×512。扫描后将原始数据采用B30 medium smooth软组织算法进行重建,将层厚1.25 mm、层间隔1.25 mm的重建图像Dicom格式传输至QCT Pro后处理工作站(Mindways Software Inc., Austin, TX, USA) 进行腰椎BMD测量,所有患者的2次BMD测量均由同1名接受培训后的影像科住院医师完成。
1.2.2设备质控:每周在QCT Pro后处理工作站进行相应测量前均用QA进行常规校准,系统运转质量控制操作后再进行BMD测量。CT扫描设备由技术人员按照CT机操作手册按周期进行常规质量控制,2次扫描间隔期间未更换CT扫描仪或任何硬件设备,CT机未进行大检修。
1.2.3BMD测定方法:将扫描结果传送至QCT Pro后处理工作站,应用QCT PRO Version 6.1 软件中“New 3 D Spine Exam Analysis”工具进行BMD测量,根据软件自动程序分别对腰1、腰2(L1、L2)椎体中央松质骨区域进行测量,将黄色十字键分别于横轴位、矢状位、冠状位放置于椎体中央(图1),感兴趣区(region of interest,ROI)由软件自动勾画,必要时,测量者可根据受试者椎体形态手动进行适当调整,将ROI尽可能放置于椎体中间层面,避开骨皮质、椎后静脉丛、骨岛等(图2)。各椎体BMD值均由软件自动算出(单位mg/cm3),并取L1、L2椎体平均值作为BMD参考值。
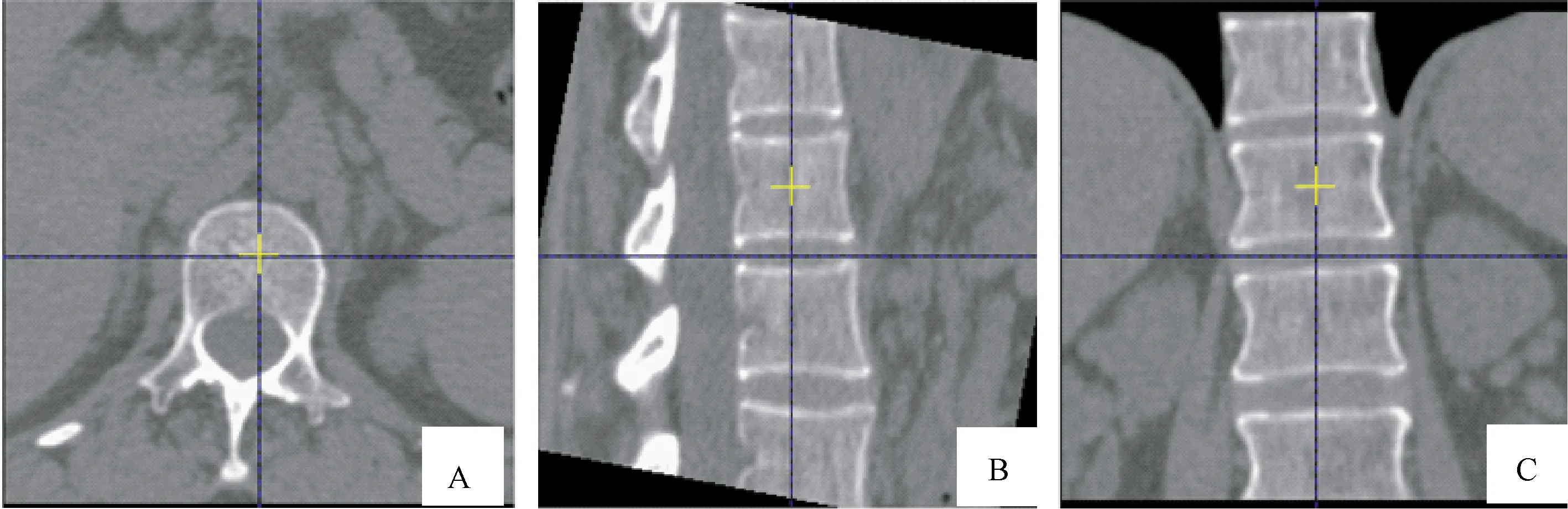
图1 QCT后处理软件QCT Pro对 L1椎体进行BMD测量示意图(黄色十字键放置于椎体中央)Fig.1 The QCT post-processing software QCT Pro measures the bone density of the L1 vertebral body(The yellow cross key is placed in the center of the vertebral body)注:A:横轴位;B:矢状位;C:冠状位。
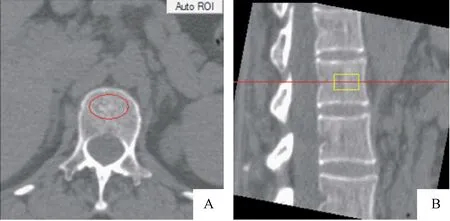
图2 QCT后处理软件QCT Pro对 L1椎体进行BMD测量示意图(红圈为ROI)Fig.2 The QCT post-processing software QCT Pro measures the bone density of the L1 vertebral body注:A:横轴位;B:矢状位。
1.3 评价指标
根据公式1、2分别计算每位受试者的标准差(SD)、变异系数(CV);总体PE用标准差的均方根(RMS-SD)和变异系数的均方根(RMS-% CV)表示(公式3、4)。
(1)
(2)
(3)
(4)
(5)
其中Z’为预计达到的可信度水平,PE为精密度误差,n1为初诊测量次数,n2为随访测量次数[12,14]。
1.4 统计学方法
采用SPSS 25.0统计软件进行数据分析及图表制作。采用Kolmogorov-Smirnov 检验分析计量资料的正态性,计量资料用平均值±标准差表示,组间比较采用Kruskal-Wallis检验,P<0.05为差异有统计学意义。
2 结果
2.1 研究对象基本情况及腰椎BMD年变化率
研究对象基本情况见表1。将研究对象以5岁为一个年龄段分组后对BMD值随增龄的变化进行计算,BMD峰值出现在40~44岁、29~39岁组时,腰椎BMD每年增加约0.15 %,40岁以后平均每年下降约1.44 %(表2)。

表1 研究对象基本情况及BMD值Table.1 The basic situation and BMD value of the study

表2 腰椎每年BMD变化Table.2 BMD changes of lumbar spine every year
2.2 非同步校准QCT测量腰椎BMD精密度误差分析
使用非同步校准QCT测量腰椎BMD的PE结果见表3,因骨质疏松组样本量较少(n=15),不能满足PE分析中最小自由度30[14],故不对骨质疏松组PE进行分析。因本次精密度分析间隔时间较长,而人体BMD值随增龄有所变化,故整体PE结果经年变化率对BMD值进行校正后计算,RMS-% CV=2.57 %,RMS-SD=3.14 mg/cm3。低骨量组PE值较骨量正常组高,整体PE值介于两者之间(图3)。组间比较结果显示,不同组间变异系数差异有统计学意义,而不同组间标准差差异无统计学意义(表4)。
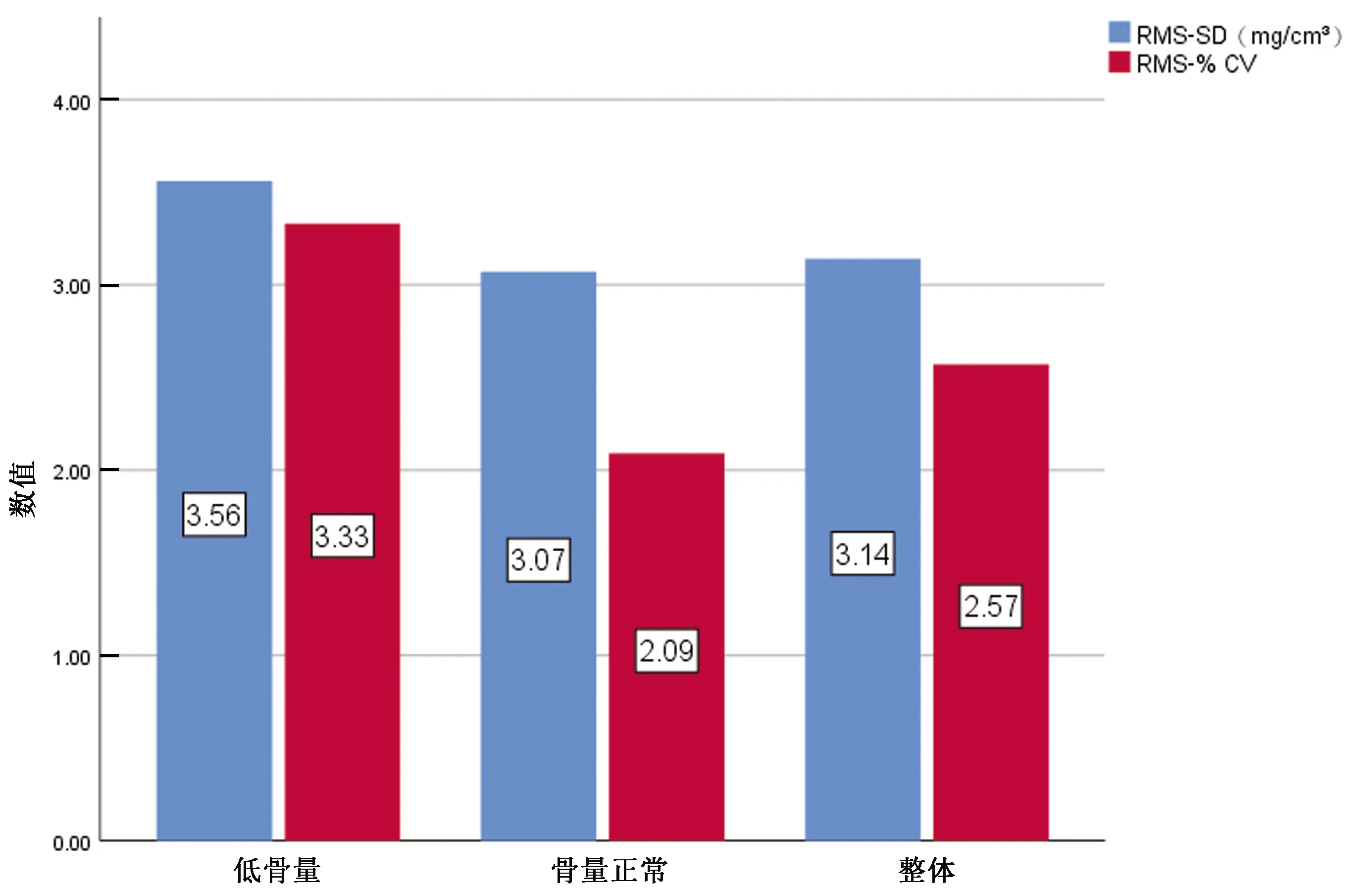
图3 不同组别及总体的标准差均方根(RMS-SD)及变异系数均方根(RMS-%CV)Fig.3 The standard deviation root mean square (RMS-SD) and root mean square coefficient of variation (RMS-%CV) in different groups

表3 非同步校准QCT测量腰椎BMD精密度误差分析Table.3 Precision errors of lumbar spine measured by asynchronous calibration
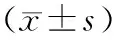
表4 不同组间标准差和变异系数的比较Table.4 Comparison of standard deviation and coefficient of variation in different
3 讨论
本研究采用526例健康体检者的2次腰椎BMD测量值分析了非同步QCT测量腰椎BMD在较长时间间隔内(约1年)的精密度误差,初步评价了非同步QCT测量腰椎BMD的长期稳定性,可以为临床医师提供监测疾病进程及评估疗效的重要参考依据。
精密度是指以相同的方式重复进行试验时,在没有实际生物发生变化的情况下再现相同数值结果的能力。与其他医学参数相仿,BMD随增龄有所变化,25岁以后,腰椎松质骨BMD每年减少1%~2%[8],本研究结果与之一致。因本次研究时间间隔较长,对研究结果经年变化率进行校正,可排除BMD随增龄变化量对PE的影响。随后对BMD测量工具进行长期体内可重复性评估,可初步评价其长时间间隔的随访价值。
本研究结果(RMS-% CV=2.57%)与既往针对非同步QCT短期精密度的研究结果(RMS-% CV<3%)一致[4,15-16],表明非同步QCT测量腰椎BMD在较长的时间间隔内(约1年)具有良好的可重复性。本研究结果显示在BMD≥ 80 mg/cm3时,随着BMD值增高,RMS-% CV呈降低趋势,且组间CV差异有统计学意义,提示低骨量人群BMD测量值变异度更大,因此在评价LSC时,BMD较低的椎体会有更显著的变化,与大部分研究结果一致[9,17-18];然而与部分结论相反[9,18],本研究结果显示在BMD≥ 80 mg/cm3时,RMS-SD随着BMD值的增高而降低,但组间SD差异无统计学意义,提示SD值可能在较大的BMD值范围内相对稳定,用RMS-SD评价LSC时不同骨量的椎体间变异度差异可能并不显著。
对于传统QCT短期PE,本研究结果与大部分针对体内短期PE的研究结果(RMS-% CV为1.8%~4.0%)一致[10,19-20],较使用欧洲腰椎体模的短期精密度实验结果(大部分RMS-% CV<1%)高[9,17,21],其原因可能包括本次研究基于人体,而25岁后椎体BMD会缓慢降低[8];将本次PE值与基于欧洲腰椎体模得出的结果比较时,部分扫描参数如X射线管电压和电流、螺距、机架转速、探测器配置、床高及重建算法等不一致,造成PE结果出现差异。据Michael Bligh等[21]报道,当不对扫描参数进行控制时,包括探测器配置不同、患者重新定位、扫描床高度及速度的变化、X射线管电流和转数的变化、重建算法的不同等都会引起PE的变异。ISCD指出,QCT测量脊柱松质骨的PE值范围为1.3%~2.4%[8]。本研究结果误差稍大的原因可能包括在一年的间隔时间内,局部温湿度对仪器的影响、探测器的漂移、设备机械损耗等因素。既往研究[21]报道,在X线管温度较低时测得的CV值几乎是在较高温度时测量的3倍。
LSC指发生真正生物学改变的最小BMD变化量,临床医师可以通过LSC值判断初诊BMD值与随访BMD值之间差异是否具有临床生物学意义,从而判断患者的治疗成效[11]。本研究以RMS-SD=3.14 mg/cm3计算得到的LSC-SD=8.70 mg/cm3,提示只有当BMD变化量超过(增加或减少)8.70 mg/cm3时,其变化才具有意义,据此可评估治疗疗效。
当然,本研究也存在一定的不足之处。纳入样本范围为60岁以下成年人,处于骨质疏松组的样本量较少(n=15),仅占本次所有样本量的2.9 %。且较多既往研究[22-23]指出,骨质疏松病人的BMD年变化率较低骨量及正常骨量者高,骨量低的人群较骨量高的人群精密度误差大,故本研究结果可能会在一定程度被低估,在未来研究中可增加骨质疏松组样本量进行总体评价。
综上所述,本研究观察的非同步校准QCT测量腰椎骨密度的长期体内可重复性好,精密度高,可用于临床随访观察;低骨量人群骨密度变异度较骨量正常的人群高,骨密度较高的人群具有更好的可重复性。

