悬钩子根多糖对2型糖尿病小鼠胰腺线粒体功能的改善作用
代敏敏,常 影,许 娜,王 燕,徐 梦,徐文悦,马佳旺,刘文森,陈正爱
(1.延边大学基础医学院药理学教研室,吉林 延吉 133002;2.吉林医药学院药学院药理学教研室,吉林 吉林 132013;3.军事医学科学院军事兽医研究所,吉林 长春 130118;4.吉林农业大学生命科学学院生物化学与分子生物学教研室,吉林 长春 130118)
糖尿病(diabetes mellitus,DM)是一种以高血糖为特征的慢性代谢性疾病,随着经济的发展和人们生活水平的提高,DM患病率逐年上升[1]。根据国际糖尿病联合会2019年的最新报告,到2045年DM患病人数将增加至6.93亿。在全球范围内,大约每11名成人中就有1例DM患者,其中90% 为 2型 糖 尿 病 (diabetes mellitus type 2,T2DM)[2-3]。持续的高血糖状态会严重损害身体各系统,引起各种并发症,最终导致死亡。DM已成为危害全球健康的最重要的慢性非传染性疾病之一[4]。
线粒体是大多数真核细胞正常功能所必需的,在包括骨骼肌、心肌、大脑、胰腺和肝脏等许多组织中的能量代谢和ATP生成中起着关键作用[5]。当线粒体功能出现障碍时,活性氧(reactive oxygen species,ROS)的产生增加,ATP产生不足,进而导致胰腺β细胞功能障碍和胰岛素分泌减少,最终导致血糖升高。目前T2DM的发病机制尚不明确,但是大多数学者认为胰岛素抵抗(insulin resistance,IR)和β细胞功能障碍是其主要发病机制[6]。研究[7]表明:线粒体功能障碍与IR和β细胞功能障碍的发生发展有密切关联。随着线粒体功能障碍与T2DM关系的深入研究,寻找改善胰腺线粒体功能的药物将有助于T2DM的临床防治。
悬钩子根多糖(Rubus root polysaccharide,RRP)是植物悬钩子的提取物,具有抗氧化、调节免疫、降糖、降脂和抗肿瘤等作用[8-10]。研究[11]显示:在体外实验中,RRP通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),抑制磷酸烯醇式丙酮酸碳羧化酶(phosphoenolpyruvate carboxykinase, PEPCK) 和葡萄糖-6-磷酸(glucose-6-phosphate,G6P)的表达水平进而调节脂类和葡萄糖代谢。KE等[12]发现:RRP可通过恢复线粒体功能对棕榈酸诱导的L02细胞毒性发挥保护作用。目前尚无RRP在T2DM小鼠模型中对胰腺线粒体功能影响的相关研究。本研究进一步探讨了RRP的降血糖作用,通过检测小鼠胰腺线粒体功能相关指标,阐明RRP对小鼠胰腺线粒体功能的改善作用,以期为T2DM的预防和治疗提供参考。
1 材料与方法
1.1 实验动物 6周龄雄性C57BL/6J小鼠,体质量(24±2)g,购自辽宁长生生物有限公司,动物生产许可证号:SCXK(辽)2015-0001。小鼠在通风良好、12 h昼夜交替、室温(24±2)℃和相对湿度(50±10)%的条件下标准化分笼饲养,自由摄食饮水。
1.2 主要试剂和仪器 RRP从悬钩子根部提取,纯度≥85%,提取方法见参考文献[9]和参考文献 [13]。链脲佐菌素 (streptozocin, STZ)(美国Sigma公司),二甲双胍(北京京风制药有限公司),MIR05-kit(北京华威中仪科技有限公司),葡萄糖检测试剂盒(南京建成生物工程研究所),小鼠胰岛素酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试 剂 盒 (美 国EMD Millipore公司),小鼠胰高血糖素(glucagon,GC)ELISA试剂盒(上海酶联生物技术有限公司),小鼠C肽ELISA试剂盒(武汉Elabscience生物技术有限公司)。高端多功能酶标仪(奥地利TECAN公司),电子天平(德国多利斯公司),低温高速离心机(日本三洋公司),超低温冰箱(中国海尔公司),OROBOROS O2K高分辨率线粒体功能/细胞能量代谢测量系统(北京华威中仪科技有限公司)。
1.3 T2DM动物模型制备、分组和给药 实验开始前,70只健康SPF小鼠适应性饲养1周。随机选取10只小鼠作为对照组饲喂标准饲料,其余60只小鼠作为模型制备组饲喂高脂饲料。5周后,模型制备组小鼠单次腹腔注射低剂量STZ(130 mg·kg-1)。腹腔注射 STZ 后 1周,禁食不禁水12 h,检测小鼠空腹血糖(fasting blood glucose, FBG) 水平,FBG≥7.8 mmol·L-1的小鼠被认为造模成功,并继续给予高脂饮食。根据血糖结果,从52只造模成功的小鼠中随机选取50只,分为5组:模型组,低、中和高剂量(50、100和200 mg·kg-1) RRP 组 , 二 甲 双 胍 (200 mg·kg-1)组,每组10只。对照组和模型组小鼠给予等体积生理盐水,每日灌胃1次,连续10周。
1.4 各组小鼠血清FBG水平检测和口服葡萄糖耐量试验(oral glucose tolerance test,OGTT) 在灌胃后0、30、60、90和120 min采集小鼠血液样品,采用葡萄糖检测试剂盒检测小鼠血清中FBG水平。每4周进行1次OGTT,OGTT测定前禁食不禁水12 h,每组小鼠口服2 mg·kg-1葡萄糖溶液进行OGTT,绘制OGTT的时间-血糖曲线,计算OGTT的时间-血糖曲线下面积(area under curve,AUC)。
1.5 ELISA法检测各组小鼠血清中空腹胰岛素(fasting insulin,FINS)、C肽和GC水平 各组小鼠禁食不禁水12 h后,通过尾静脉收集血液样品。采用ELISA法检测各组小鼠血清中FINS、C肽和GC水平。计算稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR),HOMA-IR=FBG×FINS/22.5。
1.6 计算各组小鼠胰腺指数 实验结束后,记录小鼠体质量,断髓处死后收集小鼠新鲜胰腺组织,并计算胰腺指数,胰腺指数=胰腺质量(g)/体质量(g)×100%。
1.7 检测各组小鼠胰腺组织线粒体功能 各组小鼠胰腺组织解冻后,用预冷的PBS缓冲液清洗3次,根据胰腺组织质量(g)∶PBS缓冲液体积(mL)=1∶9加入预冷的PBS缓冲液,充分研磨后使用OROBOROS O2K高分辨率线粒体功能/细胞能量代谢测量系统检测各组小鼠胰腺线粒体功能。氧气校准后,在玻璃腔中加入2 mL MIR05-kit,然后分别加入各种底物、解偶联剂和抑制剂等物质。通过O2K软件对数据进行分析,实时综合检测磷氧比(ADP∶O ratio,ADP/O)、呼吸控制率(respiratory control rate,RCR)和基础呼吸耗氧量。
1.8 HE染色观察各组小鼠胰腺组织病理形态表现 胰腺组织样本固定在4%多聚甲醛中,经过一系列酒精脱水,二甲苯清除,石蜡包埋。常规制备4 μm厚度的胰腺组织切片进行HE染色,光镜下观察小鼠胰腺组织病理形态表现。
1.9 统计学分析 采用GraphPad Prism 8.0统计软件进行统计学分析。各组小鼠体质量、饮水量和摄食量,血清中FBG、FINS、C肽和GC水平,OGTT的AUC、HOMA-IR和胰腺指数,线粒体功能相关指标ADP/O、RCR和基础呼吸耗氧量符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般状态 与对照组比较,模型组小鼠精神萎靡,毛色粗糙,自主活动减少;与模型组比较,各剂量RRP组和二甲双胍组小鼠精神状态、毛色和自主活动在一定程度上有所改善。与对照组比较,模型组小鼠体质量明显降低(P<0.05),饮水量和摄食量明显增加(P<0.05)。与模型组比较,中和高剂量RRP组及二甲双胍组小鼠体质量明显增加(P<0.05),饮水量和摄食量明显减少(P<0.05);低剂量RRP组小鼠体质量有升高趋势,饮水量和摄食量有下降趋势,但差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠一般状态Tab.1 General state of mice in various groups(n=3,±s)

表1 各组小鼠一般状态Tab.1 General state of mice in various groups(n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group.
Group Body mass(m/g)30.57±0.47 25.50±1.11*Drinking water(V/mL)5.43±0.75 18.27±0.95*Food intake(m/g)4.67±0.59 7.60±0.40*7.33±0.67 6.20±0.75△5.00±0.89△4.27±0.96△Control Model RRP Low dose Medium dose High dose Metformin 26.50±0.85 27.47±0.74△29.07±1.23△30.77±1.12△16.57±0.99 12.33±1.86△9.37±1.30△6.27±0.61△
2.2 各组小鼠血清中FBG水平、OGTT的AUC和HOMA-IR 与对照组比较,模型组小鼠血清中FBG水平、OGTT的AUC和HOMA-IR明显升高(P<0.05)。与模型组比较,中和高剂量RRP组及二甲双胍组小鼠血清中FBG水平、OGTT的AUC和HOMA-IR明显降低(P<0.05);低剂量RRP组小鼠血清中FBG水平和HOMA-IR明显降低(P<0.05),OGTT的AUC有下降趋势,但差异无统计学意义(P>0.05)。见图1。

图1 各组小鼠血清中FBG水平(A)、OGTT曲线(B)、OGTT的AUC(C)和HOMA-IR(D)Fig.1 Serum FBG levels(A),OGTT curves(B),AUC of OGTT(C),and HOMA-IR(D)of mice in various groups
2.3 各组小鼠血清中FINS、C肽和GC水平 与对照组比较,模型组小鼠血清中FINS和C肽水平明显降低 (P<0.05),GC水 平明显升高 (P<0.05)。与模型组比较,中和高剂量RRP组及二甲双胍组小鼠血清中FINS和C肽水平明显升高(P<0.05),GC水平明显降低(P<0.05);低剂量RRP组小鼠血清中FINS和C肽水平有升高趋势,GC水平有下降趋势,但差异均无统计学意义(P>0.05)。见表2。
表2 各组小鼠血清中FINS、C肽和GC水平Tab.2 Levels of FINS,C-peptide,and GC in serum of mice in various groups (n=3,±s)

表2 各组小鼠血清中FINS、C肽和GC水平Tab.2 Levels of FINS,C-peptide,and GC in serum of mice in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group.
Group Control Model RRP Low dose Medium dose High dose Metformin FINS[λB/(mIU·L-1)]17.09±1.10 11.04±0.93*C-peptide[ρB/(mg·L-1)]2.93±0.38 0.45±0.16*GC[λB/(mU·L-1)]29.35±0.32 60.47±3.47*54.07±5.03 49.23±5.82△33.97±6.69△38.45±1.79△11.35±0.14 13.01±0.47△15.44±0.98△15.40±0.38△0.73±0.21 1.27±0.15△1.90±0.20△1.93±0.38△
2.4 各组小鼠胰腺指数 与对照组比较,模型组小鼠胰腺指数明显降低(P<0.05);与模型组比较,各剂量RRP组和二甲双胍组小鼠胰腺指数明显升高(P<0.05)。见图2。

图2 各组小鼠胰腺指数Fig.2 Pancreatic indexes of mice in various groups
2.5 各组小鼠胰腺线粒体功能 与对照组比较,模型组小鼠胰腺线粒体ADP/O、RCR和基础呼吸耗氧量均明显降低(P<0.05)。与模型组比较,中和高剂量RRP组及二甲双胍组小鼠胰腺线粒体ADP/O、RCR和基础呼吸耗氧量均明显升高(P<0.05);低剂量RRP组小鼠胰腺线粒体ADP/O和RCR有升高趋势,但差异无统计学意义(P>0.05), 基 础 呼 吸 耗 氧 量 明 显 升 高 (P<0.05)。见表 3。
表3 各组小鼠胰腺线粒体功能Tab.3 Pancreatic mitochondrial function of mice in various groups (n=3,±s)
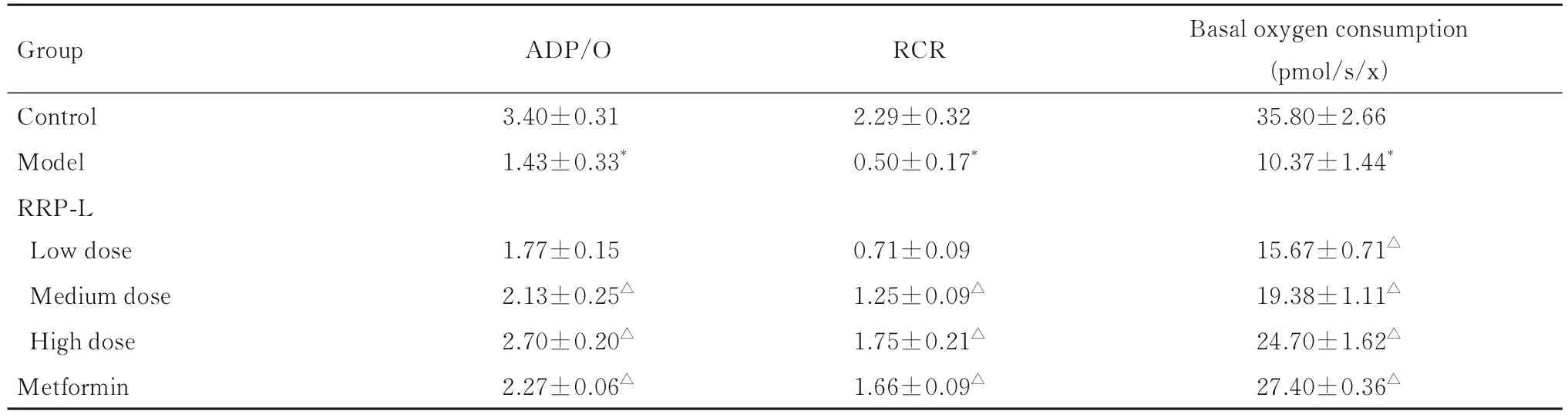
表3 各组小鼠胰腺线粒体功能Tab.3 Pancreatic mitochondrial function of mice in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group.
Group ADP/O RCR Control Model RRP-L Low dose Medium dose High dose Metformin 3.40±0.31 1.43±0.33*2.29±0.32 0.50±0.17*Basal oxygen consumption(pmol/s/x)35.80±2.66 10.37±1.44*15.67±0.71△19.38±1.11△24.70±1.62△27.40±0.36△1.77±0.15 2.13±0.25△2.70±0.20△2.27±0.06△0.71±0.09 1.25±0.09△1.75±0.21△1.66±0.09△
2.6 各组小鼠胰腺组织病理形态表现 与对照组比较,模型组小鼠胰腺组织中胰岛形状不规则,胰岛细胞大小和数量明显减少,胰岛出现炎性细胞浸润和变性坏死。与模型组比较,各剂量RRP组和二甲双胍组小鼠胰腺组织中胰岛形状较完整,胰岛细胞大小和数量不同程度增加,坏死面积减少。见图3。

图3 各组小鼠胰腺组织病理形态表现(HE,×200)Fig.3 Pathomorphology of pancreas tissue of mice in various groups(HE,×200)
3 讨 论
T2DM小鼠模型的建立多采用化学药物诱导的方法,目前常用的诱导剂有STZ和四氧嘧啶[14]。STZ是一种广谱抗生素,能够在短时间内特异性的损害β细胞,从而导致机体内胰岛素分泌不足[15]。由于STZ造模稳定性好,对机体损伤较小,并且高脂饮食联合低剂量STZ的方法能够很好地模拟人类DM患者新陈代谢的自然进展和变化,是一种常用的建立实验性T2DM动物模型的途径[16-17]。因此本研究采用高脂饲料联合腹腔注射低剂量STZ的方法建立T2DM小鼠模型,模型制备组小鼠连续4周给予高脂饮食,随后注射STZ,1周后检测小鼠的FBG,结果显示:模型制备组小鼠FBG水平 ≥7.8 mmol·L-1,OGTT 的 AUC 和 HOMA-IR升高,胰腺组织结构被破坏,表明T2DM小鼠模型制备成功。本研究结果显示:RRP可明显降低T2DM小鼠的FBG,改善糖耐量和胰腺组织结构,表明RRP具有明显的降血糖作用。
胰腺是人体的重要器官,主要分泌胰岛素和胰高血糖素来控制机体的葡萄糖代谢。当胰腺功能发生紊乱时,会导致胰岛素分泌异常或胰岛素抵抗[18]。为研究RRP对小鼠胰腺的影响,本研究检测了各组小鼠血清中FINS、C肽和GC水平及胰腺指数。C肽在等摩尔的基础上与胰岛素共分泌,衡量β细胞功能的金标准是评估血浆中的C肽水平[19]。胰腺指数在一定程度上可以反映胰岛结构是否受损[20-21]。本研究结果显示:RRP治疗后,T2DM小鼠血清中FINS、C肽水平和胰腺指数均升高,GC水平降低,表明RRP可以通过改善T2DM小鼠的胰腺功能,促进胰岛素分泌,进而调节T2DM小鼠的血糖。此外,本研究中小鼠胰腺组织病理学结果证实:RRP可以改善T2DM小鼠胰腺组织的形态表现。
线粒体最主要的功能就是通过氧化磷酸化产生能量,维持机体正常生理活动[22-23],其功能障碍会导致细胞功能受损。线粒体呼吸是线粒体系统能量代谢过程中最重要的步骤,ADP/O和RCR能够衡量线粒体功能结构完整程度,反映线粒体氧化磷酸化的偶联功能,体现线粒体的能量转化效能[24-25]。本实验采用ADP/O、RCR和基础呼吸耗氧量反映线粒体的呼吸功能和ATP的合成能力,结果显示:与对照组比较,模型组小鼠胰腺线粒体ADP/O、RCR和基础呼吸耗氧量均明显降低,且RRP干预10周后可以逆转上述变化,表明RRP可以改善T2DM小鼠的胰腺线粒体功能。
本研究探讨了RRP对T2DM小鼠胰腺线粒体功能的改善作用,其改善作用是RRP本身的作用还是其代谢产物的影响,尚需进一步研究。本研究结果显示:RRP能够使T2DM小鼠血清中FBG和GC水平及HOMA-IR明显降低,血清FINS和C肽水平、ADP/O、RCR、基础呼吸耗氧量和胰腺指数明显升高,同时T2DM小鼠的糖耐量和胰腺组织结构损伤明显改善。综上所述,RRP能够改善T2DM小鼠胰腺线粒体功能,促进胰岛素的分泌,进而调节血糖。

