高糖通过miR-125b对小鼠RAW264.7巨噬细胞极化的调控作用
沈 鑫,刘 洋,陈泓宇,张 洁,程庆砾,杨 光
(解放军总医院第二医学中心肾脏病科 国家老年医学研究中心,北京 100853)
2型糖尿病(type 2 diabetic mellitus,T2DM)是最常见的慢性代谢性疾病之一,其发病率逐年升高,2019年全球糖尿病患病率为9.3%,患病人数约4.63亿例,预计到2045年患病人数将上升至7亿例[1]。研究[2]显示:在糖尿病人群中,基于糖脂代谢紊乱等引起机体的慢性低水平炎症状态是造成糖尿病靶器官损伤的重要病因,在该病理生理过程中,单核巨噬细胞系统的激活和其向促炎表型极化发挥了重要作用。单核细胞进入组织后可以随周围环境的改变分化为不同类型的巨噬细胞,包括经典活化巨噬细胞M1型(促炎型)和替代性活化巨噬细胞M2型(抗炎型),即巨噬细胞极化[3]。研究[4-5]显示:糖尿病的微环境可能会改变巨噬细胞M1/M2的极化状态,从而造成机体的微炎症状态。
微小 RNAs(microRNAs,miRNAs) 是一种小分子非编码RNA,作为一种内源性非编码RNA,其不编码蛋白质,但在基因转录后的调控中发挥着重要作用。某些miRNAs可以参与调节巨噬细胞的极化,提示miRNAs可能是改善糖尿病微炎症环境的有效靶点。有研究[6-7]显示:miR-125b可能是调控巨噬细胞极化的重要靶点,且与糖尿病微血管病变有密切关联。目前国内外对于miR-125b调控巨噬细胞极性的研究报道较少,本研究拟探讨高糖对巨噬细胞极化改变和miR-125b表达的影响,并进一步评估miR-125b对巨噬细胞极性的调控作用,为改善糖尿病患者微炎症环境提供新的思路。
1 材料与方法
1.1 细胞、主要试剂和仪器 小鼠单核巨噬细胞系RAW264.7购自中国科学院协和细胞库。胎牛血清(fetal bovine serum,FBS)、1%青-链霉素和无糖RPMI-1640培养基购自美国Gibco公司,D-葡萄糖购自美国Sigma公司,细胞培养瓶购自美国Corning公司,转染试剂LipofectamineTM2000和TRIzol购自美国Invitrogen公司,逆转录试剂盒和实时荧光定量 PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒购自日本TOYOBO公司,小鼠白细胞介素6(interleukin-6,IL-6)、白细胞介素10(interleukin-10,IL-10)、白细胞介素12(interleukin-12,IL-12)和白细胞介素 1β(interleukin-1β, IL-1β) 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA) 试剂盒均购自美国Sigma-Aldrich公司,细胞流式APC anti-mouse CD86和PE anti-mouse CD206购自北京Biolegend公司,IL-1β和IL-10抗体购自美国CST公司,干扰素调节因子5(interferon regulatory factor 5,IRF5) 和Toll样受体4(Tolllike receptor 4,TLR4)抗体购自英国Abcam公司,过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)和干扰素调节因子4(interferon regulatory factor 4,IRF4) 抗体购自武汉云克隆科技股份有限公司,GAPDH购自杭州贤至生物有限公司。低速离心机(5702R)购自德国Eppendorf公司,酶标仪(Thermo MULTISKAN MK3) 购 自 美 国Thermo公 司,CO2恒温培养箱(SANYO-MCO-15AC)购自日本三洋公司,倒置显微镜(OLYMPUS-IX51)购自北京普瑞赛司仪器有限公司、流式细胞仪(Beckmancoulter-cytoFLEX) 和 RT-qPCR 仪(ABI-QuantStudio 6)购自上海土森视觉科技有限公司,水平电泳仪(JY300)和紫外分析仪(JY02S)购自北京君意东方电泳设备有限公司,电转仪(DYCZ-40)购自北京六一仪器厂。
1.2 细胞培养、转染和实验分组 小鼠RAW264.7细胞采用含有10%FBS的RPMI-1640培养基置于37℃、5%CO2恒温培养箱中培养,传代。取对数生长期RAW264.7细胞,制备成单细胞悬液,以2.5×105个/孔接种于6孔细胞培养板中培养过夜,按照不同实验分组对细胞进行干预处理。①正常对照(NG)组:RAW264.7细胞+正常培养基(5.6 mmol·L-1葡萄糖);②正糖抑制 (NG+miR-125b inhibitor)组:RAW264.7细胞+正常培养基+miR-125b inhibitor沉默miR-125b表达;③高糖刺激(HG)组:RAW264.7细胞+高糖培养基 (30 mmol·L-1葡萄糖);④高糖抑制 (HG+miR-125b inhibitor)组:RAW264.7细胞+高糖培养基+miR-125b inhibitor沉默miR-125b表达。其中NG+miR-125b inhibitor组和HG+miR-125b inhibitor组通过细胞转染的方法沉默miR-125b的表达,miR-125b inhibitor由汉恒生物科技(上海)有限公司合成,按照LipofectamineTM2000转染试剂说明书步骤进行操作。各组细胞经不同浓度葡萄糖刺激培养72 h后留取细胞和细胞上清进行后续检测。
1.3 RT-qPCR法检测细胞中M1/M2极化相关因子mRNA和miR-125b表达水平 收集各组细胞,TRIzol法提取各组细胞总RNA,根据逆转录试剂盒和RT-qPCR试剂盒说明书进行mRNA定量分析。引物由深圳华大基因科技有限公司合成。引物序列:GAPDH,上游引物5′-ATGGGTGTGAACCACGAGA-3′, 下 游 引 物 5′-CAGGGATGATGTTCTGGGCA-3′; IRF4, 上 游 引 物 5′-TCCCCATTGAGCCAAGCATA-3′, 下 游 引 物 5′-TCCTCTGTCCATTGTCGTCC-3′;IL-10,上游引物5′-GCTGGACAACATACTGCTAACCG-3′,下游引 物 5′-CACAGGGGAGAAATCGATGACAG-3′;IL-1β, 上 游 引 物 5′-GTCTTTCCCGTGGACCTTC-3′, 下 游 引 物 5′-ATCTCGGAGCCTGTAGTGC-3′;PPAR,上游引物 5′-AGGGCGATCTTGACAGGAAA-3′, 下 游 引 物 5′-CGAAACTGGCACCCTTGAAA-3′; TLR4, 上 游 引 物 5′-GCCCTACCAAGTCTCAGCTA-3′, 下 游 引 物 5′-CTGCAGCTCTTCTAGACCCA-3′;IRF5,上游引物5′-TGTCCCAGACCCAAATCTCC-3′, 下 游 引 物5′-CTCTAGGTCCGTCAAAGGCA-3′; U6, 上游引物 5′-CGCTTCGGCAGCACATATAC-3′,下游 引 物 5′-AAATATGGAACGCTTCACGA-3′;miR-125b, 上 游 引 物 5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCACAAGT-3′, 下 游 引 物 5′-TGCGCTCCCTGAGACCCTAACT-3′。反应条件:95℃预变性2 min;95℃ 变性15 s,58℃、 20 s,72℃ 延伸30 s,循环40次;95℃终末延伸10 s,4℃保持。M1/M2极化相关基因以GAPDH为内参,miR-125b以U6为内参,采用 2-△△Ct法计算 M1/M2极化相关因子mRNA和miR-125b表达水平。
1.4 ELISA法检测细胞上清中相关细胞因子水平 细胞分组和处理同上。细胞离心后取上清液,按照ELISA试剂盒说明书步骤检测细胞上清中IL-10、IL-12、IL-6和IL-1β水平,每个样本设3个复孔。
1.5 流式细胞术检测细胞中M1/M2极化标记物CD86和CD206阳性表达率 细胞分组和处理同上。各组RAW264.7细胞消化后离心,弃上清,加 PBS缓冲液重悬,1 500 r·min-1离心 5 min,PBS缓冲液清洗细胞2次,细胞分为2份,一份加入200 μL PBS缓冲液重悬细胞,每流式小管添加CD86(0.25 μg/次),4℃孵育 30 min;另一份CD206孵育前进行破膜处理,再添加CD206(0.5 μg/次),4℃孵育 30 min; PBS缓冲液再次洗涤2次,PBS缓冲液重悬后采用流式细胞仪检测CD86和CD206阳性表达率。
1.6 Western blotting法检测细胞中M1/M2极化相关因子蛋白表达水平 提取各组细胞总蛋白后,测定蛋白浓度。加样后经电泳、转膜和脱脂牛奶室温封闭后,用封闭液稀释相应的一抗PPAR(1∶500)、IL-1β(1∶500)、IRF5(1∶500)、TLR4(1∶1 000)、IRF4(1∶1 000)、IL-10(1∶1 000)和GAPDH(1∶1 000),4℃孵育过夜,TBST充分洗膜5~6次,每次5 min,二抗37℃孵育2 h,再次洗膜5~6次,每次5 min,ECL显色,采用Image J软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析 采用SPSS 26.0统计软件进行统计学分析。各组细胞中miR-125b及IL-10、IL-1β、TLR4、IRF4、PPAR 和 IRF5 mRNA 表达水平,细胞上清中IL-10、IL-12、IL-6和IL-1β水平,细胞表面分子CD86和CD206阳性表达率,细胞中IRF4、PPAR、 IL-10、IRF5、TLR4和IL-1β蛋白表达水平均符合正态分布,以±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 NG组和HG组细胞中IL-10、IL-1β和TLR4 mRNA表达水平及细胞上清中IL-10、IL-1β、IL-12和IL-6水平 RT-qPCR法检测结果显示:高糖处理72 h后,与NG组比较,HG组细胞中M2相关标记物IL-10 mRNA表达水平明显降低(P<0.01), M1相关标记物IL-1β和TLR4 mRNA表达水平明显升高(P<0.01)。见图1。ELISA法检测结果显示:高糖处理72 h后,与NG组比较,HG组细胞上清中IL-10水平明显降低(P<0.01),M1相关标记物IL-1β、IL-12和IL-6水平明显升高(P<0.01)。见图2。
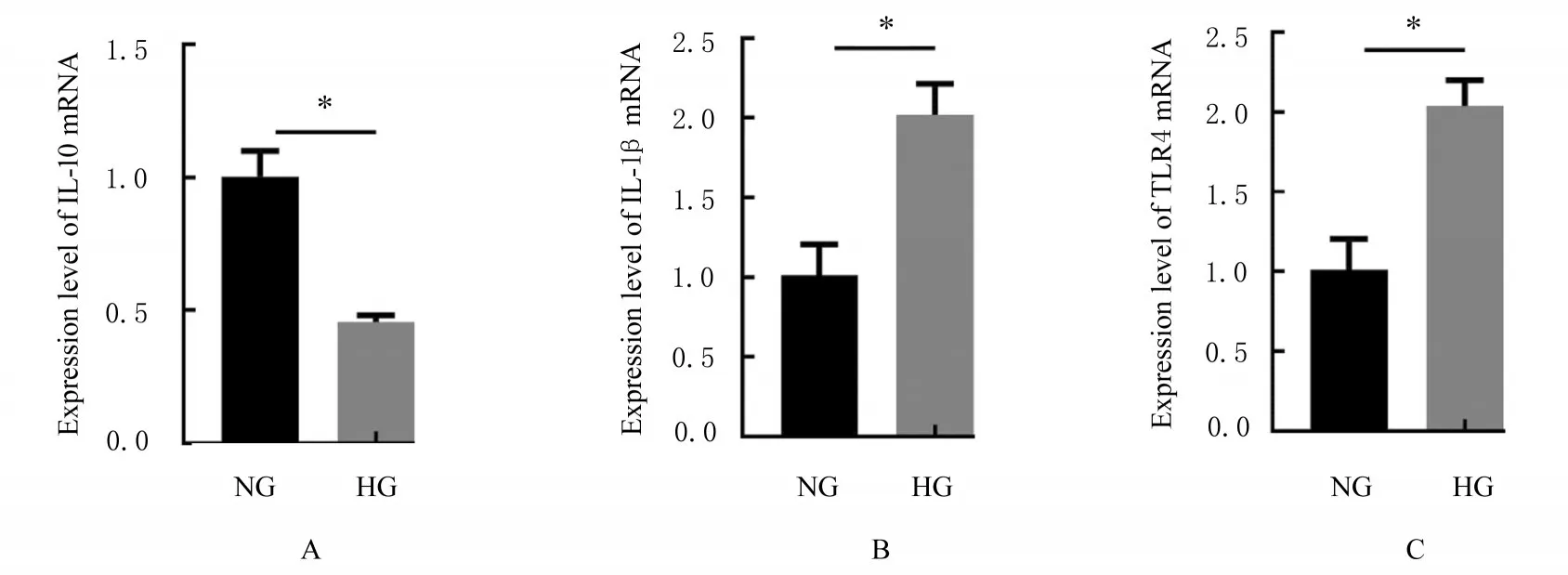
图1 2组细胞中IL-10、IL-1β和TLR4 mRNA表达水平Fig.1 Expression levels of IL-10,IL-1β,and TLR4 mRNA in cells in two groups
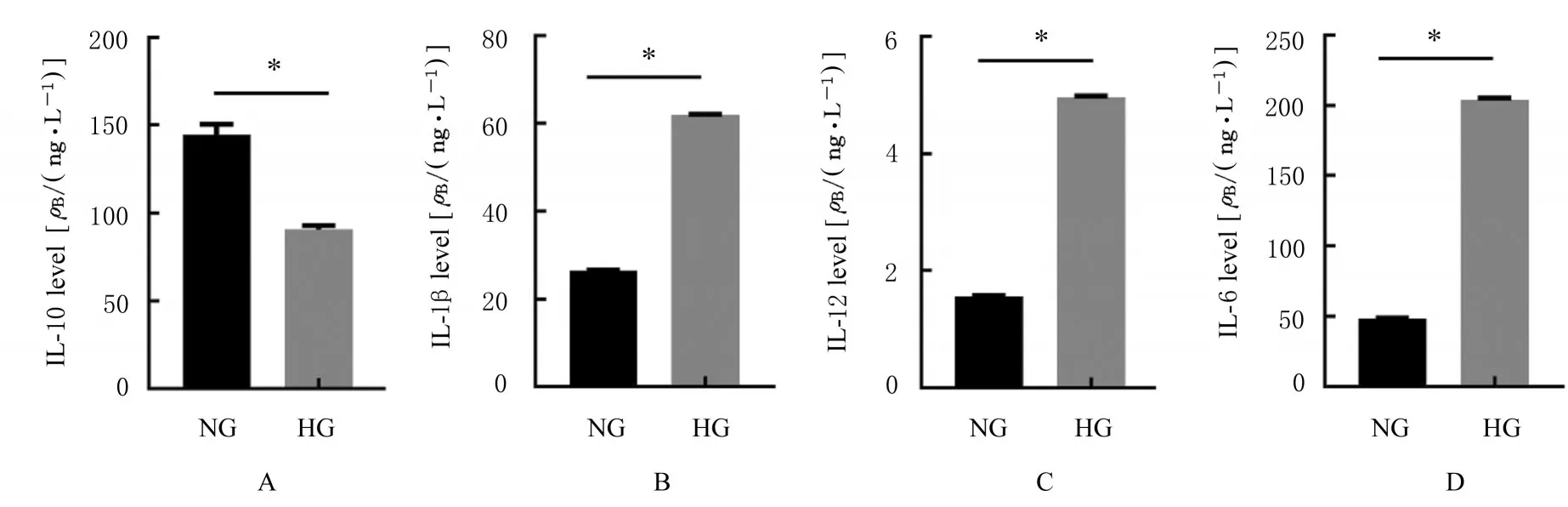
图2 ELISA法检测2组细胞上清中M1/M2相关因子水平Fig.2 Levels of M1/M2 related factors in cells in two groups detected by ELISA
2.2 NG组和HG组细胞中CD86和CD206阳性表达率 与NG组(16.43%±1.39%)比较,高糖处理72 h后,HG组细胞中CD86阳性表达率(66.46%±1.69%) 明 显 升 高 (P<0.01); 与NG组(8.42%±0.87%)比较,高糖处理72 h后,HG组细胞中CD206阳性表达率(3.98%±0.53%)明显降低(P<0.01)。见图3。
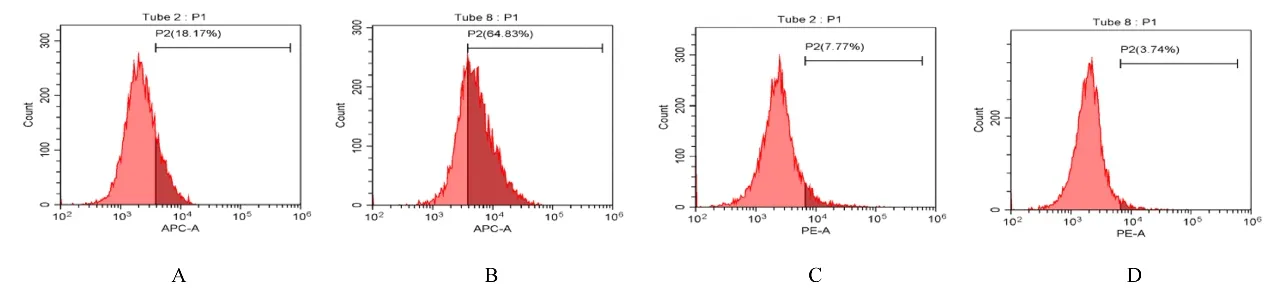
图3 流式细胞术检测2组细胞中CD86和CD206阳性表达率Fig.3 Positive expression rates of CD86 and CD206 in cells in two groups detected by flow cytometry
2.3 各组细胞中miR-125b表达水平 与NG组比较,HG组细胞中miR-125b表达水平明显升高(P<0.01);沉默miR-125b表达后,分别与NG组和HG组比较,NG+miR-125b inhibitor组和HG+miR-125b inhibitor组细胞中miR-125b表达水平明显降低(P<0.01)。见图4。
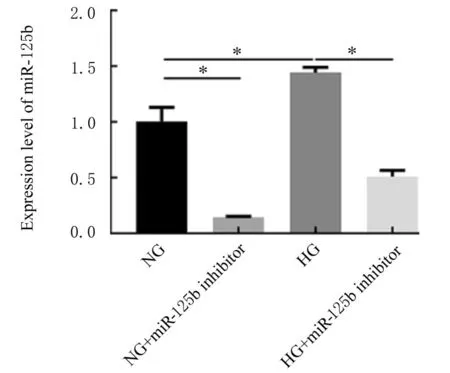
图4 各组细胞中miR-125b表达水平Fig.4 Expression levels of miR-125b in cells in various groups
2.4 沉默miR-125b表达后各组细胞中IL-10、IL-1β和TLR4 mRNA表达水平及细胞上清中IL-10、IL-1β、IL-12和IL-6水平 RT-qPCR法检测结果显示:沉默miR-125b表达后,分别与NG组和HG组比较,NG+miR-125b inhibitor组和HG+miR-125b inhibitor组细胞中IL-10 mRNA表达水平均明显升高(P<0.01),IL-1β和TLR4 mRNA表达水平均明显降低 (P<0.05或 P<0.01)。见图 5。ELISA法检测结果显示:沉默miR-125b表达后,分别与NG组和HG组比较,NG+miR-125b inhibitor组和HG+miR-125b inhibitor组细胞上清中IL-10水平均明显升高 (P<0.01),IL-1β、IL-12和IL-6水平均明显降低(P<0.01)。见图6。
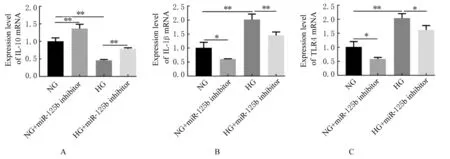
图5 RT-qPCR法检测沉默miR-125b后各组细胞中IL-10、IL-1β和TLR4 mRNA表达水平Fig.5 Expression levels of IL-10,IL-1β,and TLR4 mRNA in cells in various groups after silencing miR-125b detected by RT-qPCR method
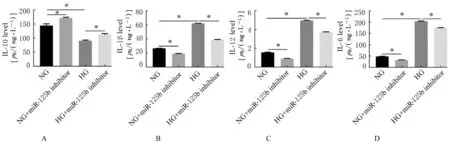
图6 ELISA法检测沉默miR-125b后各组细胞上清中IL-10、IL-1β、IL-12和IL-6水平Fig.6 Levels of IL-10,IL-1β,IL-12 and IL-6 in cell supernatant in various groups after silencing miR-125b detected by ELISA
2.5 沉默miR-125b表达后各组细胞中CD86和CD206阳性表达率 沉默miR-125b表达后,分别与NG组和HG组比较,NG+miR-125b inhibitor组和HG+miR-125b inhibitor组细胞中CD86阳性表达率明显降低(P<0.05或P<0.01),CD206阳性表达率明显升高(P<0.01)。见图7和8。
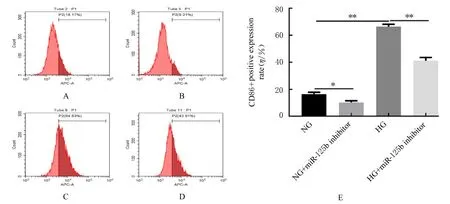
图7 流式细胞术检测沉默miR-125b后各组细胞中CD86阳性表达率Fig.7 Positive expression rates of CD86 in cells in various groups after silencing miR-125b detected by flow cytometry
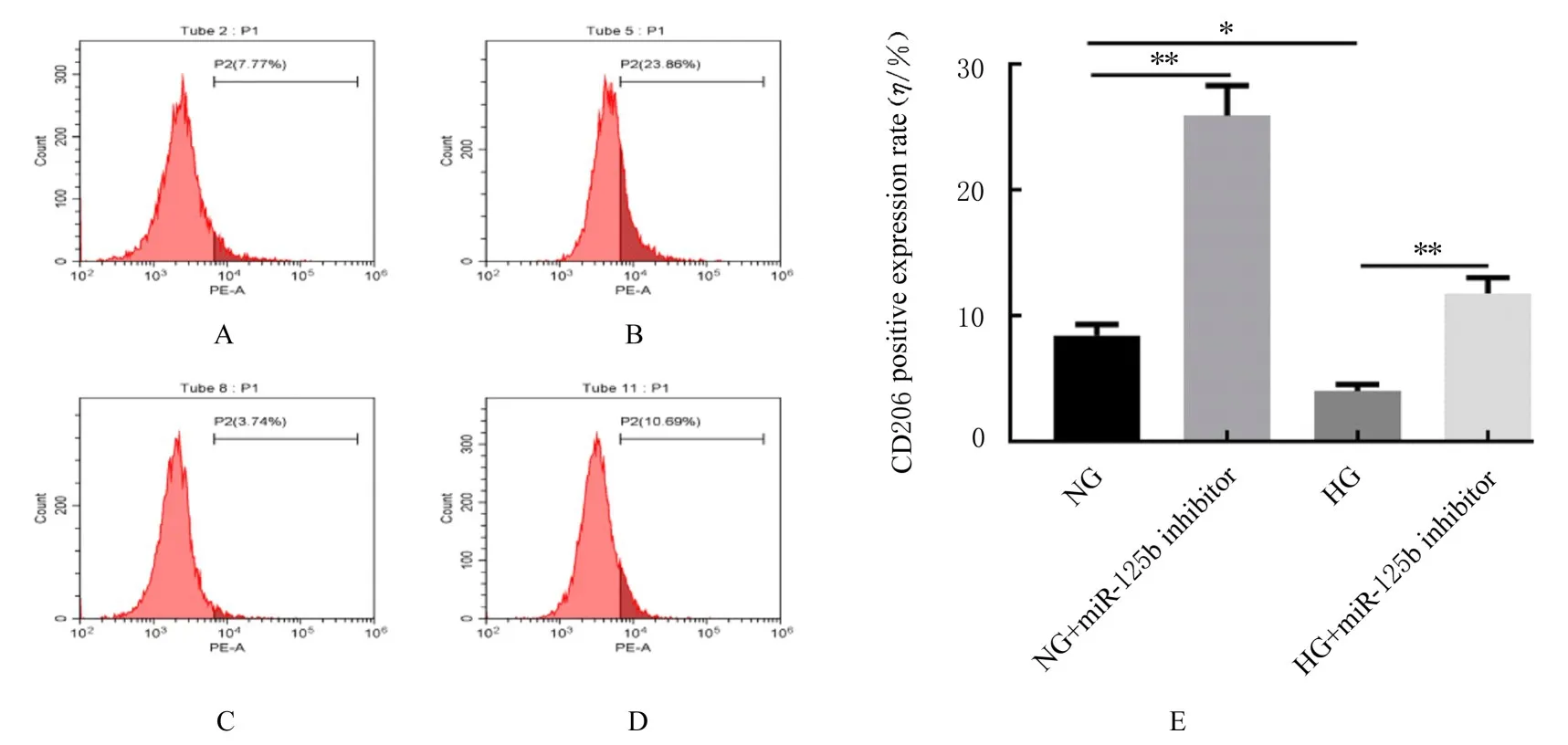
图8 流式细胞术检测沉默miR-125b后各组细胞中CD206阳性表达率Fig.8 Positive expression rates of CD206 in cells in various groups after silencing miR-125b detected by flow cytometry
2.6 各组细胞中IRF4、PPAR和IRF5 mRNA表达水平及 IRF4、PPAR 、IL-10、IRF5、TLR4 和 IL-1β蛋白表达水平 RT-qPCR法检测结果显示:与NG组比较,高糖处理72 h后,HG组细胞中IRF4和PPAR mRNA表达水 平明显降 低 (P<0.01),IRF5 mRNA表达水平明显升高(P<0.01);沉默miR-125b表达后,分别与NG和HG组比较,NG+miR-125binhibitor组 和 HG+miR-125b inhibitor组中IRF4及PPAR mRNA表达水平均明显升高(P<0.01),IRF5 mRNA表达水平明显降低(P<0.05或P<0.01)。见图9。
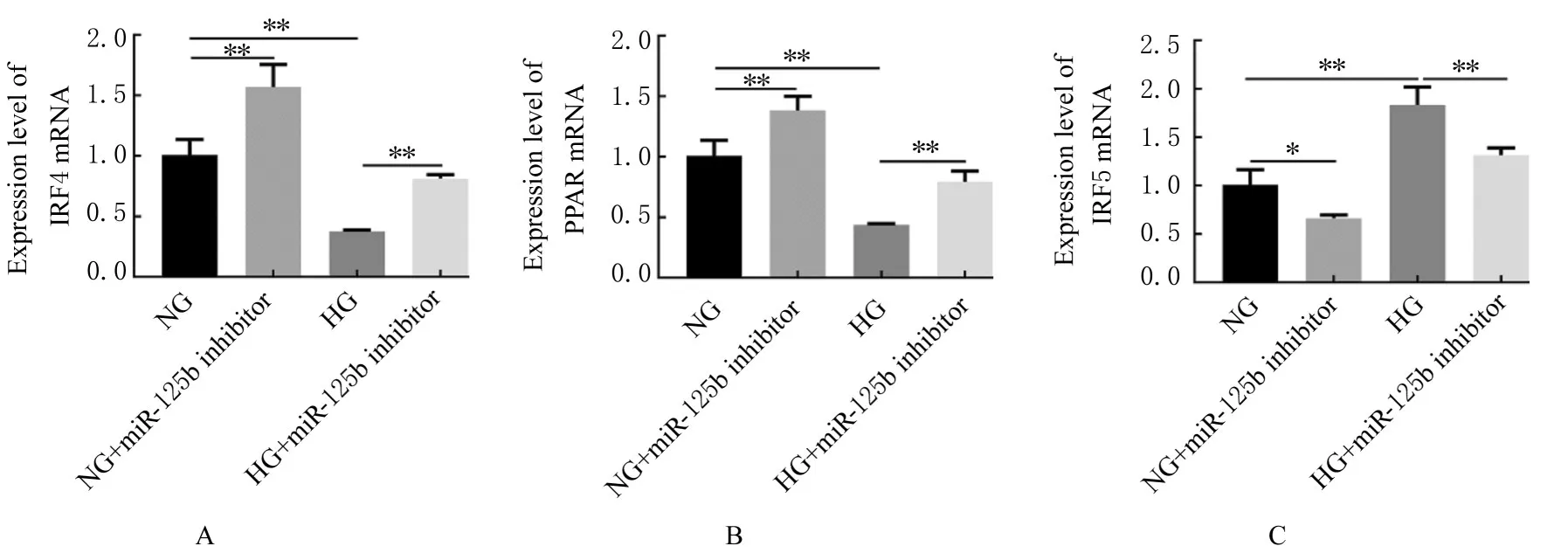
图9 RT-qPCR法检测沉默miR-125b后各组细胞中IRF4、PPAR和IRF5 mRNA表达水平Fig.9 Expression levels of IRF4,PPAR,IRF5 mRNA after silencing miR-125b in cells in various groups detected by RT-qPCR method
Western blotting法检测结果显示:与NG组比较,高糖处理72 h后,HG组细胞中IRF4、PPAR和IL-10蛋白表达水平明显降低(P<0.01),IRF5、TLR4和IL-1β蛋白表达水平明显升高(P<0.01);沉默miR-125b表达后,与NG组比较,NG+miR-125b inhibitor组 细 胞 中 IRF4、PPAR和IL-10蛋白表达水平明显升高(P<0.01),IRF5、TLR4和IL-1β蛋白表达水平明显降低(P<0.01);与HG组比较,HG+miR-125b inhibitor组细胞中IRF4、PPAR和IL-10蛋白表达水平明显升高;TLR4和IL-1β蛋白表达水平明显降低(P<0.01)。见图10和11。
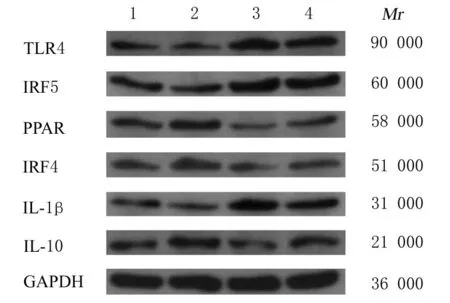
图10 Western blotting法检测沉默miR-125b后各组细胞中M1/M2极化相关因子蛋白表达电泳图Fig.10 Electrophoregram of expressions of M1/M2 polarization-related factor proteins in cells in various groups after silencing miR-125b detected by Western blotting method
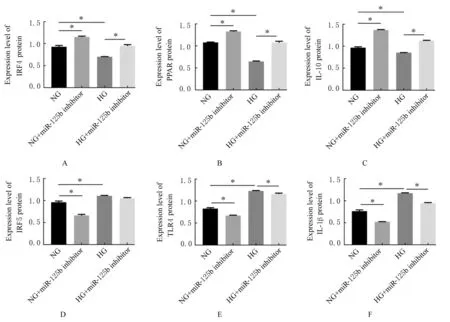
图11 沉默miR-125b后各组细胞中M1/M2极化相关因子蛋白表达水平Fig.11 Expression levels of M1/M2 polarization-related factor proteins in cells in various groups after silencing miR-125b
3 讨 论
糖尿病是最常见的慢性病之一,也是全世界发病率和死亡率较高的疾病。糖尿病的血糖升高、代谢紊乱和胰岛素抵抗等核心病理生理改变,可同时造成机体的慢性低水平炎症状态,进而导致T2DM靶器官损伤。研究者[8]认为:炎症微环境可能是糖尿病肾病和动脉粥样硬化的危险因素。另有研究[2]表明:与非糖尿病患者比较,糖尿病患者体内肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、干扰素γ(interferon-γ,IFN-γ)和IL-6等促炎细胞因子的水平升高,同时外周血中Toll样受体2(Toll-like receptor 2,TLR2) 和 TLR4 mRNA 表达水平也明显升高,且上述炎症指标与T2DM患者中胰岛素抵抗水平密切相关。导致机体微炎症状态的机制包括缺氧、细胞死亡、核因子κB(nuclear factor kappa-B,NF-κB) 及c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)途径、胰岛素抵抗、脂肪因子和趋化因子作用等[9]。
在T2DM患者体内的微炎症状态中,单核巨噬细胞系统的激活和极化发挥了重要作用。巨噬细胞极化是指巨噬细胞在不同微环境下表现出不同的活化状态并发挥不同功能作用的过程。按照表型特点和分泌的细胞因子可将巨噬细胞分为M1和M2 2种极化类型,其中M1极化为促炎表型,可以通过INF-γ或脂多糖激活,高表达IL-12、IL-1β、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、TNF-α、CD86、TLR4和组织相容复合体Ⅱ(major histocompatibility complex Ⅱ, MHC Ⅱ)等[10],可分泌TNF-α、一氧化氮、超氧化物和IL-1等细胞因子介导炎症反应和组织损伤;而M2极化呈现出抗炎表型,可以通过白细胞介素4(interleukin-4,IL-4)或白细胞介素3(interleukin-3,IL-3)激活,高表达IL-10、精氨酸酶1(arginase-1,Arg-1)、类几丁质酶3样分子3、转化生长因子β(transforming growth factor-β,TGF-β) 和 CD206等,可以分泌IL-10和TGF-β等细胞因子,在机体的损伤修复中具有重要的作用[3,11]。M1型巨噬细胞介导的慢性炎症是导致T2DM患者胰岛素抵抗和β细胞功能异常的关键。在胰岛炎症状态时,巨噬细胞会极化为M1型,同时分泌各种炎症细胞因子,从而导致局部和全身炎症,胰腺β细胞功能异常以及肝脏、脂肪和肌肉骨骼组织中的胰岛素抵抗[12]。
巨噬细胞的极化是一个高度动态的过程,巨噬细胞不会保持于单一激活状态[13],巨噬细胞的极化表型可以在生理和病理条件下逆转[14]。在糖尿病的微炎症环境中,巨噬细胞通常向M1表型极化。研究[15]显示:用晚期糖基化终产物(advanced glycation end products, AGEs) 处 理Ana-1巨噬细胞会使细胞中IL-1β和TNF-α mRNA表达水平降低,提示巨噬细胞向M1促炎表型转化。本研究在体外评估了高糖刺激对小鼠巨噬细胞极性改变的影响,结果表明:高糖微环境可促使巨噬细胞向M1表型转变。有研究者[16]发现:小鼠RAW264.7 巨噬细胞在 25 mmol·L-1葡萄糖培养基中随着时间的推移,iNOS表达上调,而MR(M2巨噬细胞标记物)表达下调。另有研究[17]显示:与非糖尿病组比较,糖尿病患者肝组织在基线和缺血/再灌注后M1标志物表达水平升高,M2标志物表达水平降低,表明高血糖可能通过促进巨噬细胞向M1极化,抑制向M2极化,增强炎症反应,从而加剧肝脏的缺血/再灌注损伤。但高糖引起M1极化的分子机制尚不明确。
本研究结果显示:经高糖培养后,巨噬细胞向M1表型转化的同时,miR-125b表达水平也明显升高。miR-125b可能是调控巨噬细胞极化的重要靶点,有研究[6]报道:过表达miR-125b后巨噬细胞处于激活状态,刺激T淋巴细胞,并且增加其对IFN-γ的反应性,该作用主要是通过抑制IRF4表达介导的。IRF4是促进M2激活的重要转录因子,巨噬细胞的TLRs被激活后可上调去甲基化酶—含jumonji结构域蛋白3(jumonji domain-containing protein 3,jmjd3)的表达,IRF4是jmjd3的靶基因,jmjd3的缺失虽然不影响M1型巨噬细胞极化,但M2型巨噬细胞极化受到抑制[18]。当小鼠巨噬细胞被IFNγ诱导时,miR125b表达的增加会抑制其靶基因IRF4表达,表现为M1型巨噬细胞增多[19]。最近一项研究[20]显示:T2DM患者中,IRF5基因表达上调且巨噬细胞向M1促炎型方向极化,同时炎性因子 CD11c、IL-1β、TNF-α、IL-6 和单核细胞趋化蛋白1表达增加。本研究为了评估miR-125b的调控作用,沉默miR-125b的表达,结果显示:与对照组比较,沉默miR-125b表达后,NG组和HG组细胞中M1相关标记物均明显降低,而M2相关标记物均明显升高,提示沉默miR-125b表达,可部分逆转高糖刺激引起巨噬细胞向M1表型的转化;沉默miR-125b后,高糖诱导的巨噬细胞IRF4和PPAR降低作用被逆转,而IRF5表达则降低,提示高糖可能通过促进miR-125b表达,进而影响IRF4、PPAR和IRF5的表达,调节巨噬细胞极化的转变。M1巨噬细胞表型受信号传导及转录激活蛋 白 1 (signal transducer and activator of transcription 1,STAT1)和IRF5控制,而M2巨噬细胞表型受信号传导及转录激活蛋白6(signal transducer and activator of transcription 6,STAT6)、IRF4和 PPARγ控制[21]。研究[22]表明:PPARγ激活是M2巨噬细胞成熟所必需的,缺乏PPARγ对M2巨噬细胞极化有抵抗力并能够促进胰岛素抵抗,而PPARγ可能通过IL-4-STAT6轴的作用来控制M2巨噬细胞表型。有研究[7]显示:miR-125b可能与糖尿病微血管病变有密切关联,上调miR-125b表达能够促进基质矿化,降低血管弹性,加速血管硬化,从而加重微血管损害,miR-125b还可以通过靶基因Suv39h1蛋白来调控糖尿病小鼠炎症因子的释放。miR-125b的高表达也与败血症患者的疾病严重程度、炎症和死亡率增加有关联[23]。
综上所述,高糖刺激会诱导巨噬细胞向促炎M1表型转变,同时miR-125b表达水平升高;沉默miR-125b的表达,则可部分逆转巨噬细胞向M1的表型转化。miR-125b可能是逆转高糖引起的巨噬细胞向促炎表型转化的重要靶点,通过沉默miR-125b来调控巨噬细胞的极化,对于改善糖尿病患者的微炎症状态和减少并发症发生具有很大研究潜力。

