整合素β1和层黏连蛋白受体1在小鼠牙发育不同阶段牙胚组织中的表达及其意义
郑赫南,周怡君,王爽爽,任飞龙,范心怡,史 册,刘 红
(1.吉林大学口腔医院综合治疗科,吉林 长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021;3.中国医科大学口腔医学院·附属口腔医院口腔病理科,辽宁 沈阳 110002;4.吉林大学口腔医院病理科,吉林 长春 130021)
牙体硬组织包括牙本质、牙釉质和牙骨质。多种原因可引起牙体硬组织的缺损,生理状况下牙釉质和牙本质的再生十分困难,而目前通过牙科材料对其进行修复又缺乏天然组织的结构,尤其是缺乏牙本质小管的结构,不能传递外界刺激[1-2]。所以,研究成釉细胞和成牙本质细胞的分化及其形成硬组织的过程对于牙体组织缺损的修复和再生具有重要的意义。牙的发育分为蕾状期、帽状期和钟状期。在钟状期,前成釉细胞和前成牙本质细胞被一层主要由层黏连蛋白等成分组成的特殊细胞外基质,即基底膜分隔[3-4]。在成釉细胞和成牙本质细胞分化早期基底膜仍存在。随着上述2种细胞的分化,细胞器逐渐移至分泌端胞质,靠近基底膜一侧,细胞核逐渐移至对侧,远离基底膜一侧,细胞形态逐渐从立方状转变为高柱状,该形态和功能上的不对称分布称为细胞的极性,特定的空间分布会促进细胞分化和分子跨膜运输等细胞行为[5-8]。在细胞完全分化成熟前,基底膜逐渐降解消失,因此基底膜可能是成釉细胞和成牙本质细胞分化并建立细胞极性所必需的[3,9]。基底膜的主要成分为层黏连蛋白,由α、β和γ链组成异三聚体[10],层黏连蛋白受体包括整合素和非整合素,其中整合素β1和层黏连蛋白受体1(laminin receptor 1, LAMR1)是其最主要的2种受体[7,11]。层黏连蛋白及其受体介导的信号通路可能在成釉细胞和成牙本质细胞的分化和牙发育中发挥重要作用。目前,二者在牙发育过程中的时空表达尚未见报道。本研究通过HE染色和免疫组织化学染色的方法,观察整合素β1和LAMR1在小鼠磨牙发育不同阶段牙胚组织中的表达,探讨二者在成釉细胞和成牙本质细胞分化过程中的可能作用及意义。
1 材料与方法
1.1 实验动物 成年C57雄鼠5只,成年C57雌鼠10只,均为12周龄。所有小鼠均来自吉林大学医学实验动物中心,动物使用许可证号:SYXK(吉)2018-0006。所有小鼠均无系统性疾病,健康状况良好。
1.2 主要试剂和仪器 15%乙二胺四乙酸二钠(EDTA)脱钙液、各浓度梯度乙醇和4%多聚甲醛(北京化学工业集团有限责任公司),大鼠抗小鼠整合素β1单克隆抗体(MAB1997,美国Millipore公司),兔抗小鼠LAMR1单克隆抗体(0900r,北京博奥森生物技术有限公司),羊抗大鼠二抗(美国Proteintech公司),免疫组织化学染色试剂盒(福建迈新生物技术开发有限公司),二氨基联苯胺(diaminobenzidine,DAB)(北京中杉金桥生物科技有限公司)。切片机和包埋机(美国Thermo Fisher公司),光学显微镜(日本Olympus公司)。
1.3 标本制备 1只雄鼠与2只雌鼠合笼,次日清晨观察阴栓,以观察到阴栓计为第0.5天(embryonic day 0.5,E0.5)。当小鼠胚胎分别发育至E13.5、E14.5、E16.5和E18.5时,取雌鼠脱颈处死,取出胚胎,分别为E13.5、E14.5、E16.5和E18.5组,每组5只,分离胚胎小鼠头部于4%多聚甲醛4℃固定24 h后,梯度乙醇脱水,过二甲苯,浸蜡包埋,切片机切片;分离出生后5 d(postnatal day 5,PN5) 小鼠头部 (PN5组,5只),4%多聚甲醛4℃固定24 h后,15%EDTA脱钙液脱钙7 d,梯度乙醇脱水,过二甲苯后浸蜡包埋,切片机切片。
1.4 HE染色观察小鼠牙发育不同阶段牙胚组织形态表现 烤片40 min后,常温下脱蜡至水,苏木精5 min,返蓝,盐酸乙醇分化30 s,伊红20 min,梯度乙醇脱水,二甲苯透明,树胶封片,镜下观察拍照。
1.5 免疫组织化学染色检测小鼠牙胚组织中整合素β1和LAMR1蛋白表达分布情况及表达水平 烤片40 min后,常温下脱蜡至水,流水冲洗5 min,柠檬酸盐95℃抗原修复15 min,冷却至室温后PBS缓冲液冲 洗 5 min×3次, 滴 加 3%H2O2,30 min后PBS缓冲液冲洗5 min×3次,血清封闭1 h,加一抗,4℃过夜,PBS缓冲液冲洗5 min×3次后加二抗,1 h后PBS缓冲液冲洗5 min×3次,加辣根过氧化物酶标记的链霉素抗生物素工作液,20 min后PBS缓冲液冲洗5 min×3次,滴加DAB显色液,中止显色后苏木精5 min,返蓝,后盐酸乙醇分化30 s,梯度乙醇脱水,二甲苯透明,树胶封片,空白对照以PBS缓冲液代替一抗,镜下观察拍照,采用Image Pro Plus软件分析目的蛋白阳性信号平均光密度(IOD/Area)值,代表目的蛋白表达水平。
1.6 统计学分析 采用SPSS 22.0统计软件进行统计学分析。小鼠不同部位牙胚组织中整合素β1和LAMR1蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 E13.5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果 E13.5组小鼠牙胚组织发育处于蕾状期。HE染色:上皮细胞突入到外胚间充质中,形成上皮芽,形状如花蕾,上皮下方和周围的外胚间充质细胞增生,包绕上皮芽,未见细胞分化。免疫组织化学染色:整合素β1在上皮芽内弱表达,上皮芽周围的间充质几乎无表达;LAMR1在上皮芽弱表达,在上皮芽周围间充质和二者交界处即基底膜均有表达。见图1。
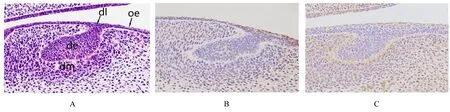
图1 E13.5组小鼠牙胚组织HE染色(A)及整合素β1(B)和LAMR1(C)免疫组织化学染色结果(×400)Fig.1 Results of HE staining(A)and integrin β1(B)and LAMR1(C)immunohistochemical staining of tooth germ tissue in mice in E13.5 group(×400)
2.2 E14.5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果 E14.5组小鼠牙胚组织发育处于帽状期。HE染色:上皮芽继续生长,体积逐渐增大,该上皮称为帽状期成釉器,分为外釉上皮层、内釉上皮层和星网状层;成釉器周围外胚间充质细胞密度增加,形成细胞凝聚区,称为牙乳头。免疫组织化学染色:整合素β1表达于星网状层、内釉上皮和基底膜,表达强度高于蕾状期上皮,在牙乳头和外釉上皮呈弱表达;LAMR1在口腔黏膜上皮和基底膜处表达较强,在内釉上皮、外釉上皮、星网状层细胞胞浆和牙乳头呈弱表达。见图2。
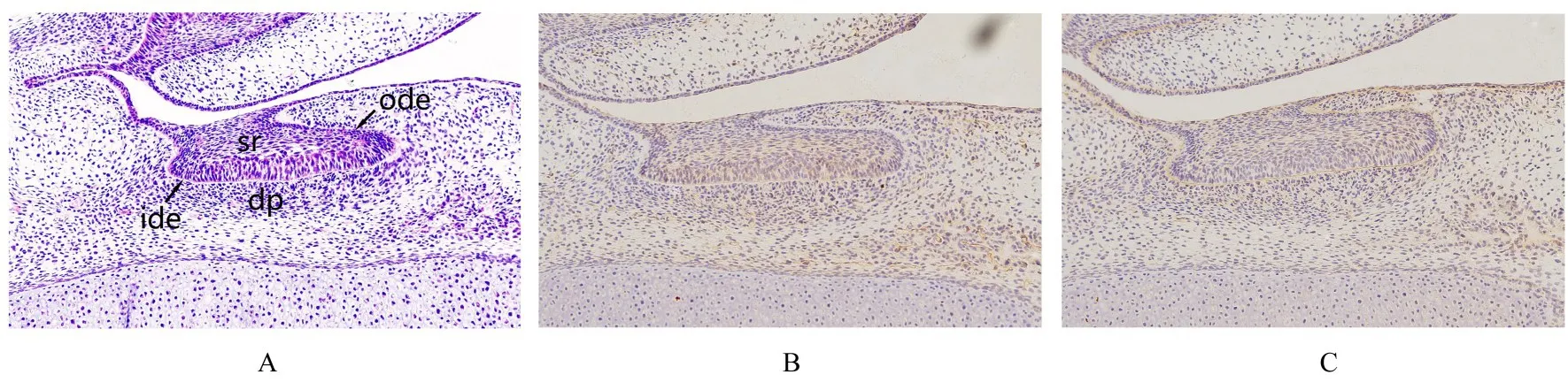
图2 E14.5组小鼠牙胚组织HE染色(A)及整合素β1(B)和LAMR1(C)免疫组织化学染色结果(×200)Fig.2 Results of HE staining(A)and integrin β1(B)and LAMR1(C)immunohistochemical staining of tooth germ tissue in mice in E14.5 group(×200)
2.3 E16.5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果 E16.5组小鼠牙胚组织发育处于钟状早期。HE染色:成釉器进一步长大,形似吊钟,称为钟状期,初步具有牙尖形态,分为外釉上皮层、内釉上皮层、星网状层和中间层。免疫组织化学染色:整合素β1表达于内釉上皮和基底膜,在外釉上皮、星网状层细胞胞浆和牙乳头呈弱表达;LAMR1在内釉上皮、外釉上皮和基底膜均有表达,在星网状层细胞胞浆和牙乳头呈弱表达。见图3。
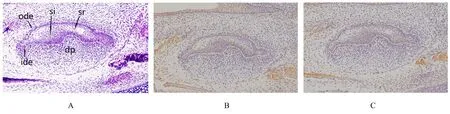
图3 E16.5组小鼠牙胚组织HE染色(A)及整合素β1(B)和LAMR1(C)免疫组织化学染色结果(×200)Fig.3 Results of HE staining(A)and integrin β1(B)and LAMR1(C)immunohistochemical staining of tooth germ tissue in mice in E16.5 group(×200)
2.4 E18.5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果 E18.5组小鼠牙胚组织发育处于钟状晚期。HE染色:成釉器进一步发育,内釉上皮细胞向前成釉细胞分化,形态由立方状变为高柱状。免疫组织化学染色:整合素β1表达于内釉上皮、外釉上皮、靠近成釉细胞的牙乳头细胞和基底膜,在星网状层细胞胞浆呈弱表达;LAMR1在内釉上皮、外釉上皮、靠近成釉细胞的牙乳头细胞和基底膜均有表达,在星网状层细胞胞浆呈弱表达。见图4。
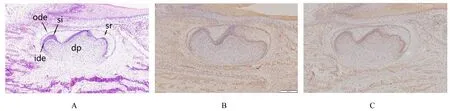
图4 E18.5组小鼠牙胚组织HE染色(A)及整合素β1(B)和LAMR1(C)免疫组织化学染色结果(×200)Fig.4 Results of HE staining(A)and integrin β1(B)and LAMR1(C)immunohistochemical staining of tooth germ tissue in mice in E18.5 group(×200)
2.5 PN5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果 PN5组小鼠牙冠发育完成。HE染色:内釉上皮和外釉上皮相连接处为颈环,2层上皮在颈环处向根方增殖,称为上皮根鞘;上皮根鞘形成向内折的45°弯曲,形成上皮隔;在成釉器与牙乳头交界处的基底膜两侧,具有呈高柱状整齐排列的分化成熟的成釉细胞和成牙本质细胞,已有釉质和牙本质形成,牙冠发育完成。免疫组织化学染色:整合素β1和LAMR1蛋白均在成釉细胞分泌端和成牙本质细胞分泌端广泛表达;牙尖处成熟的成牙本质细胞中整合素β1和LAMR1蛋白表达水平(0.203±0.010和0.174±0.018)高于牙尖之间和牙颈部不成熟成牙本质细胞 (0.152±0.011和 0.158±0.025)(P<0.05);牙乳头细胞中整合素β1和LAMR1蛋白均有表达,但其表达水平均低于成釉细胞和成牙本质细胞(P<0.05)。见图5和表1、2。
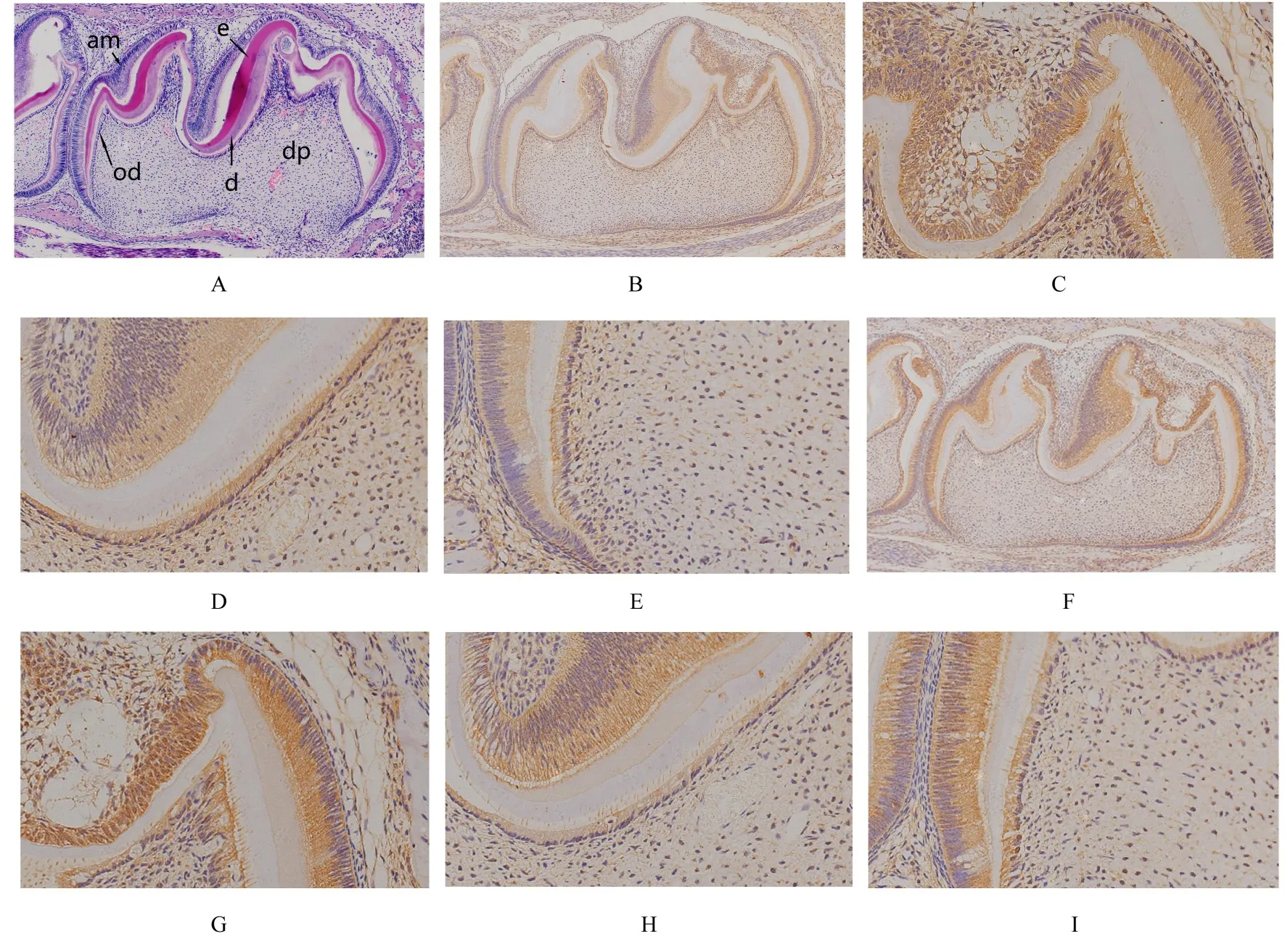
图5 PN5组小鼠牙胚组织HE染色及整合素β1和LAMR1免疫组织化学染色结果Fig.5 Results of HE staining and integrin β1 and LAMR1 immunohistochemical staining of tooth germ tissue in mice in PN5 group
2.6 各组小鼠牙发育不同阶段牙胚组织中整合素β1和LAMR1蛋白表达水平 E13.5组小鼠牙胚组织上皮芽中有整合素β1蛋白表达;E18.5组小鼠牙胚组织外釉上皮细胞中整合素β1蛋白表达水平高 于 E14.5和 E16.5组 (P<0.05); E16.5和E18.5组小鼠牙胚组织星网状层细胞中整合素β1蛋白表达水平高于E14.5组(P<0.05);PN5组小鼠牙胚组织成釉细胞中整合素β1蛋白表达水平高于E14.5、E16.5和E18.5组小鼠牙胚组织内釉上皮细胞/前成釉细胞(P<0.05);PN5组小鼠牙胚组织成牙本质细胞中整合素β1蛋白表达水平高于E16.5和E18.5组小鼠牙胚组织前成牙本质细胞(P<0.05);E13.5、E14.5、E16.5和 E18.5组小鼠牙胚组织牙乳头中无整合素β1蛋白表达,PN5组小鼠牙胚组织牙乳头中有整合素β1蛋白表达。见表1。
表1 各组小鼠牙发育不同阶段牙胚组织中整合素β1蛋白表达水平Tab. 1 Expression levels of integrin β1 in tooth germ tissue at different stages of tooth development of mice in various groups(n=5,±s)
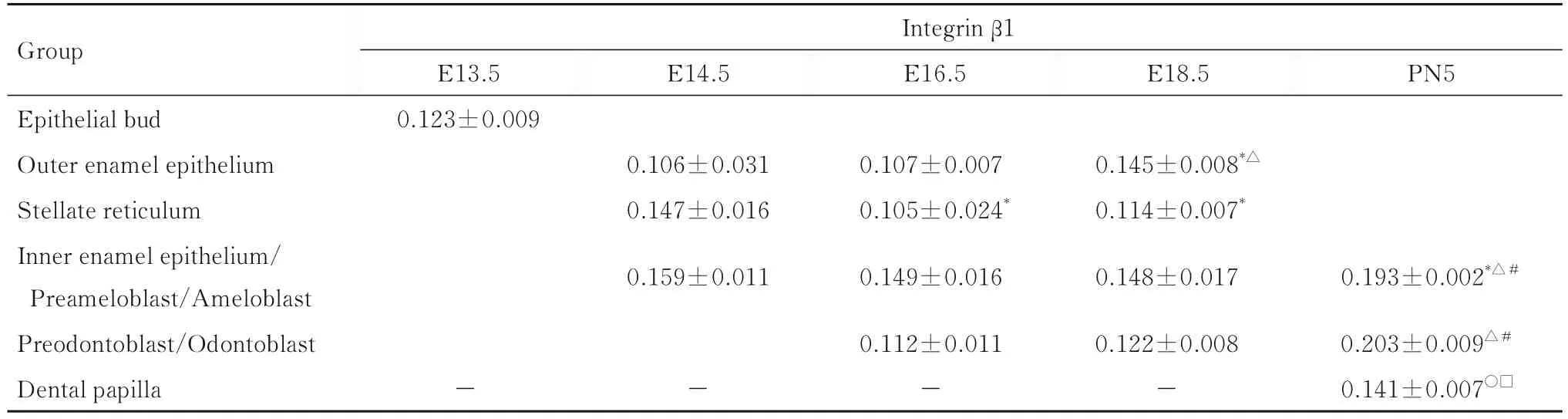
表1 各组小鼠牙发育不同阶段牙胚组织中整合素β1蛋白表达水平Tab. 1 Expression levels of integrin β1 in tooth germ tissue at different stages of tooth development of mice in various groups(n=5,±s)
*P<0.05 vs E14.5 group;△P<0.05 vs E16.5 group;#P<0.05 vs E18.5 group;○P<0.05 vs odontoblast;□P<0.05 vs ameloblast.The blank space indicated that the tissue structure had not formed or disappeared;“-”:Negative expression.
Group E14.5 E16.5 E18.5 PN5 Integrin β1 E13.5 0.123±0.009 0.106±0.031 0.147±0.016 0.107±0.007 0.105±0.024*Epithelial bud Outer enamel epithelium Stellate reticulum Inner enamel epithelium/Preameloblast/Ameloblast Preodontoblast/Odontoblast Dental papilla 0.145±0.008*△0.114±0.007*0.159±0.0110.149±0.0160.148±0.0170.193±0.002*△#0.203±0.009△#0.141±0.007○□--0.112±0.011-0.122±0.008-
E13.5组小鼠牙胚组织上皮芽中有LAMR1蛋白表达;E16.5和E18.5组小鼠牙胚组织外釉上皮细胞中LAMR1蛋白表达水平高于E14.5组(P<0.05);E14.5、E16.5和E18.5组小鼠牙胚组织星网状层细胞中有LAMR1蛋白表达;E16.5、E18.5和PN5组小鼠牙胚组织内釉上皮细胞/前成釉细胞/成釉细胞中LAMR1蛋白表达水平高于E14.5组小鼠牙胚组织内釉上皮细胞(P<0.05);PN5组小鼠牙胚组织成釉细胞中LAMR1蛋白表达水平高于E16.5和E18.5组小鼠牙胚组织内釉上皮细胞/前成釉细胞(P<0.05);E18.5和PN5组小鼠牙胚组织(前)成牙本质细胞中LAMR1蛋白表达水平高于E16.5小鼠牙胚组织前成牙本质细胞(P<0.05);PN5组小鼠牙胚组织成牙本质细胞中LAMR1蛋白表达水平高于E18.5组小鼠牙胚组织前成牙本质细胞(P<0.05);PN5组小鼠牙胚组织牙乳头中LAMR1蛋白表达水平高于E13.5组(P<0.05);E14.5、E16.5和E18.5组小鼠牙胚组织牙乳头中无LAMR1蛋白表达。见表2。
表2 各组小鼠牙发育不同阶段牙胚组织中LAMR1蛋白表达水平Tab. 2 Expression levels of LAMR1 in tooth germ tissue at different stages of tooth development of mice in various groups(n=5,±s)
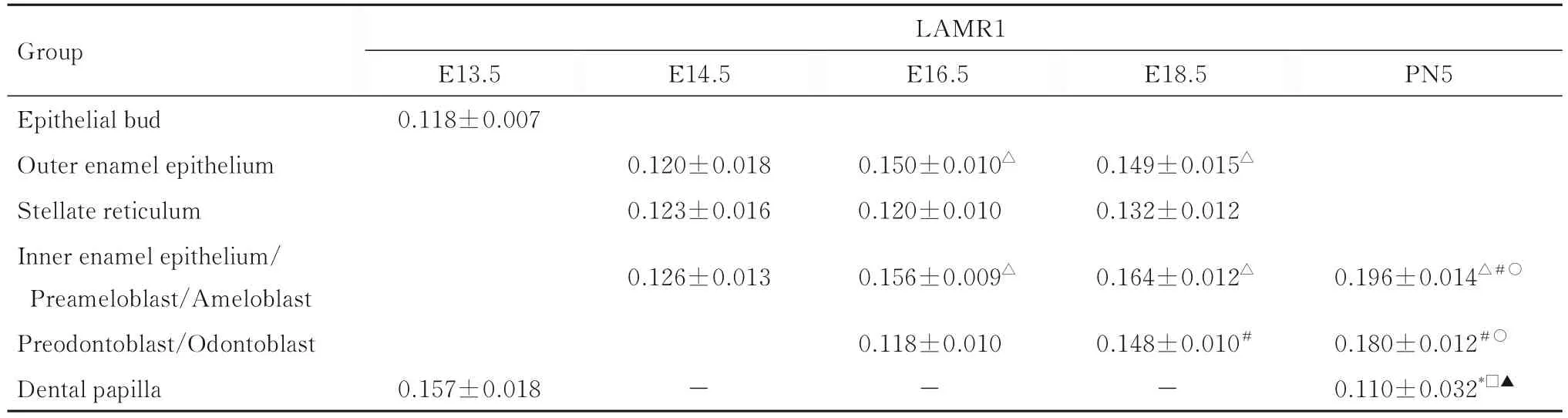
表2 各组小鼠牙发育不同阶段牙胚组织中LAMR1蛋白表达水平Tab. 2 Expression levels of LAMR1 in tooth germ tissue at different stages of tooth development of mice in various groups(n=5,±s)
*P<0.05 vs E13.5 group;△P<0.05 vs E14.5 group;#P<0.05 vs E16.5 group;○P<0.05 vs E18.5 group;□P<0.05 vs odontoblast;▲ P<0.05 vs ameloblast.The blank space indicated that the tissue structure had not formed or disappeared;“-”:Negative expression.
Group E14.5 E16.5 LAMR1 E13.5 0.118±0.007 E18.5 PN5 Epithelial bud Outer enamel epithelium Stellate reticulum Inner enamel epithelium/Preameloblast/Ameloblast Preodontoblast/Odontoblast Dental papilla 0.120±0.018 0.123±0.016 0.126±0.013 0.150±0.010△0.120±0.010 0.156±0.009△0.149±0.015△0.132±0.012 0.164±0.012△0.196±0.014△#○0.180±0.012#○0.110±0.032*□▲0.157±0.018-0.118±0.010-0.148±0.010#-
3 讨 论
整合素家族是与层黏连蛋白相结合的主要受体家族[12]。整合素存在于多种组织中,是一种由α亚基和β亚基通过非共价结合成的跨膜受体[13]。在上皮细胞中,整合素β1与胞外基质结合后复杂的胞内信号通路就会启动,通过Ras相关C3肉毒素底物 1(Ras-related C3 botulinum toxin substrate 1,Rac1)-胰岛素受体酪氨酸激酶底物p53蛋白(insulin receptor substrate protein of53 kDa,IRSP53)途径刺激肌动蛋白骨架的重排,同时也通过Rac1介导的“由内向外”的信号将层黏连蛋白等基质分泌组装至基底膜中,基底膜中的基质又同整合素受体结合,产生“由外向内”的信号,通过整合素连接激酶(integrin-linked kinase, ILK)支架因子建立正确的细胞极性,2个方向的信号形成正反馈系统介导着上皮细胞的增殖、分化和极性形成[14-16]。在上皮细胞中特异性敲除整合素β1后,小鼠牙胚的基底膜断裂破碎,失去正常结构,颈环处最为严重,成釉细胞呈圆形,失去极性,钟状期的牙尖不明显,颈环发育不足,且出生后有釉质发育不良和磨牙迟萌的现象[17-18]。在本研究中,E13.5~PN5,整合素β1在小鼠牙源性上皮中的表达逐渐增强,尤其在PN5成釉细胞的分泌端呈强表达,提示其可能参与成釉细胞的分化和极性的建立。整合素β1在E14.5组小鼠牙胚组织的星网状层细胞中有表达,在E16.5和E18.5组小鼠牙胚组织星网状层细胞中表达降低,提示其可能对于星网状层细胞的分化起到负反馈调节的作用。在E16.5和E18.5组小鼠牙胚组织前成牙本质细胞中,整合素β1弱表达,在PN5组小鼠成牙本质细胞的分泌端表达增强,且在牙尖处较为成熟的成牙本质细胞中的表达强于牙尖之间和牙颈部的尚未完全成熟的成牙本质细胞,提示其可能参与成牙本质细胞的分化和极性的建立。整合素β1在E13.5组小鼠牙胚组织基底膜中无表达,在E14.5、E16.5和E18.5组小鼠牙胚组织基底膜处均有表达,提示其可能参与前成釉细胞和前成牙本质细胞与基底膜的结合,并通过“由外向内”的信号介导细胞极性的建立。本研究结果提示:整合素β1可能介导了细胞外基质信号的转导,并在成釉细胞和成牙本质细胞的分化和极性形成过程中起到重要作用。
层黏连蛋白的非整合素受体主要是LAMR1,又称67LR,同样是一种细胞表面受体,与层黏连蛋白结合后,可以激活细胞外调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 和 c-Jun氨基末端激酶 (c-Jun N-terminal kinase-mitogen,JNK)-MAPK通路,调控细胞的黏附、分化、增殖、迁移和轴突生长[19-21]。在本研究中,LAMR1在E13.5~PN5组小鼠牙胚组织的牙源性上皮中表达逐渐增强,且在PN5组小鼠成釉细胞的分泌端有强表达,提示其可能参与成釉细胞的分化和极性的建立。LAMR1在E13.5组小鼠牙胚组织的牙乳头中有表达,在E14.5、E16.5和E18.5组小鼠牙胚组织的牙乳头中无表达,在PN5组小鼠牙胚组织牙乳头中呈弱表达,提示其可能参与牙胚早期外胚间充质细胞的增殖和聚集以及牙冠发育完成后牙乳头细胞向牙根部牙乳头细胞的增殖和分化。LAMR1在E16.5~PN5组小鼠牙胚组织前成牙本质细胞/成牙本质细胞中的表达逐渐增强,在PN5组小鼠牙胚组织成牙本质细胞的分泌端呈强表达,且在牙尖处较为成熟的成牙本质细胞中的表达强于牙尖之间和牙颈部的尚未完全成熟的成牙本质细胞,提示其可能参与成牙本质细胞的分化和极性的建立。在E13.5~E18.5组小鼠牙胚组织的基底膜处均有LAMR1表达,提示其可能参与前成釉细胞和前成牙本质细胞与基底膜的结合,并通过“由外向内”的信号介导细胞极性的建立。本研究结果提示:LAMR1可能介导了细胞外基质信号的转导,并在成釉细胞和成牙本质细胞的分化和极性形成过程中起到重要作用。
综上所述,整合素β1和LAMR1表达于小鼠磨牙发育不同阶段牙胚组织中的基底膜、内釉上皮/(前)成釉细胞和(前)成牙本质细胞中,二者可能参与细胞外基质信号的转导,并在成釉细胞和成牙本质细胞的分化和极性形成的过程中起到重要作用。但在牙胚组织发育过程中,整合素β1和LAMR1在细胞分化和极性形成中的作用和具体机制尚有待进一步研究。

